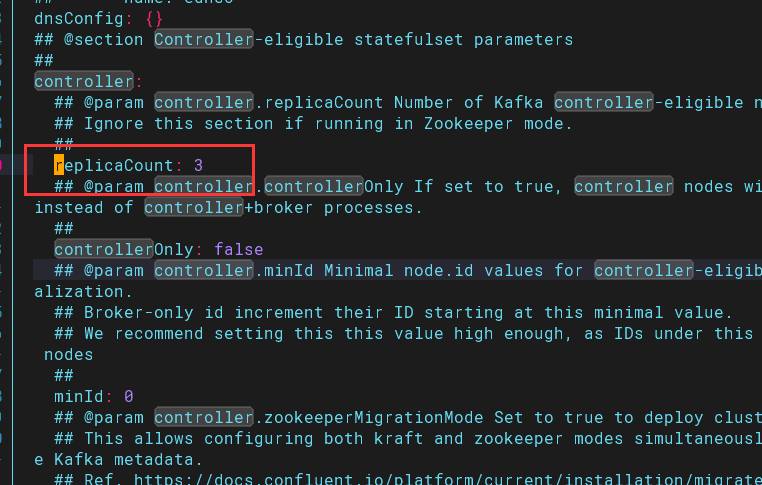
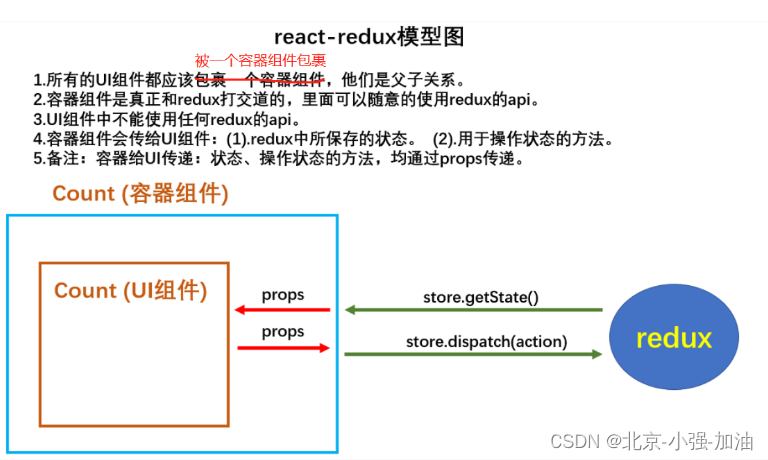
除了新版《体外诊断试剂分类目录》的变化外(见:体外诊断试剂分类目录的变与不变),最值得关心的是:
- 2024版《体外诊断试剂分类目录》发布以后,过渡期多久?
- 当前分类目录背景下如何管理?
- 对在研、已取证、变更的产品,有何影响?
- 2024版《体外诊断试剂分类目录》发布以后,过渡期多久?
- 当前分类目录背景下如何管理?
- 对在研、已取证、变更的产品,有何影响?
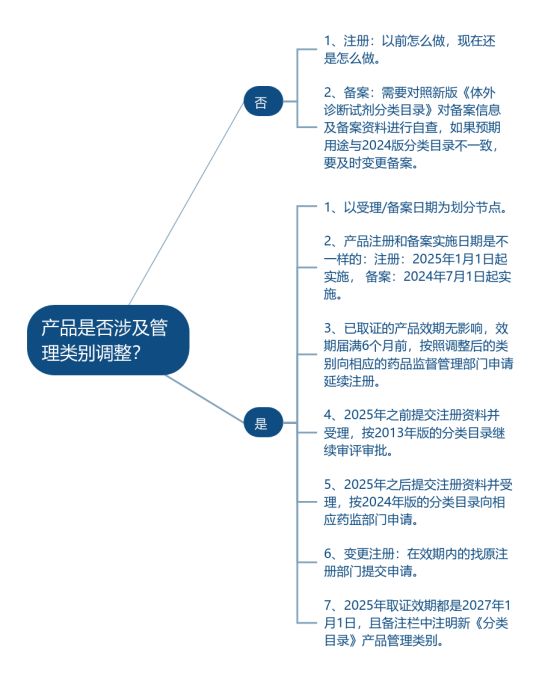
建议
三类→二类 :如果 非必要 ,建议等到2025年实施以后,按照2024年版的分类目录进行申请,注册资料可以直接使用。二类→三类:如果已准备资料,建议尽快提交,并按照三类产品的要求,补充和完善注册资料。如果尚未完成资料,建议直接按照三类产品的要求,修改注册资料。
一类→二类/三类:需要取消备案,并按照改变后的类别向相应药品监督管理部门申请注册。
结语
《体外诊断试剂分类目录》(2024年第58号)的发布,或多或少都会对产品的注册工作量、研发计划、注册时限等方面带来影响。每个企业的情况各不相同,我们可以根据上述流程并结合产品的情况,提前做好预案,尽可能降低分类目录变化对注册工作带来影响。
【参考文献】
[1] 国家药监局关于发布体外诊断试剂分类目录的公告(2024年第58号)
[2]《体外诊断试剂分类目录》及《关于实施〈体外诊断试剂分类目录〉有关事项的通告》解读2024-05-11