目录
T Cell Exhaustion
T 细胞衰竭路径上的细胞和分子路标
研究起源
介绍
T 细胞耗竭的发生路径
耗尽的T细胞亚群的解剖分离和迁移
持续TCR刺激的收益递减
通过共调节受体进行发育微调
细胞因子介导的耗尽T细胞亚群的特异性
T细胞耗竭和表观遗传
T Cell Exhaustion
T Cell Exhaustion - PubMed (nih.gov)
背景:t细胞反应必须平衡,以确保对恶性转化和一系列病原体的充分保护,同时限制对健康细胞的损害并防止自身免疫。T细胞衰竭是一种调节机制,用于限制经历慢性抗原刺激的T细胞的活性和效应功能。衰竭的T细胞表现出较差的增殖能力;高抑制性受体表达;改变转录组、表观基因组和代谢;最重要的是,降低了效应器功能。虽然衰竭有助于抑制自身免疫性疾病中异常T细胞造成的损害,但它也限制了细胞对持续感染和癌症的反应能力,导致疾病进展。

T 细胞衰竭路径上的细胞和分子路标
Cellular and molecular waypoints along the path of T cell exhaustion - PubMed (nih.gov)
研究起源
研究了慢性淋巴细胞性脉络丛脑膜炎病毒(LCMV)感染小鼠期间病毒特异性CD8 T细胞反应的调节。我们的研究表明,在同一持续感染的宿主中,不同的机制可以沉默抗病毒T细胞反应;对一个显性病毒表位特异的CD8 T细胞被删除,而对另一个显性表位有反应的CD8 T细胞无限期存在。这些病毒特异性CD8 T细胞表达活化标志物(CD69(hi)、CD44(hi)、CD62Llo)并在体内增殖,但无法发挥任何抗病毒效应功能。在CD4 T细胞缺乏的情况下,这种无反应的表型更加明显,突出了CD8- CD4 T细胞合作在控制持续感染中的重要性。重要的是,在CD4 T细胞的帮助下,足够的CD8效应子活性得以保持,慢性病毒感染最终得以解决。激活的病毒特异性CD8 T细胞在没有效应功能的情况下持续存在,揭示了一种沉默抗病毒免疫反应的新机制,也为增强慢性感染宿主的CD8 T细胞免疫提供了新的可能性。Viral immune evasion due to persistence of activated T cells without effector function - PubMed (nih.gov)
介绍
长期刺激的T细胞并不简单死亡,而是其增殖和表达效应细胞因子的能力受损。对衰竭特征的进一步研究表明,有限的增殖与抑制TCR信号的抑制性受体(IRs)的表达有关,这有助于开发免疫检查点阻断(ICB)疗法,该疗法使用阻断IR-配体相互作用的阻断抗体来增强内源性T细胞反应。值得注意的是,只有一部分长期刺激的T细胞对ICB有反应,这促使人们最近努力进一步剖析耗尽的T细胞在转录组、表型和表观遗传水平上存在的异质性。最近对T细胞衰竭进展的深入了解正在指导T细胞免疫疗法设计的三种一般模式,以提高免疫保护的效力和持久性:I)防止T细胞衰竭;ii)在命运提交之前延迟或转移T细胞终端衰竭;iii)逆转命运锁定后的衰竭
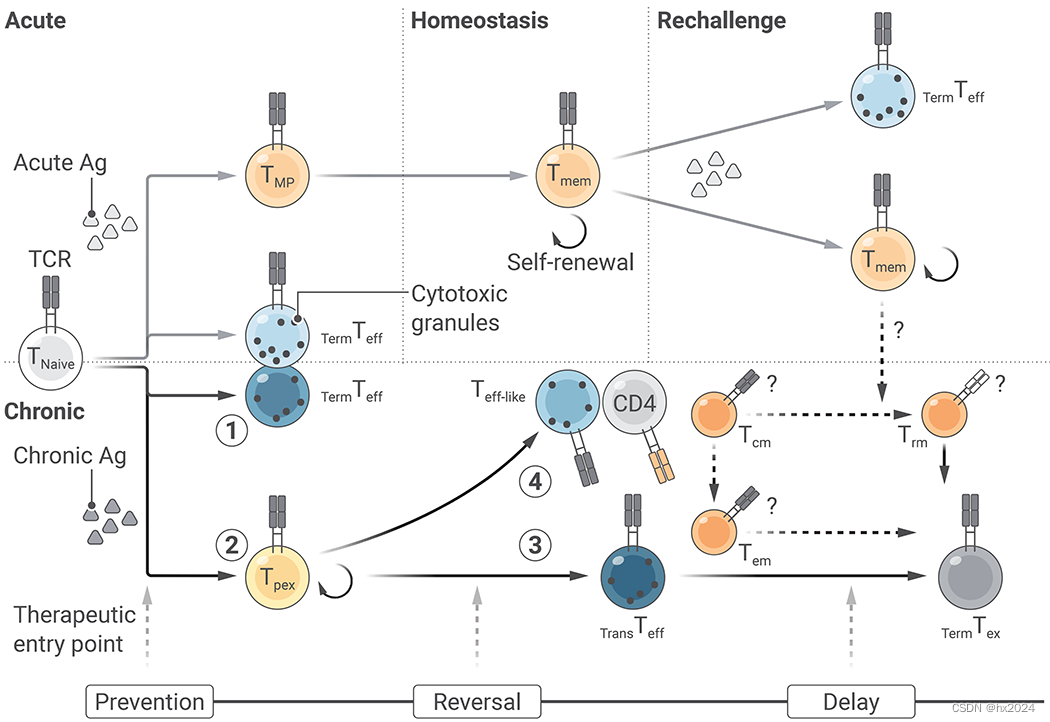
CD8+T 细胞激活后的分化是一个过程,在这个过程中,T 细胞通过连续的细胞状态转换,获得与抗原(Ag)暴露持续时间相适应的特化功能。CD8+T细胞发育路径的第一个主要分叉是成为终末效应细胞,这是一种几乎没有分化潜力的细胞命运(1),与成为保留发育可塑性的前体T细胞相比,后者可进一步分化为长效记忆T细胞(Tmem)(急性抗原暴露期间)或衰竭的祖先T细胞(Tpex)(慢性抗原暴露期间)(2)。CD8+T 细胞对慢性刺激的适应从 Tpex 开始,通过稳定表达 Tox 和 PD-1 促进细胞存活,同时强化具有抑制增殖和杀伤能力的后代 T 细胞。相反,Tmem 的后代则具有更强的效应潜能。在慢性感染后期,由 Tpex 衍生的 Teff 样细胞的命运取决于 CD4+T 细胞的存在。在没有 CD4+T 细胞的情况下,Tpex 衍生的 Teff 样亚群(Tim3+CD101-)是介于 Tpex 和终端 Tex 之间的过渡状态(3)。然而,CD4+ T 细胞可将效应样(CX3CR1+)T 细胞分化为具有卓越细胞毒性的终末分化状态(4)。这两种Teff样亚群是衰竭T细胞池的细胞毒性来源。以上对 CD8+T 细胞分化的概述为针对慢性感染和癌症中的 T 细胞衰竭进行治疗提供了理论依据,其中的主要方向是将 T 细胞从衰竭系分化为更强的效应因子、保留 Tpex 和/或过渡效应因子以延迟 T 细胞的终末衰竭,以及在命运承诺后对衰竭的 T 细胞进行重编程。
T 细胞耗竭的发生路径
当暴露于慢性抗原时,CD8+ T 细胞会逐渐减少其效应反应,以平衡免疫保护和免疫病理。这种对 T 细胞功能的逐步抑制导致了 T 细胞发育潜能的变化,从能够产生治疗反应到完全不活跃。要使基于 T 细胞的免疫疗法达到最佳疗效,关键是要确定 CD8+T 细胞进入衰竭细胞系的时间点。利用克隆 13 LCMV 慢性病毒感染小鼠模型对内源性和被收养转移的 T 细胞进行纵向分析,可以初步了解 T 细胞在衰竭过程中经历的渐进变化。LCMV 特异性 CD8+T 细胞表现出渐进式抑制和分级效应多功能丧失,其特点是最初 IL-2 表达丧失,随后是 TNFa,最后是 IFNg(15)。此外,从感染后 8 天的小鼠体内分离出的病毒特异性 CD8+T 细胞与后期分离出的 CD8+T 细胞相比,保留了更大的记忆潜能(16)。尽管未感染的小鼠在二次挑战前休息了很长时间,但在慢性 LCMV 感染效应反应高峰后分离的 CD8+T 细胞仍保留了 T 细胞衰竭的表型和功能特征(17)。在诱导性小鼠肝脏肿瘤模型中也观察到了这种长期受刺激的 T 细胞逐渐丧失发育可塑性的现象,来自恶性病变前期和早期的肿瘤特异性 CD8+T 细胞在转移到无抗原宿主体内后,能够恢复效应功能并获得记忆表型。相比之下,肿瘤植入 30 天后分离的 T 细胞未能重新获得效应潜能,而且无论 PD-1 是否阻断,都会保留多种 IR 的高表达(18)。总之,这些开创性的研究表明,功能记忆与衰竭状态的划分发生在免疫反应的早期,并通过持续的 TCR 刺激和暴露于免疫抑制组织环境而得到加强。
耗尽的T细胞亚群的解剖分离和迁移
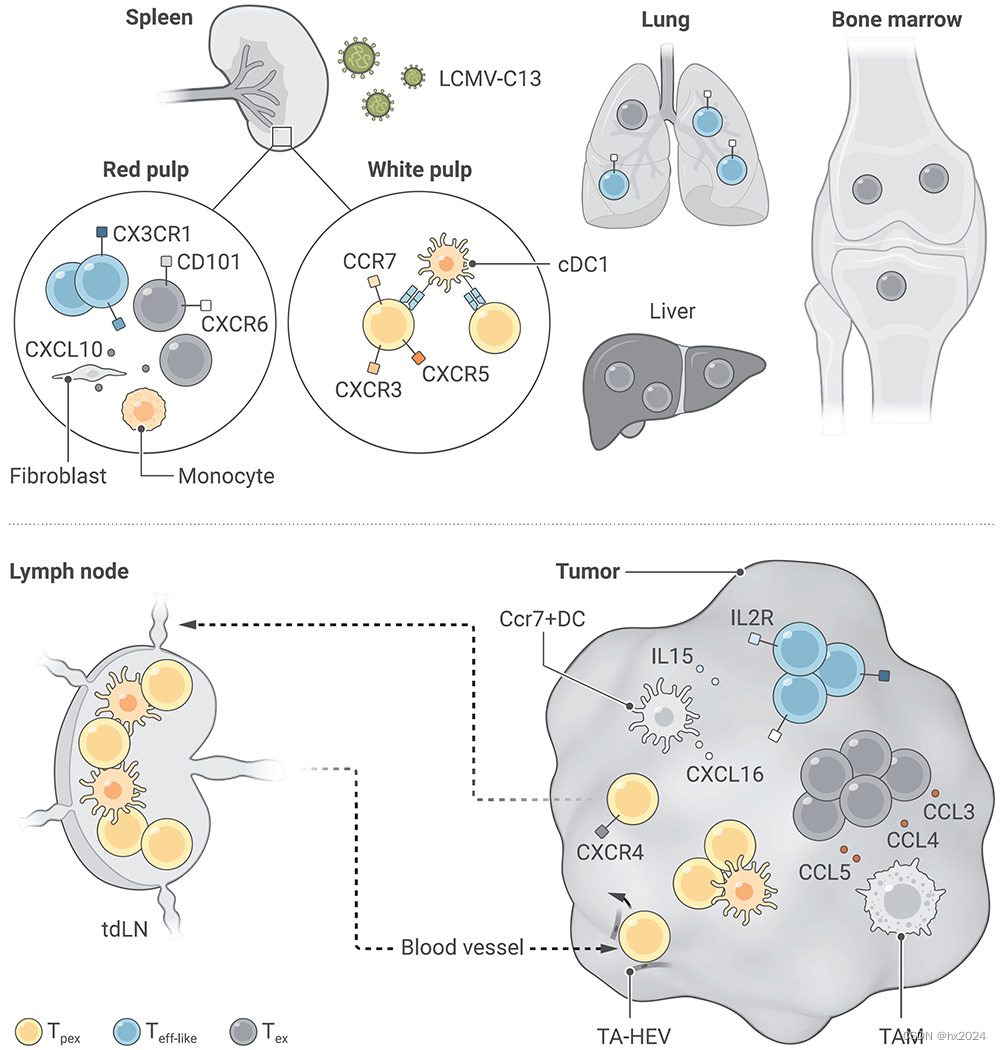
在慢性病毒感染中,Tpex 通过 cDC1 维持在脾脏的白髓,并通过 CXCR3 和 CXCL9/10 信号转导到红髓,在那里进一步分化为过渡效应细胞,并最终分化为终末衰竭 T 细胞。不同衰竭亚群在不同组织中的分布也各不相同。CX3CR1+效应子样亚群主要存在于肺、脾和血液中,而终末衰竭亚群(CX3CR1-CXCR6+)则富集于肝脏,在肝脏中抗原特异性 T 细胞的表型最为一致。在肿瘤环境中,Tpex 在肿瘤引流淋巴结中生成并维持,淋巴结是维持瘤内 Tpex 的储库。通过肿瘤相关的高内皮静脉(TA-HEV)是外渗进入肿瘤的关键入口。到达肿瘤部位后,CD8+ T 细胞会与各种抗原递呈细胞和肿瘤相关巨噬细胞(TAM)相互作用。具体来说,APC-T 细胞区存在于肿瘤中,对维持肿瘤浸润 Tpex 至关重要。CCR7+DCs是CXCR6+效应因子在肿瘤中存活所不可或缺的。衰竭的 T 细胞可分泌 CCL3/4/5 等趋化因子,积极招募单核细胞,使其分化为抑制性 TAM,促进 CD8+T 细胞的终末衰竭。CXCR4+Tpex可通过肿瘤相关淋巴管(TA-LV)排出肿瘤,并转移到肿瘤排泄淋巴结。
持续TCR刺激的收益递减
CD8+T细胞衰竭产生的空间和时间阶段,通过一系列精心安排的细胞接触,结合了来自TCR、共刺激和细胞因子的信号。这些信号中的每一个信号是如何促进祖细胞和终末衰竭 T 细胞之间的发育转变的,这为我们深入了解 T 细胞亚群之间的世系关系以及支配它们在不同阶段之间转变的下游信号提供了重要的视角。在这些信号中,人们一致承认 TCR 信号对衰竭的发展至关重要。一项早期研究对慢性感染期间衰竭 T 细胞的维持机制进行了调查,结果表明,当被收养转移到天真宿主或表位突变病毒感染宿主体内时,衰竭 T 细胞未能持续存在(64)。后来,通过研究衰竭 T 细胞分化的不同阶段对 TCR 参与的要求,对衰竭 T 细胞的这种抗原依赖性维持进行了改进。具体来说,采纳性转移研究表明,Tpex 可以在没有抗原的情况下存活很长时间(17)。此外,再次暴露于同源抗原是启动 Tpex 分化为终末衰竭 T 细胞的必要且充分条件(22)。虽然这些研究表明 Tpex 的维持与抗原无关,但长期 TCR 参与对 Tpex 自我更新能力的影响仍有待全面阐明。
通过共调节受体进行发育微调
使用具有单一 TCR 特异性的工程 T 细胞表明,所观察到的群体动态不能用 TCR 复合物之间的异质性来解释,并强调了共刺激和细胞因子信号转导的重要性。现在,人们已经对增强或减弱 T 细胞活化的成本刺激和 IRs 的广泛网络进行了详细描述。这种激活和/或抑制信号的组合取决于专业 APC 和非常规抗原呈递体(如肿瘤细胞或基质细胞)上的配体。虽然共刺激受体在 T 细胞启动过程中的作用已得到深入研究,但它们在衰竭发展过程中的亚群分化功能还不完全清楚。协同刺激配体-受体对包括多种成员,其中包括特征明显的 CD28 和肿瘤坏死因子受体(TNFR)超家族。新出现的证据描述了 CD28 和 ICOS 在 CXCR5+Tcf1+ CD8+T 细胞中的富集,这促使人们进一步研究共刺激受体在不同衰竭状态之间的转换中所起的作用,以及这些受体对 CD8+T 细胞对 PD-1 阻断反应的影响(74)。具体来说,CD8+T 细胞中 CD28 的特异性缺失会在 PD-1 阻断后大大影响其增殖。与这些发现相一致的是,接受 PD-1 治疗的肺癌患者的循环 CD28+T 细胞群体占主导地位(74,75)。根据对 ICB 反应性人群产生于分化较低状态的观察,CD28 可能是促进 Tpex 最终分化以产生 Teff 样细胞和/或扩增 Teff 样亚群的关键,这一点最近已在肿瘤环境中得到证实(76)。
细胞因子介导的耗尽T细胞亚群的特异性
TGFb 曾被描述为慢性感染和肿瘤发生过程中的免疫抑制细胞因子(110,111),现在人们认识到 TGFb 对 T 细胞分化的影响是阶段性的。最近的研究重新审视了 TGFb 信号在新定义的衰竭亚群中的作用,发现 TGFb 在通过淋巴组织保留和作为 mTOR 活性调节剂保存 Tpex 方面具有关键作用(112-115)。据观察,TGFb 的抑制功能可在启动过程中促进 Tpex 的形成,同时损害由 Tpex 衍生的 Teff 样细胞的效应潜力(114,115)。同样,有报道称 1 型干扰素(IFN-I)在慢性病毒感染的不同衰竭阶段发挥着相反的作用。在研究中,如果在感染早期施用 IFN-I,T 细胞扩增就会增强,最终有助于改善病毒控制(116-118)。然而,在感染晚期使用 IFN-I 会促进 CD8+T 细胞终末衰竭,最近的研究表明这种衰竭是由 IFN 诱导的转录因子(Irf2)介导的(119)。对 IFN-I 信号传导的 CD8+T 细胞内在作用的进一步研究表明,Tpex 的形成受到 IFNAR1 介导的信号传导的抑制(120)。这些发现共同强调了通过 IRs 和细胞因子发出的抑制信号在维持衰竭的祖细胞和提供针对慢性抗原的长期保护方面的重要性。
T细胞耗竭和表观遗传
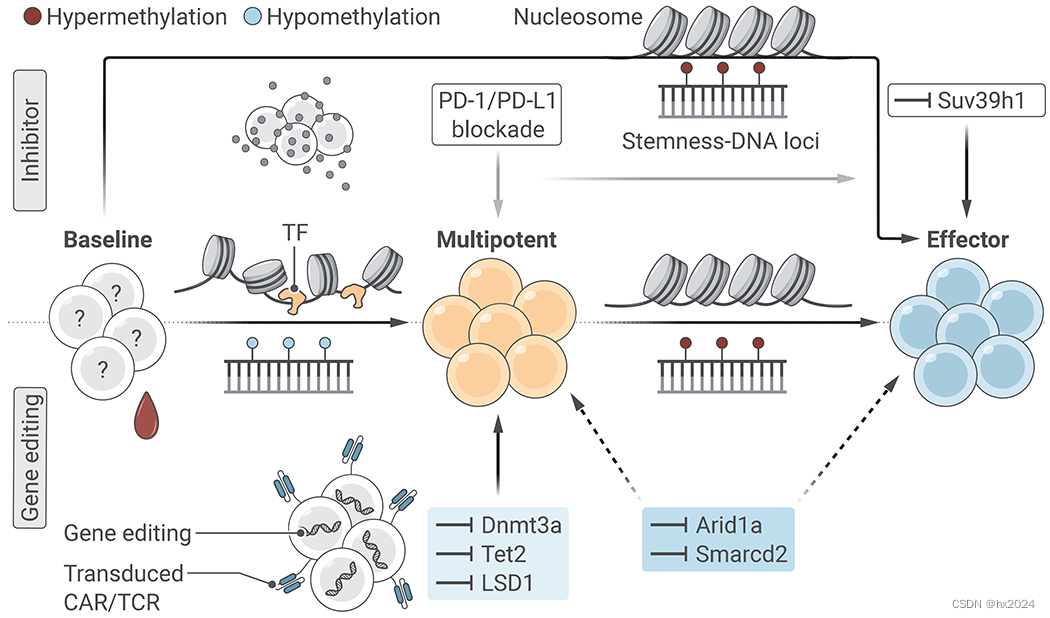
将表观遗传编程转化为癌症免疫疗法。
在天真或干样祖细胞向效应细胞的末期分化过程中,CD8+T细胞会获得全新的表观遗传学程序,其中与干性相关的基因座会通过DNA甲基化和染色质重塑受到抑制。同样,在衰竭发展过程中,效应相关基因座也会受到抑制。阻断限制T细胞干性和效应潜能的表观遗传学程序的获得是一个重要的治疗机会。在采用细胞疗法的方法中,可以对自体或异体T细胞进行基因工程改造,或使用能破坏表观遗传酶催化功能的化学物质对其进行修饰。表观遗传阻断 "衰竭的例子包括删除 Dnmt3a 或 Tet2 以维持祖 T 细胞,从而加强对肿瘤的控制。在 LCMV 特异性 CD8+T 细胞中删除 LSD1 也能促进 Tpex 的富集,并提高对抗 PD-1 的反应。cBAF 成分 Arid1a 和 Smarcd2 也有助于 CD8+T 细胞分化衰竭,可能成为治疗靶点。
文献:
1:T Cell Exhaustion。DOI: 10.1146/annurev-immunol-090222-110914
2:Viral immune evasion due to persistence of activated T cells without effector function
:3:Cellular and molecular waypoints along the path of T cell exhaustion
补充:Signatures of T cell dysfunction and exclusion predict cancer immunotherapy response | Nature Medicine