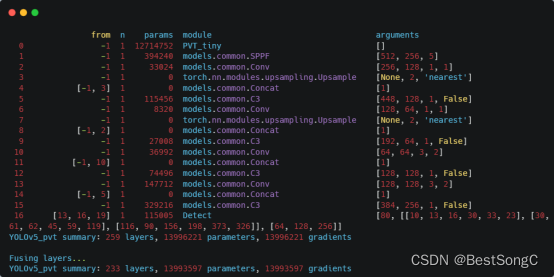
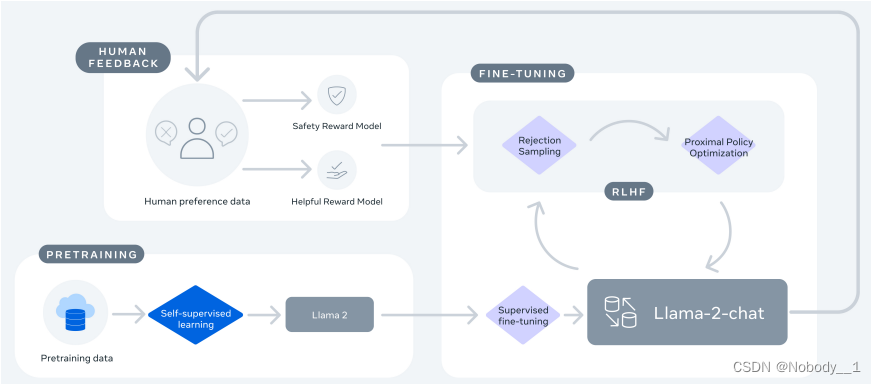
一、什么类型的医疗器械需要递交网络安全文件?
FD&C法案第524B条(c) 条将“网络设备”定义为:
1)经申请人验证、安装或授权的软件或设备;
2)具备连接互联网的能力;
3)包含经申请人验证、安装或授权的可能容易受到网络安全威胁的技术特征。
最新草案中列举了(包括但不限于)能够连接到互联网的以下设备:
- Wi-Fi或蜂窝网络
- 网络、服务器或云服务提供商连接
- 蓝牙或低功率蓝牙
- 射频通信
- 感应通信
- 能够连接互联网的硬件连接器(如USB、以太网、串口)
根据FD&C法案第524B(a)节,任何人(包括制造商)以510(k)路径提交符合524B (c)中“网络设备”定义的产品的上市前申请,均需递交相关网络安全资料,以自证确保该设备符合FD&C法案第524B (b)中关于网络安全的要求。
二、需要提交什么样的网络安全文件?
制造商必须提供符合FD&C法案第524B条要求的文件,具体包括:
- 合理的时间内监控、识别和解决关于上市后网络安全漏洞的计划,以及包括协调一致的漏洞披露(CVD)和相关程序
- 合理保证的设计、开发和维护流程和流程
- 提供Software Bill of Materials (SBOM),即软件材料清单,包括商业、开源和现成的软件组件。
细化的文件类型包括(供参考):

具体需提交的网络安全文件需针对不同医疗器械产品进行个性化评估,可了解:FDA网络安全评估方案![]() https://link.zhihu.com/?target=https%3A//work.weixin.qq.com/ca/cawcde5ee29d239046
https://link.zhihu.com/?target=https%3A//work.weixin.qq.com/ca/cawcde5ee29d239046