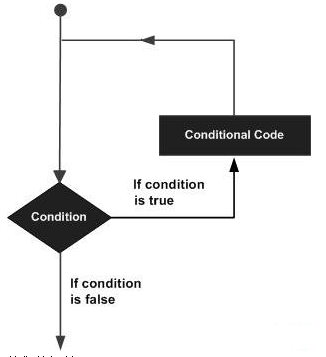
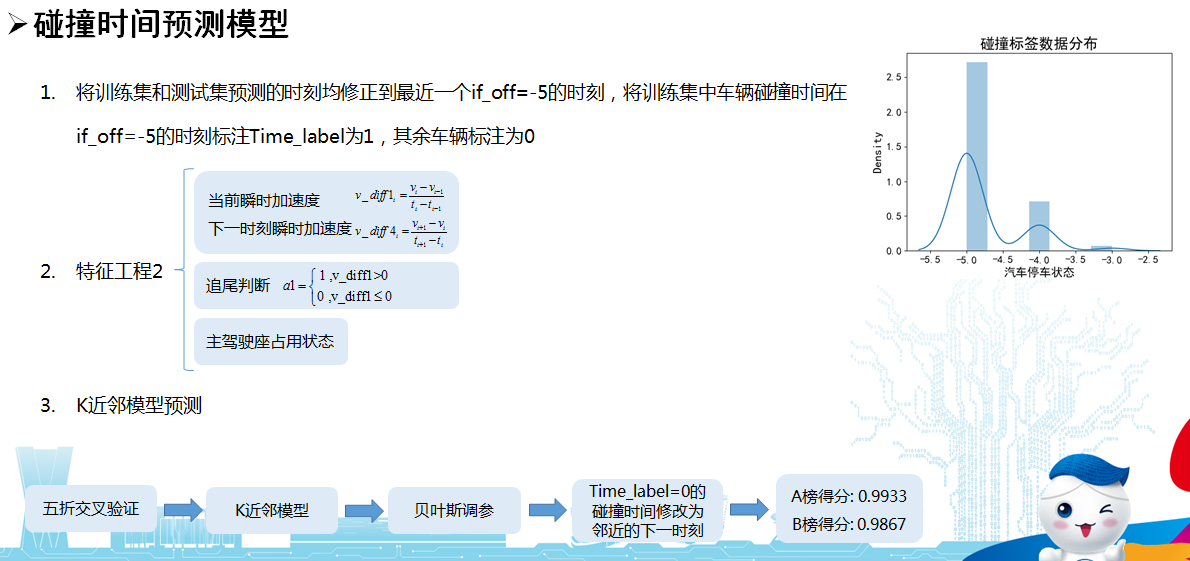
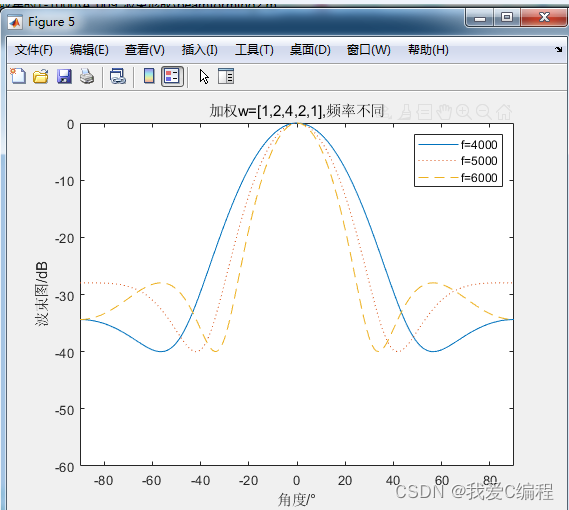
2019 年 8 月 8 日,来自美国 NIH 的 Rafael Casellas 与科罗拉多大学 Francisco J. Asturias 在 Cell 杂志上发表文章 《A Pliable Mediator Acts as a Functional Rather Than an ArchitecturalBridge between Promoters and Enhancers》,综合运用 CRISPR-Cas9 筛选系统、降解子实验、Hi-C 和冷冻电镜等技术研究了哺乳动物 Mediator(mammalian Mediator,mMED)的功能和结构,揭示了 mMED 尾部模块与核心模块的构象影响 mMED-Pol II 相互作用。该研究的另一亮点是揭示了虽然Mediator 在功能上联系着启动子和增强子,但与传统的认识不同的是,启动子与增强子空间上的联系主要是由 cohesin 发挥的。

图1.文章亮点
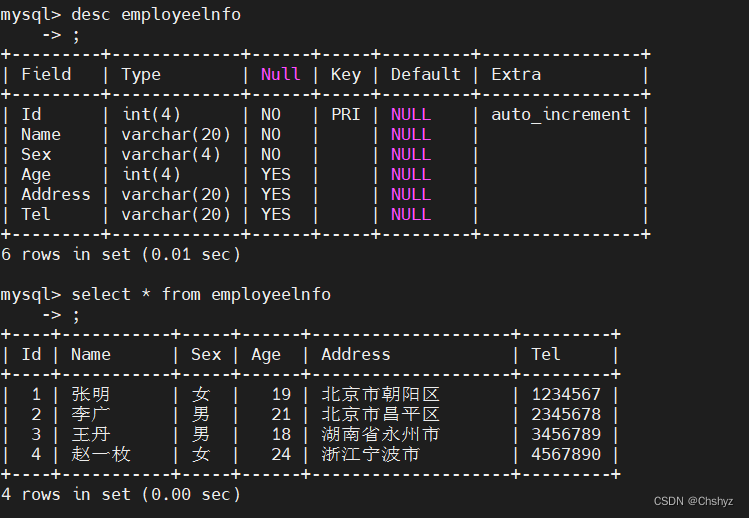
研究团队首先运用冷冻电镜技术解析了哺乳动物 Mediator(mMED)复合物的结构,整体分辨率达到 5.9 埃。为了探究 mMED 的功能,研究团队利用 CRISPR-Cas9 在小鼠细胞中敲除 Mediator 各亚基进行分析。其中 mMED 中对细胞存活是非必需的,又不属于尾部模块的亚基,敲除后仅干扰小部分的基因表达。诱导性敲除骨架亚基 MED14 导致整个 Mediator 的失活,细胞周期停止,细胞变小,RNAseq 显示转录组整体性下调,下调~7倍。mMED14 的敲除导致Pol II 和 PolII-S5 信号显著降低,与 Mediator 能够招募并磷酸化 PolII 的功能相一致。Mediator 复合物对哺乳动物细胞的总体 PolII 招募和转录组扩增都是必需的。
敲除尾部模块(non-essential)的亚基,发现随着亚基敲除数量的增加,被影响表达的基因数量增加。被调控基因的启动子平均与 10 个 H3K27Ac+H3K4me1+增强子相关,没有被调控的基因只有 6 个,说明 mMED 尾部在转录因子(TFs)和Pol II 间形成了一个功能性的桥梁。同时,mMED 尾部模块的缺陷导致 mMED-Pol II 或者 mMED-CKM 相互作用的增加。
最后,进一步研究Mediator在启动子-增强子(P-E)相互作用过程中的功能。Mediator 或 Pol II(敲除其最大亚基RBP1)敲除显著降低 Mediator、PolII 在受调控 DNA 的分布,敲除 cohensin 蛋白 RAD21不影响Pol II、MED26 的招募,但显著降低 P-E、P-P 相互作用。
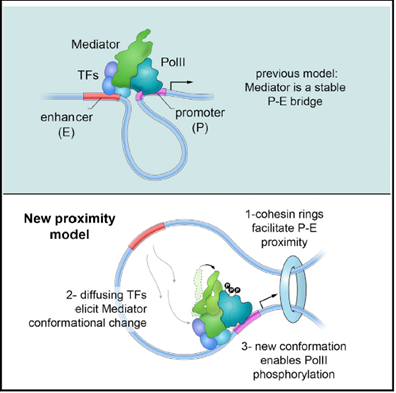
图2.文章机制图
研究进一步证明 Mediator 通过间接方式调控染色体的拓扑结构,即Mediator影响 DNA 甲基化和其他表观遗传修饰,调控染色体可接近性(accessibility),进而调控 architectural protein 的招募,染色体的拓扑结构。
来自美国宾夕法尼亚大学的研究人员在同期 Cell 杂志上发表文章《MolecularStrategies of Meiotic Cheating by Selfish Centromeres》。雌性减数分裂的不对称分裂产生了选择性压力,有利于自私的着丝粒,使它们偏向于向卵子传递。研究人员定义了一个分子通路,将扩大的着丝粒与组蛋白磷酸化和微管不稳定因子的募集联系起来,导致自私的着丝粒从纺锤体微管中分离出来,从而将它们导向极体。利用种间着丝粒的分化,我们证明了自私的着丝粒存在于两个杂种中小鼠模型使用相同的分子途径,但调节方式不同,以丰富不稳定因素。在这两种模型中,增加微管的失稳活性是一种普遍的驱动策略,但是中心体已经进化出了不同的机制来增加这种活性。此外,研究人员还发现了驱动依赖于减数分裂进程的放缓的现象,这表明可以通过调节减数分裂的时间来抑制自私的着丝粒哦~
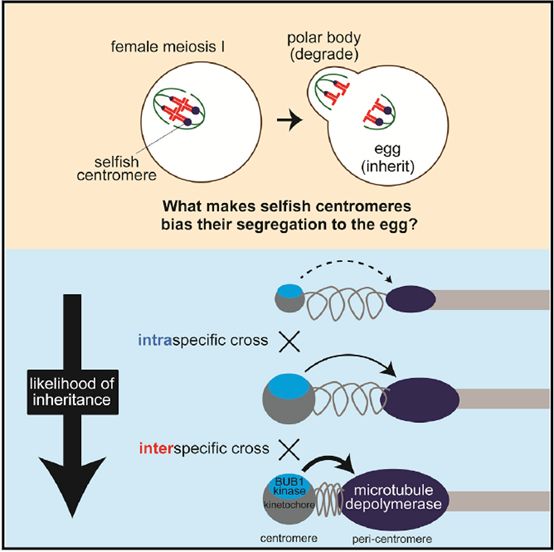
图3.文章机制图
原文链接
https://doi.org/10.1016/j.cell.2019.07.001