上次我们介绍了>>《制药机械(设备)计算机化系统验证指南》,本期我们就来展开讲讲制药企业为什么需要以及如何进行计算机化系统验证。
计算机化系统验证(Computerized Systems Validation,简称CSV)是一种确保计算机化系统在药品生产、医疗设备和相关行业中正常、可靠、合规运行的验证过程。CSV的目标是验证计算机化系统的稳定性、可靠性和合规性,以确保系统能够有效地支持关键业务流程,并满足相关法规和标准的要求(如《药品生产质量管理规范》,Good Manufacturing Practice of Medical Products,简称GMP)。随着科技的进步,制药企业在生产过程中越来越多地依赖计算机化系统。它覆盖了制药企业从生产到销售的流程,对药品质量的把控以及患者的生命安全保障起到了关键的作用。
制药企业为何需要CSV
1. 合规性要求:制药企业必须遵守国家和国际的法规和标准,如GMP。计算机化系统验证是确保企业符合这些要求的关键步骤之一。验证过程能够证明系统的设计、实施和操作符合相关法规要求,以确保产品质量和患者安全。
2. 数据完整性保障:数据完整性是制药行业的核心要求之一。计算机化系统验证通过测试数据审计追踪、用户访问权限、电子签名等功能,有效防止数据造假、篡改或丢失,确保数据的完整性和可靠性。
3. 风险管理:制药企业面临着许多潜在的风险,如生产过程中的错误、系统故障、数据泄露等。计算机化系统验证有助于识别和评估这些风险,并采取相应的控制措施,以减少风险对企业运营和产品质量的影响。

图.制药企业生产车间(iStock)
制药企业CSV面临的挑战
1. 复杂性和多样性:制药企业的计算机化系统通常是复杂的,涉及多个模块和功能。验证这些复杂系统需要专业的知识和技能,以确保验证过程的全面性和准确性。
2. 技术更新:科技的快速发展导致计算机化系统的更新频率加快,制药企业需要及时适应新技术并进行验证。因此,企业需要建立有效的变更管理和验证更新的机制,以确保系统在更新后仍能符合法规和标准的要求。
3. 资源限制:计算机化系统验证需要投入大量的时间、人力和财力资源。对于一些中小型制药企业来说,资源限制可能成为制约验证工作的因素。企业需要合理规划资源,并寻求合作伙伴的支持,以确保验证工作的顺利进行。
制药企业如何进行CSV
制药企业可以采取以下步骤来进行计算机化系统验证,更多详情可查看>>如何满足计算机化系统验证(CSV):制药企业的指南
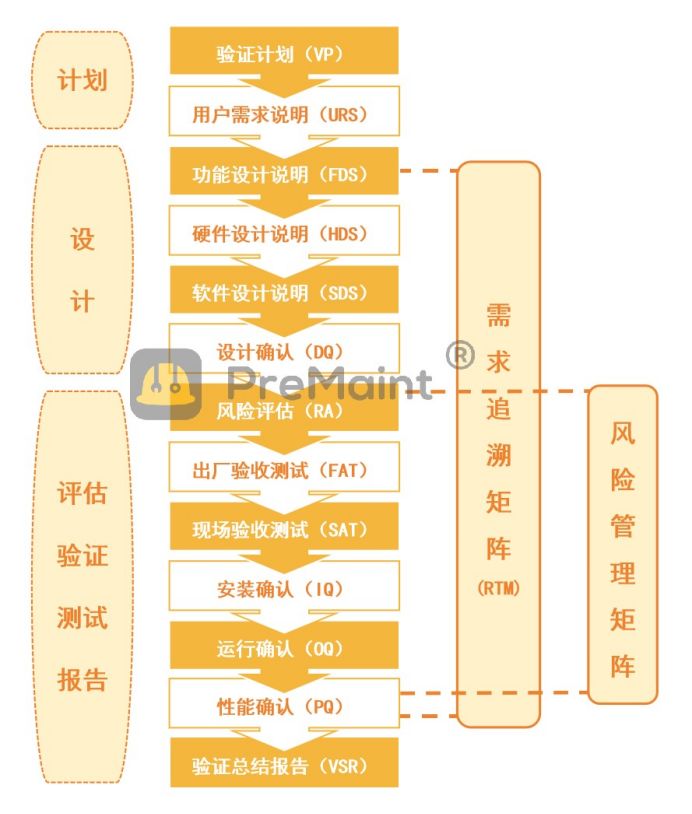
图.计算机化系统验证基本流程(PreMaint)
1. 明确范围和制定计划:根据企业的需求和法规要求,确定验证的范围、目标和时间表,制定验证策略和计划,明确验证所需的资源和预算。
2. 编制验证文档:编制验证所需的文档,如:验证计划(VP)、用户需求说明(URS)、功能需求说明(FDS)等。这些文档应包含系统的基本业务需求、功能要求、安全性要求、数据完整性要求等信息。
3. 进行验证测试:根据验证计划和验证文档,执行相应的验证测试进行确认。包括:设计确认(DQ)、出厂验收测试(FAT)、现场验收测试(SAT)、安装确认(IQ)、运行确认(OQ)和性能确认(PQ)等。验证测试应覆盖系统的各个方面,确保系统符合设计要求、安装正确、运行稳定,并在正常生产环境下有效工作。
4. 数据完整性测试:进行数据完整性测试,包括数据审计追踪、用户访问权限、电子签名、数据备份等方面的测试。确保系统能够满足数据完整性的要求,防止数据造假、篡改或丢失等问题。
5. 记录和报告验证结果:记录验证过程和测试结果,并编制验证报告,如:验证总结报告(VSR)。验证报告应详尽、准确地反映系统的验证状态和符合性。报告中还应包含发现的问题和解决方案等信息。
计算机化系统验证对制药企业来说至关重要。通过进行验证,制药企业能够确保系统的合规性、数据的完整性,并有效管理潜在的风险。
想要进一步了解设备健康管理平台如何帮助企业进行计算机化系统验证(CSV)?
-关注我,不错过工业互联网&设备管理领域的最新资讯、深度干货!
-如果对本文有任何疑问,或想了解更多内容,欢迎评论留言/发送私信告诉我~