虹科分享 | 超低温冷冻箱温度分布验证的9步指南
背景:
在生物制药行业,温度分布验证是确保对时间和温度敏感的产品在保证质量和安全的条件下储存和运输的关键步骤。这对于超低温冷冻箱尤为重要,因为超低温冷冻箱用于在低于 -60℃ 的温度下储存对温度敏感的材料。以下指南提供了超低温冷冻箱温度分布验证的分步说明。

超低温冷冻箱的温度分布验证流程:
要完成一项超低温冷冻箱温度分布验证流程,从审查相关文件和规定到编写总结报告,总共可分为9个步骤。分别为
1审查相关准则和规定→2指定验证计划→3生成验证方案→4准备好冷冻箱和验证仪设定好相应参数→6将温度验证设备放入冷冻箱→6执行温度分布验证程序→7分析和解读温度分布验证数据→8纠偏→9编写总结报告,完成验证流程。
本指南可适用于任何受控温度设备的温度分布验证,而不仅仅是超低温冷冻箱。只需将 "超低温冷冻箱 "换成您要进行温度分布验证的特定受控温度设备类型即可。无论对哪种类型的设备进行温度分布验证,都适用相同的综合流程和注意事项。

分步细节:
Step1 审查相关准则和规定
在温度分布验证程序开始之前,了解适用于你的超低温冷冻箱的相关准则和规定非常重要。这将有助于确保温度分布验证过程符合规定,对于验证结果也有重要意义。
Step2验证计划
在进行温度分布验证之前,必须制定全面的验证计划。这可能涉及定义验证过程的范围和目标,包括最坏情况,确定所需的资源和人员,并确定可能需要应对的任何潜在风险或挑战。
Step3生成验证方案
制定了验证计划,下一步就是制定详细的验证方案。该方案应概述进行温度监测过程所涉及的步骤,包括温度监测仪器的放置、收集和分析温度数据的方法以及任何必要的质量控制措施。
Step4为超低温冷冻箱温度分布验证做准备
在进行温度分布验证之前,必须为超低温冷冻箱做好准备,在处理和准备超低温冷冻箱时始终使用适当的个人防护设备(PPE),以确保安全。此过程包括清洁冷冻箱、移除所有储存的材料,并确保冷冻箱经过适当校准且运行正常。

Step5将温度分布验证仪器放入超低温冷冻箱
验证方案就绪后,就可以在冷冻箱中放置温度分布验证仪器了。这可能涉及到按照预定的网格在整个冷冻箱的不同位置放置温度数据记录仪或热电偶,包括顶部、底部和侧面,以及门内和所有通风口附近。此外,在开始验证程序之前,应将冷冻箱稳定一段时间。
布点方案推荐
典型设置 :8 个在角落,1 个在中间 *如果适用,请勿忘记在显示、控制和监控探头旁边放置附加传感器。
Step6执行温度分布验证程序
温度分布验证仪器就位后,就可以执行温度分布验证程序了。这可能需要在几个小时甚至几天的时间内收集温度数据,具体取决于操作或设备的具体要求和正在评估的存储区域。
控温装置(CTUs):
-持续时间:24小时
-原因:CTU需要24小时的监测时间,以捕捉多个温度周期,确保温度保持稳定。
Step7分析和解读温度分布验证数据
温度分布验证程序完成后,就需要对收集到的数据进行分析和解释。这可能需要生成报告和图表,显示整个超低温冷冻箱的温度分布,并找出冷冻箱中不符合温度范围要求的任何区域,并找出根本原因。
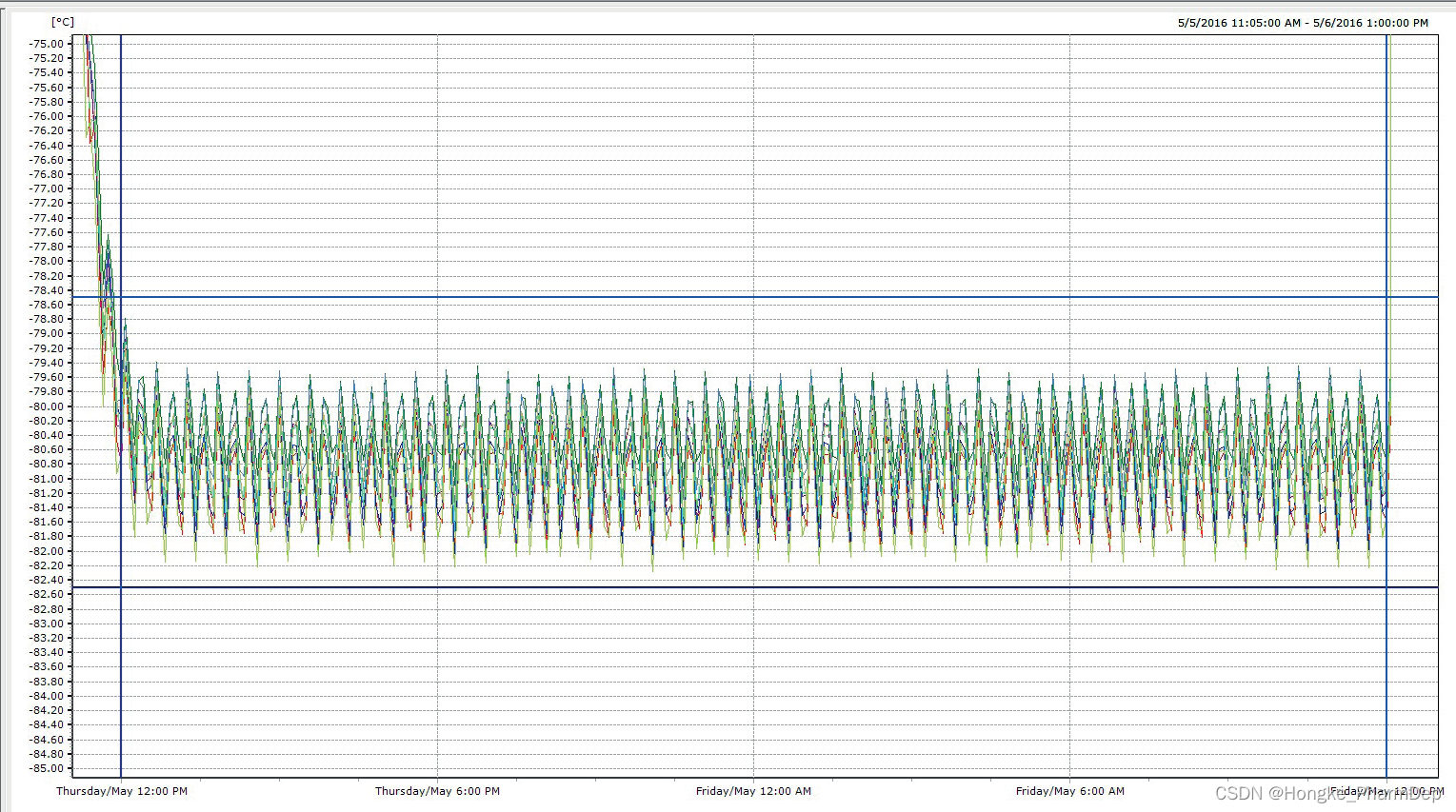
监管说明:超低温冷冻箱应配备警报器,以提醒工作人员注意温度偏差。连续温度监测系统也有助于保证材料的完整性。
Step8实施纠正措施
根据温度分布验证的结果,可能有必要采取纠正措施,以确保超低温冷冻箱的正常运行。这可能涉及更改温度控制系统、添加或重新定位温度分布验证仪器,或采取其他措施来提高冷冻箱的温度稳定性。
监管说明:如果超低温冷冻箱的设置、位置或操作条件发生任何变化,可能需要重新验证(包括重新温度分布验证)。应制定并遵循适当的变更控制程序。
Step9编写总结报告
最后,必须编写一份总结报告记录温度分布验证程序的结果,包括所采取的所有纠正措施。该报告应全面、清晰地记录所使用的方法、温度分布验证程序的结果以及从数据中得出的任何结论。确保该报告由合格人员审查和批准
监管说明:《药品生产质量管理规范》(GMP)规定强调了正确记录的重要性。温度分布验证过程中的每一个步骤、每一个观察结果都应一丝不苟地记录在案。记录可证明整个过程是一致和受控的。
遵循本指南,您就迈出了确保温度敏感型药品的安全性和完整性的重要一步。通过对超低温冷冻箱进行温度分布验证,您可以保护依赖这些产品的患者的生命和健康。
希望本指南能为您提供清晰简明的超低温冷冻箱温度分布验证流程。联系虹科,以满足您在lQ、OQ和PQ方面的所有需求。虹科将为您提供实用的解决方案和指导,帮助您应对复杂的监管环境,确保您取得成功。
现在就进行温度分布验证,为确保温度敏感产品的安全迈出下一步!

更多信息请访问:honglusys.com/,如果您想了解产品,技术,商务等任何问题,请直接点击“联系我们”。
![[人工智能-综述-13]:第九届全球软件大会(南京)有感 -2-新型的云服务:AI即服务,传统的云服务:IaaS,PaaS,SaaS, DaaS](https://img-blog.csdnimg.cn/c38fd523d6e54110bbfebc1b7a475bdf.jpeg)