胃癌(GC)是第五大常见肿瘤,在癌症相关死亡人数中占第三位。缺氧是肿瘤微环境的一个主要特征。本研究旨在探索缺氧对胃癌的影响,并建立一个与缺氧相关的预后面板。
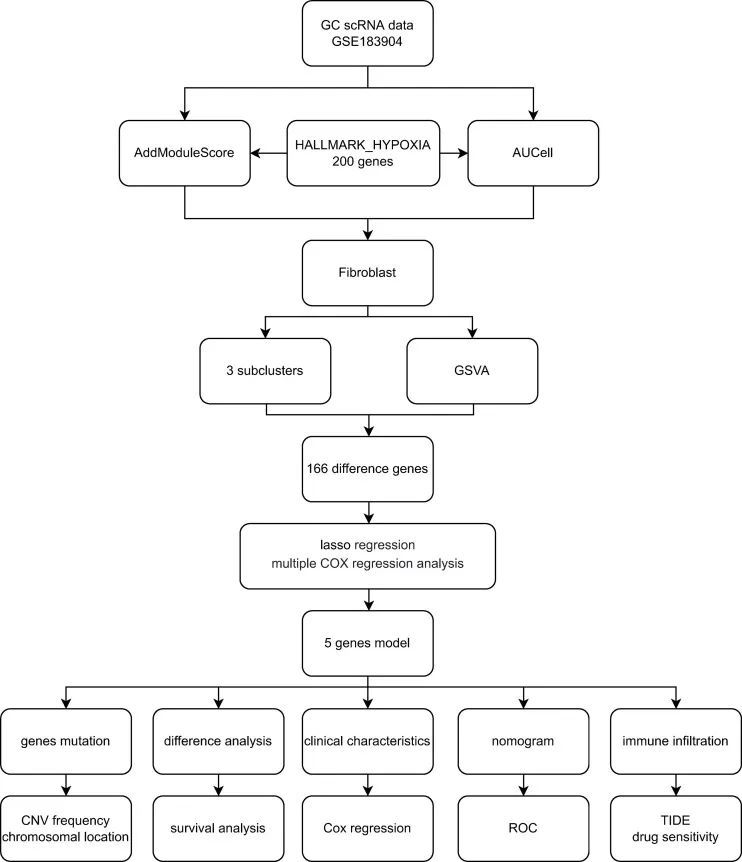
图1 流程图
1.细胞类型和缺氧评分的注释
GSE183904 共筛选出 73981 个细胞和 26571 个基因。根据典型的细胞标记注释了十种细胞类型(图 2A)。用于注释的细胞标记如图 2B 所示。根据 AddmoduleScore 函数(图 2C)和 AUCell(图 2D),与其他细胞类型相比,成纤维细胞的缺氧相关得分和 AUC 最高。因此,提取成纤维细胞进行后续分析。通过对成纤维细胞进行二次聚类,得到了三个聚类(图 3A)。然后,测定了成纤维细胞亚簇中每个细胞的 GSVA 富集得分,结果表明成纤维细胞簇 2 中富集了缺氧相关标志物(图 3B)。
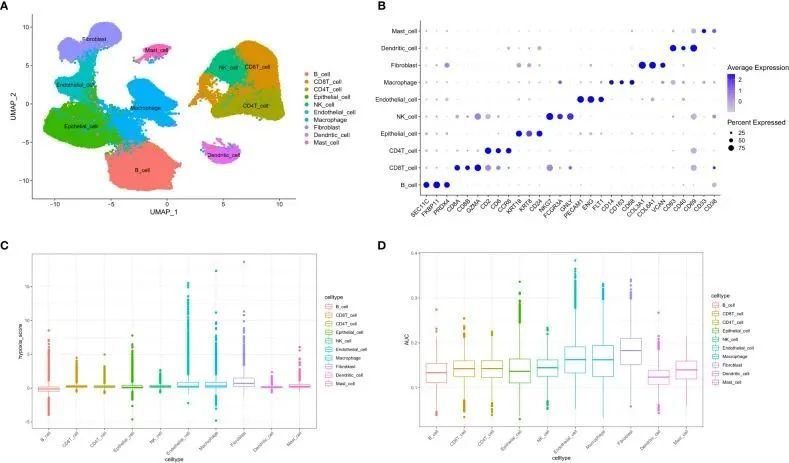
图2 单细胞数据概览
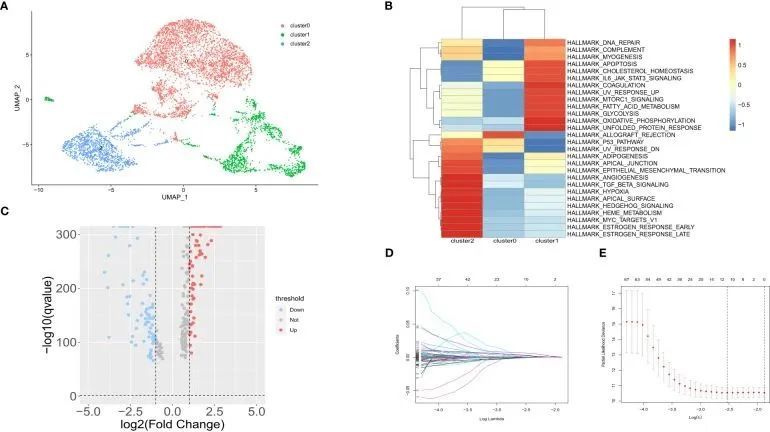
图 3成纤维细胞亚型的亚群分析
2.差异基因分析
利用 FindMarkers 功能(logFC>1,P 值<0.05,Minpct = 0.25)筛选了成纤维细胞第 2 群与其他群之间的 DEGs。在正常组和胃癌组之间的第 2 组 CAF 中发现了 166 个差异表达基因,这些基因被用于后续分析。差异表达基因的火山图如图 3C 所示。通过 LASSO-Cox 回归分析确定了中心基因。基因的变化轨迹如图 3D、E 所示。最后,筛选出 5 个基因作为缺氧相关基因,构建了缺氧相关预后模型,包括 APOD、BMP4、POSTN、MXRA5 和 LBH。
3. qPCR 验证和 LASSO 模型所含基因的 Kaplan-Meier 分析
对 LASSO 模型中的差异表达基因进行分析。采集临床胃癌样本进行 qPCR 分析。从表达水平来看,与正常组相比,4个缺氧相关基因(包括POSTN、BMP4、MXRA5和LBH)在临床胃癌样本中明显上调,而APOD在胃癌样本中表达下降(TCGA队列-图4A;临床样本-图4B)。此外,细胞系中的 PCR 也检测到了这些中心基因的表达。与组织结果一致,与正常对照细胞相比,MKN45 细胞中的 POSTN、BMP4、MXRA5 和 LBH 明显上调,而 APOD 则下降(图 4C)。此外,我们还检测了预后面板中的基因在NFs和CAFs中的表达。与NFs相比,CAFs标记基因ACTA2和FAP明显上调。与 NFs 相比,POSTN、BMP4、MXRA5 和 LBH 在 CAFs 中明显上调,而 APOD 则下降(图 4D)。
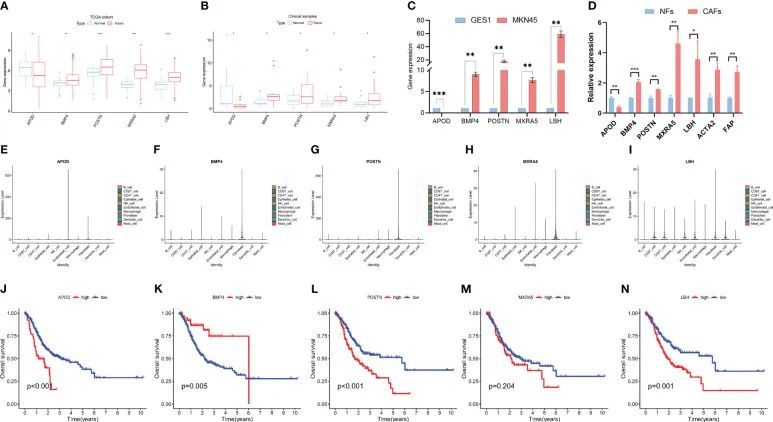
图4 胃癌中 5 个缺氧相关基因的特征
我们进一步探讨了这 5 个基因在 scRNA-seq 数据中的表达情况。结果显示,这些基因在成纤维细胞中高表达,但在其他细胞中也有表达,包括内皮细胞、上皮细胞、B 细胞、CD4 T 细胞和 CD8 T 细胞等(图 4E-I)。此外,还进行了 Kaplan-Meier (K-M) 分析,以探讨 RNA 表达与 GC 存活率之间的相关性。结果显示,APOD、POSTN、MXRA5 和 LBH 的高表达与 GC 的不良预后有关,而 BMP4 的高表达与较高的存活率有关(图 4J-N)。与其他群组的CAFs相比,第2群组的CAFs中有许多差异表达基因,列出了这些基因。由于ACTA2和FAP是众所周知的CAFs标记物,因此利用GEPIA2数据库分析了CAFs标记物(ACTA2和FAP)与缺氧相关预后面板(包括APOD、POSTN、BMP4、MXRA5和LBH)之间的相关性。
4.临床病理特征分析和模型构建
根据 LASSO-Cox 回归分析结果,利用基因表达和系数计算缺氧评分。根据缺氧评分的中位数,TCGA-GC 患者被分为高低两组。根据单变量 Cox 回归分析,TNM 分期、T 分期、N 分期和缺氧评分与胃癌的预后显著相关(图 5A)。图 5B 显示,在多变量 Cox 回归分析中,缺氧评分是一个独立的预后因素。TCGA 队列中 GC 患者的临床病理特征显示,低氧分值高组和低氧分值低组之间在年龄、TNM 分级、TNM 分期和 T 分期方面存在显著差异(图 5C-F 和 S2A)。N 分期、M 分期或性别无明显差异。KM 生存分析表明,缺氧评分高组的预后明显差于缺氧评分低组(图 5G)。图 5H 显示了缺氧评分与患者生存状况之间的关系,评分越高,预后越差。最后,我们利用所选的缺氧相关基因建立了预后相关性预测提名图(图 5I)。如 ROC 曲线所示,缺氧相关基因模型能有效预测 GC 患者的预后,其曲线下面积(AUC)值在 1 年时达到 0.679,2 年时达到 0.676,3 年时达到 0.716(图 5J)。
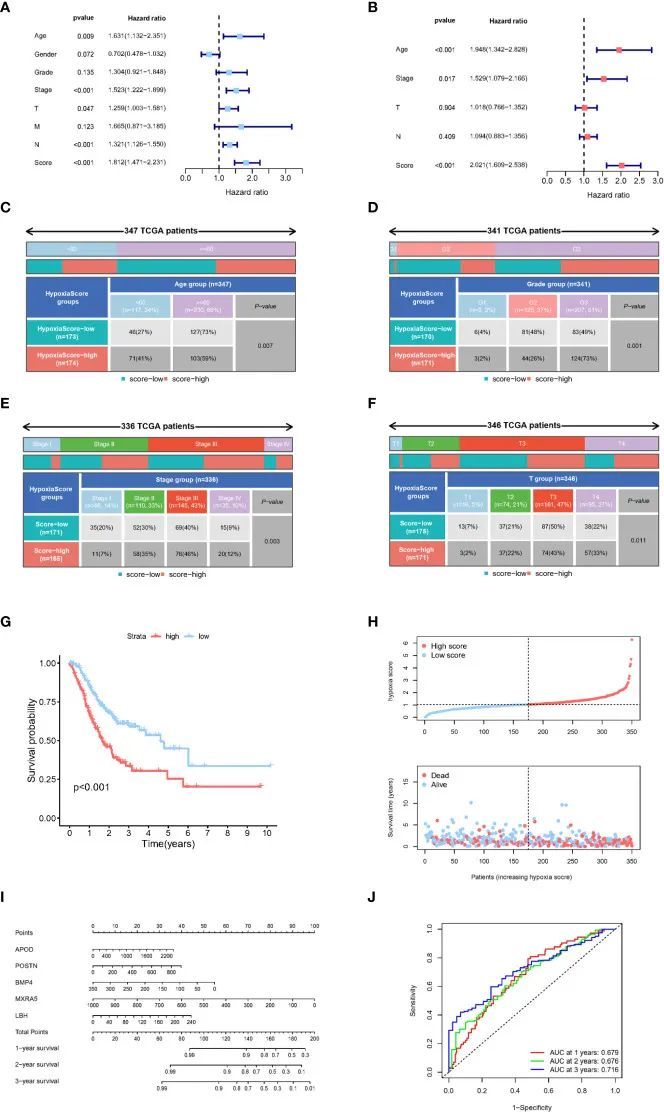
图5 缺氧相关基因模型的临床特征
5.免疫浸润与缺氧评分之间的关系
利用CIBERSORT估算了TCGA-GC队列中22种免疫细胞的浸润情况,然后探讨了不同缺氧评分组免疫细胞浸润的差异。结果显示,高缺氧评分组患者的抗肿瘤免疫细胞(包括活化的 NK 细胞或 CD8+ T 细胞)较少,而静息的 NK 细胞和 M2 巨噬细胞等促癌免疫细胞在高评分组有所增加(图 6A、B)。大部分功能性免疫细胞浸润在高缺氧评分组,表明缺氧评分与免疫微环境密切相关。缺氧基因与免疫细胞的相关性分析见图 S4A,表明 M2 巨噬细胞和活化 B 细胞与缺氧评分呈正相关,而中性粒细胞和活化记忆 CD4 T 细胞则相反。
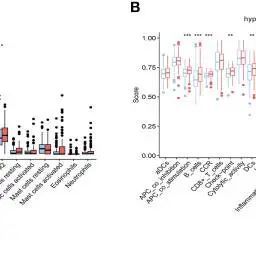
图6 不同缺氧评分组的免疫浸润和免疫疗法的预后价值
这个LASSO模型是根据第2群CAFs中的DEGs建立的。为了验证CAFs与免疫浸润的关系,我们使用双重染色免疫组化技术检测了CAF标记物ACTA2和CD8+ T细胞标记物CD8。这一结果表明,CAFs 与免疫浸润有关(图 6D)。
6.缺氧评分的免疫治疗预测效果
采用肿瘤免疫功能障碍和排斥(TIDE)算法来检验候选基因与细胞毒性T细胞功能之间的相互作用。TIDE 预测得分与免疫逃避呈正相关,证明了免疫疗法的抗药性。根据 ROC 曲线,缺氧评分是比 TIDE 评分或 TIS 评分更好的预后面板(图 6C)。在TCGA-GC队列中,高缺氧评分组的TIDE评分明显高于低评分组(图6E)。此外,除 MSI 评分(图 6H )外,两个缺氧评分亚组之间的 T 细胞排除评分(图 6F)和 T 细胞功能障碍评分(图 6G)也有显著差异。这些结果表明,缺氧评分高的患者免疫治疗获益差,这与之前的研究结果一致。生存分析表明,缺氧评分高的患者预后较差(15)。根据ESTIMAT算法,缺氧评分高的患者肿瘤纯度也高于缺氧评分低的患者(图7A)。肿瘤突变负荷(TMB)定义为每一百万个碱基中检测到的体细胞突变总数。研究表明,肿瘤突变负荷高的患者更有可能从 ICI 治疗中获益。与高缺氧评分组相比,低缺氧评分组 TMB 的表达明显上调(图 7B)。此外,我们观察到低缺氧评分与 MSI-H 状态相关,而高 CAFS 评分与微卫星稳定(MSS)状态相关(图 7C、D)。
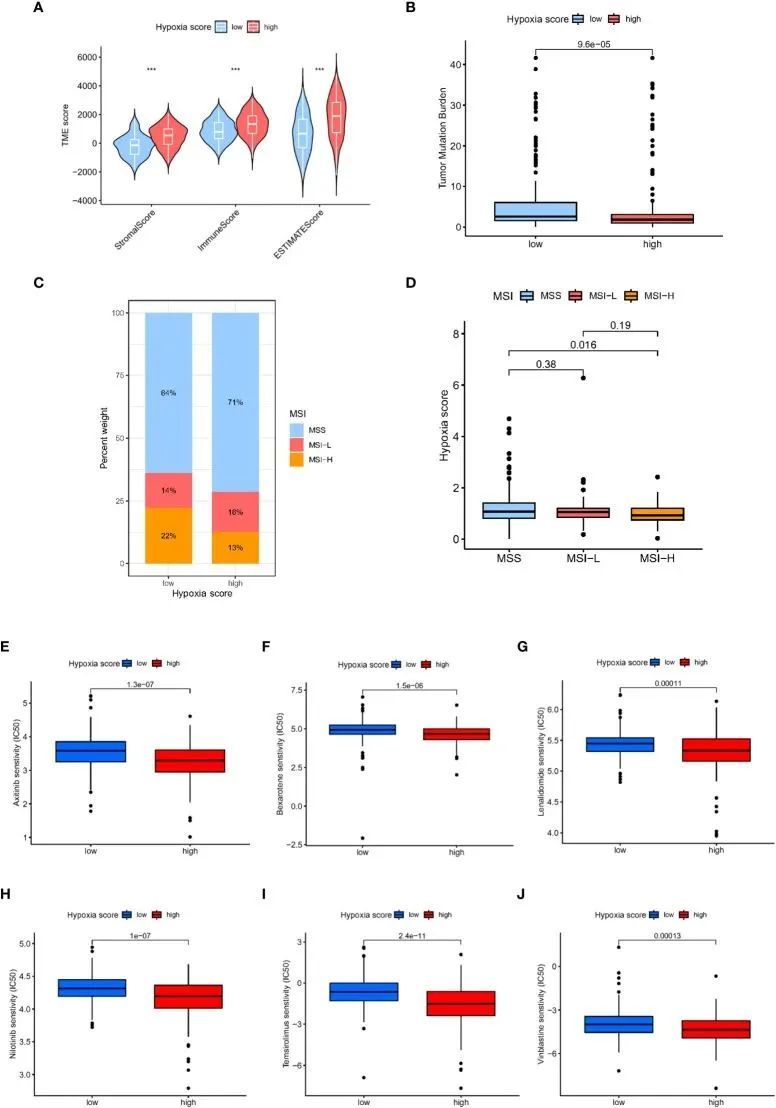
图7 不同缺氧评分患者的肿瘤微环境和药物敏感性分析
7. Drug sensitivity 3.7.药物敏感性
此外,我们还探讨了缺氧评分与化疗对 GC 治疗效果之间的关系。我们发现,缺氧评分越高,阿西替尼、贝沙罗汀、来那度胺、尼洛替尼、替米考星和长春新碱等化疗药物的半数抑制浓度(IC50)越低(图7E-J,P<0.05)。因此,我们的研究表明,缺氧评分可作为化疗敏感性预测的潜在有效预测指标。
总结
基于单细胞和大块 RNA 测序建立的新型五元素缺氧相关面板是预测胃癌预后的潜在生物标志物。该缺氧相关预后面板与免疫浸润、免疫治疗和化疗密切相关。这项研究可能会为胃癌治疗提供潜在的靶点,但还需要更多的实验研究。







![[GWCTF 2019]你的名字 - SSTI注入(waf绕过)](https://img-blog.csdnimg.cn/f5e36bfa050849ac87ce6dae6cad226c.png)