Krüppel-like factor 3(KLF3)是一个关键的转录抑制因子,参与了脂肪生成、红细胞生成和B细胞发育等多种生物功能,并成为当前研究的热点之一。然而,KLF3在泛癌症和肿瘤微环境中的作用仍不清楚。
1. KLF3的差异表达
为了研究KLF3在泛癌症中肿瘤和正常组织中的表达差异,作者进行了以下分析。通过整合TGCA和GTEx数据库,作者发现KLF3 mRNA在14种肿瘤(ALL,CHOL,COAD,COADREAD,ESCA,GBM,GBMLGG,LAML,LGG,LIHC,PAAD,STAD,STES和WT;所有p < 0.01)中显著上调,而在13种肿瘤(BLCA,BRCA,KICH,KIPAN,KIRC,KIRP,LUAD,OV,READ,SKCM,THCA,UCEC和UCS;所有p < 0.01)中显著下调,与正常组织相比(图1A)。此外,通过对TGCA数据库中的癌症和正常组织进行配对分析,作者发现KLF3 mRNA在CHOL(p < 0.01)和PAAD(p < 0.001)中上调,但在BRCA(p < 0.001),COAD(p < 0.001),KICH(p < 0.001),THCA(p < 0.001)和UCEC(p < 0.001)中显著下调,与配对的正常组织相比(图1B)。这些结果表明,除了COAD外,配对和非配对样本分析之间存在一致的趋势。通过人类蛋白质图谱数据库(HPA)的进一步分析发现,KLF3蛋白在胶质瘤(11/11)、甲状腺癌(3/3)、肺癌(10/10)、结直肠癌(10/10)、头颈癌(4/4)、胃癌(12/12)、尿路上皮癌(12/12)、宫颈癌(11/11)和胰腺癌(11/11)等肿瘤类型中的表达频率为100%,而在类癌(2/4)、黑色素瘤(6/11)和肾癌(7/12)等肿瘤类型中的表达频率最低(图1C)。此外,利用Genecards数据库,作者观察到KLF3主要定位于细胞核内(图1D)。
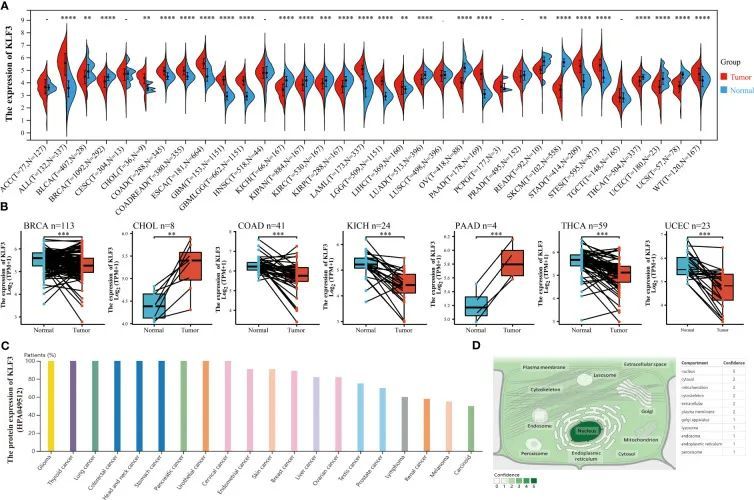
图1 KLF3在泛癌中的表达和定位差异
2. KLF3的遗传变化和表观遗传修饰
由于在肿瘤中观察到KLF3的差异表达,作者使用在线资源cBioPortal和GSCALite分析了其遗传变异和表观遗传调控修饰。如图2A所示,KLF3的主要遗传变异类型是“突变”,其中STAD(5.68%),UCEC(5.29%),SKCM(2.25%),COAD(1.85%)和ESCA(1.1%)是最典型的。在ACC(2.2%),LUAD(0.88%),SARC(0.78%),BLAC(0.73%)和PAAD(0.54%)中主要看到“扩增”。在泛癌中,KLF3基因突变的频率在“深度缺失”,“结构变异”和“多重变异”方面通常低于0.5%。拷贝数变异是导致肿瘤发生和生长中基因表达改变的重要异常。Spearman相关分析显示,KLF3的mRNA表达与SKCM,ESCA,READ,LGG,LUSC,UCS,HNSC,STAD,COAD,KIRC,LUAD,CESC,BLCA,UCEC,LIHC,SARC,BRCA和OV的KLF3基因的拷贝数变异显著正相关(图2B)。DNA甲基化的失调与包括癌症在内的各种疾病的发生密切相关。GSCA数据库提供了与各种肿瘤类型中KLF3基因表达最负相关的甲基化位点(图2C)。通过UALCAN数据库进一步发现,BLCA、BRCA、CESC、ESCA、HNSC、KIRC、LUAD、LUSC、PRAD、TGCT和UCEC中KLF3基因启动子的甲基化水平显著高于相应的正常组织;而STAD和THCA中则相反。越来越多的证据表明,RNA修饰途径在人类癌症中发生了失调,可能是癌症治疗的理想靶点。KLF3表达与RNA修饰相关基因的关联显示在图2D中。作者发现,在泛癌症中,KLF3表达通常与m1A、m5C和m6A相关基因表达呈正相关,尤其是与YTHDF1、NSUN3、TET2、METTL14、YTHDC2和FMR1的关联较强。以上结果表明,KLF3在不同肿瘤中的异常表达可能与其基因变异和参与表观遗传修饰密切相关。
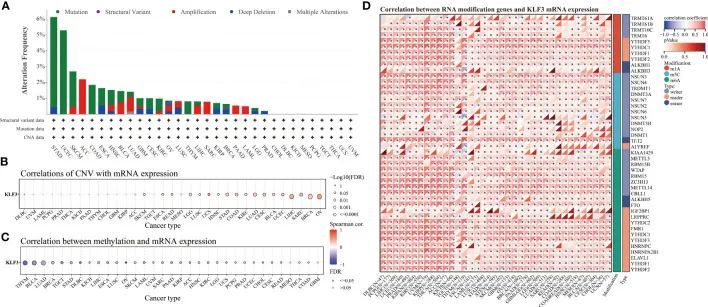
图2 KLF3的基因改变和表观遗传修饰
3. KLF3表达与临床病理特征及预后的相关性
以上结果表明,KLF3在各种肿瘤中表达异常,但其表达是否与肿瘤进展有关还需要进一步探索。根据图3A所示的结果,观察到在CESC、ESCA、KIPAN、KIRC和STES患者中,随着组织学分级的增加,KLF3的表达呈下降趋势。相反,在PAAD、HNSC、GBMLGG和LGG患者中观察到相反的趋势(所有p<0.05)。此外,观察到在COAD、COADREAD、ESCA、KIPAN、KIRC、THCA和OV患者中,随着临床分期的进展,KLF3的表达呈下降趋势,除了在PAAD患者中观察到相反的趋势(图3B,所有p<0.05)。接下来,通过绘制Kaplan-Meier生存曲线,作者发现与KLF3低表达组相比,高KLF3表达与ACC、GBMLGG、LGG、PAAD和SARC患者的整体生存期较短密切相关(所有p<0.05,图3C)。相反,KLF3的高表达与BLCA、COADREAD、COAD和KIRC患者的良好预后密切相关(所有p<0.05,图3D)。此外,作者在泛癌症患者生存数据和KLF3基因表达上建立了COX比例回归模型,以分析KLF3基因表达与每种肿瘤预后之间的关系。结果显示,在LGG、GBMLGG、ACC和PAAD中,较高的KLF3表达与较差的OS相关,而在KIRC、COADREAD、COAD和KIPAN患者中观察到相反的结果。DSS结果显示,在LGG、GBMLGG、PAAD和ACC中,较高的KLF3表达与较差的DSS相关,而在KIRC和KIPAN患者中观察到相反的结果。综上所述,结果表明KLF3能够有效预测多种癌症的预后,尤其是在PAAD中。
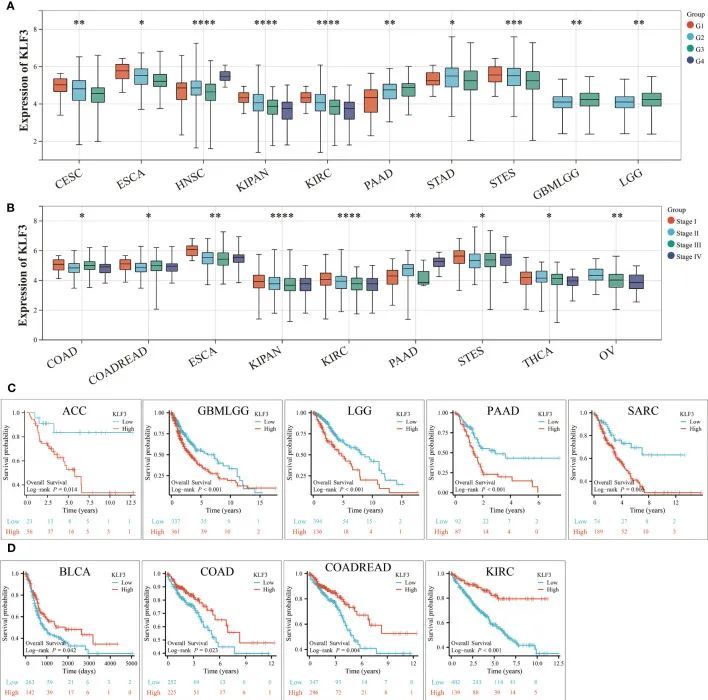
图3 KLF3表达与临床特征和预后的关系
4. KLF3在泛癌症中的功能分析
为了阐明KLF3如何影响预后,作者分析了KLF3与14种功能状态之间的相关性,使用了来自CancerSEA的单细胞测序数据。此外,通过GSEA,作者探索了KLF3异常表达如何影响上述功能的可能信号通路(图4)。作者发现在大多数肿瘤类型中,免疫相关的信号通路显著富集,包括TNFA信号通过NFκB、IFN-γ响应、IFN-α响应、炎症反应、IL6-JAK-STAT3、IL2-STAT5和移植排斥。结果还显示,各种肿瘤类型富集了TGF-β、蛋白质切割、氧化磷酸化、mTORC1、KRAS、上皮间质转化和DNA修复信号。以上结果表明,KLF3与肿瘤进展和免疫应答密切相关。

图4 KLF3在各种癌症中的特征基因集富集分析(GSEA)
5. KLF3表达与TME之间的关系
为了阐明KLF3与免疫细胞浸润之间的关系,作者使用EPIC和MCPCOUNTER算法进行了分析。结果显示,KLF3的表达与CD4+ T细胞、CD8+ T细胞、中性粒细胞、髓样树突状细胞、单核细胞/巨噬细胞和内皮细胞在大多数肿瘤微环境中的浸润密切相关(图5A、B)。作者进一步通过分析单细胞测序数据验证了上述发现。如图5C所示,KLF3在CD4Tconv、CD8T、单核细胞/巨噬细胞、内皮细胞和恶性细胞中的比例较高。然后,作者分析了KLF3表达与泛癌症肿瘤微环境之间的关系。KLF3的表达与ACC、THYM、TGCT、LUSC、THCA、UCEC、BLCA、LUAD、ESCA、STES、KIRP、CESC、CHOL、HNSC、GBM、STAD、LIHC和PAAD的免疫评分呈负相关,与COAD、LGG、LAML和DLBC的免疫评分呈正相关(图6A)。KLF3的表达与ACC、ESCA、BLCA、LUSC、STES、STAD、HNSC、CESC、THCA、GBM、UCEC和LUAD的基质评分呈负相关,与LGG、KICH、BRCA、SARC、THYM、UCS、KIRC、TGCT、LAML和DLBC的基质评分呈正相关(图6B)。KLF3的表达与ACC、LUSC、BLCA、ESCA、STES、THCA、HNSC、STAD、UCEC、CESC、LUAD、THYM、GBM、CHOL、KIRP、TGCT、LIHC和PAAD的估计分数呈负相关,与KIRC、COAD、READ、LGG、KICH、USC、LAML、DLBC、OV和BRCA的估计分数呈正相关(图6C)。Spearman相关分析还显示,KLF3的表达与免疫相关基因显著相关(图6D)。从泛癌症的角度来看,发现与KLF3表达显著正相关的免疫相关基因有VEGFA、C10orf54、CD276、EDNRB、ARG1、HMGB1、ENTPD1、BTN3A1、TLR4和BTN3A2,而VEGFB的表达与KLF3的表达呈负相关。此外,作者发现BLCA中的KLF3表达与T细胞耗竭、M2巨噬细胞和CAFs的相关标记的表达呈负相关。有趣的是,作者在DLBC中观察到了相反的结果。从泛癌症的角度来看,KLF3通常与与M2巨噬细胞和CAFs相关的标记的表达呈正相关。此外,KLF3与T细胞耗竭基因中TIGIT的表达水平大多呈正相关。简而言之,异常的KLF3表达对肿瘤微环境的贡献不可忽视。

图5 KLF3在TME中的表达和分布
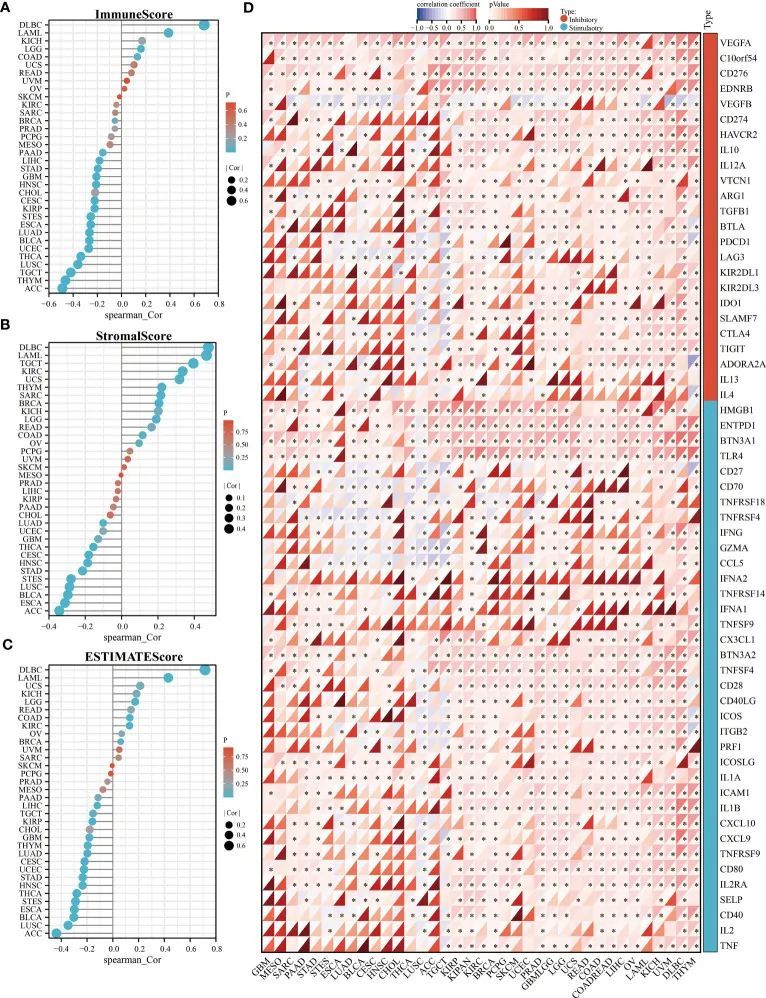
图6 KLF3表达与泛癌症TME的关系
6. 预测与KLF3相关的肿瘤免疫治疗反应和药物
TMB和MSI是免疫疗法的预测因子。因此,作者评估了KLF3表达与TMB和MSI之间的关系。Spearman相关分析显示,DLBC(p<0.05)、ESCA(p<0.05)、HNSC(p<0.05)、LAML(p<0.05)、LGG(p<0.05)、PAAD(p<0.001)、SARC(p<0.001)、STAD(p<0.001)和THYM(p<0.001)的KLF3表达与它们的TMB呈正相关,而在BRCA(p<0.001)、KIRC(p<0.05)和THCA(p<0.01)中与TMB值呈负相关(图7A)。此外,KLF3表达水平与COAD(p<0.01)、DLBC(p<0.001)、READ(p<0.05)和STAD(p<0.001)的MSI呈正相关。相反,在BLCA(p<0.05)、BRCA(p<0.05)、HNSC(p<0.01)、KIRP(p<0.05)、PRAD(p<0.01)、SKCM(p<0.01)、THCA(p<0.01)和UCS(p<0.05)中与MSI呈负相关(图7B)。此外,作者根据KLF3表达预测了肿瘤患者对免疫疗法药物的反应和敏感性。值得注意的是,与免疫疗法反应的常见标准生物标志物相比,作者发现AUC大于0。当仅使用KLF3作为预测标记时,在10个免疫疗法队列中观察到5个,表明KLF3在预测中的表现优于TMB、T. Clonality和B. Clonality。随后,通过GDSC数据集对KLF3进行药物IC50分析,发现trametinib(可逆性丝裂原活化外信号调节激酶1(MEK 1/2)抑制剂)、PD-0325901(选择性MEK抑制剂)和17-AAG(HSP90抑制剂)是与KLF3表达负相关的前三种药物;而PI-103(多靶点PI3K抑制剂)、JW-7-24-1(小分子激酶抑制剂)和PIK-93(PI4KIIIβ抑制剂)是与KLF3表达正相关的前三种药物(图7C)。根据CTRP数据库,KLF3表达与药物IC50的相关性显示,阿比特龙(一种CYP17抑制剂)、厄洛替尼(一种酪氨酸激酶抑制剂)和PD318088(一种非ATP竞争性MEK1/2突变抑制剂)是与KLF3表达负相关的前三种药物;曼纳霉素A(一种选择性竞争性法尼酰转移酶(FTase)抑制剂)、CCT036477(Wnt通路抑制剂XI)和CIL70是与KLF3表达正相关的前三种药物(图7D和表S3)。这些结果表明KLF3在预测泛癌症免疫治疗反应和预测靶向KLF3的有效小分子药物方面发挥作用,这可能为未来的泛癌症治疗研究提供了有力的证据。

图7 免疫疗法反应、生物标志物相关性和KLF3在泛癌症中的药物敏感预测
7. 在胰腺导管腺癌中鉴定KLF3
通过作者对泛癌症中KLF3的分析,作者发现KLF3在胰腺导管腺癌(PAAD)中显著上调(图1A-C),其表达与患者的临床分期和组织学分级呈正相关(图3A,B)。它还与PAAD患者的不良总生存期(OS)、疾病特异性生存期(DSS)、无进展生存期(PFI)和无疾病生存期(DFI)显著相关(图3C)。因此,作者的研究重点是调查KLF3在PAAD中的致癌作用。首先,作者分析了KLF3在PAAD中的临床意义及其蛋白质表达。联合单因素和多因素COX回归分析表明,KLF3是PAAD的独立预后风险因子(图8A,所有p<0.05)。随后,作者对KLF3的蛋白质表达进行了表征,以澄清其mRNA表达是否与蛋白质表达一致。HPA数据库显示,KLF3的免疫组化染色强度在PAAD组织中显著高于正常胰腺组织(图8B)。这一结果得到了CPTAC数据库的蛋白质表达实验数据的验证(图8C,p=0.01834020)。使用qPCR和western bot检测了正常胰腺导管上皮细胞和PAAD细胞系中KLF3的mRNA和蛋白质基础表达水平。如图8D、E所示,与正常胰腺导管上皮细胞HPDE6-C7相比,PAAD细胞中KLF3的mRNA和蛋白质水平均较高(所有p<0.05)。胰腺癌细胞系PANC-1和BxPC-3中KLF3的基础表达水平显著较高,这将作为沉默KLF3表达的工具细胞。基于ICC/IF分析发现,KLF3表达主要定位于PAAD细胞的细胞核中(图8F),这与从HPA(图8B)和Genecards(图1D)数据库中获取的信息一致。

图8 KLF3的高表达与PAAD的预后不良相关
8. KLF3的沉默抑制了胰腺导管腺癌的进展
作者使用RNAi技术有效地抑制了KLF3的表达(图9A、B,所有p<0.05)。通过CCK-8实验,作者发现干扰KLF3的表达会抑制PANC-1和BxPC-3细胞的细胞活力(图9C,所有p<0.05)。同样,作者使用EdU细胞增殖实验发现,KLF3表达的沉默会抑制PAAD细胞系的增殖能力(图9D,所有p<0.05)。随后,作者使用Transwell和划痕愈合实验来检测KLF3在PAAD和BxPC-3细胞迁移中的潜在作用。如图9E、F所示,KLF3表达受干扰的PANC-1和BxPC-3细胞的迁移能力显著受到抑制(所有p<0.05)。此外,体内实验显示,与对照组相比,稳定沉默KLF3表达的PANC-1细胞的肿瘤生长明显减缓(图9G,p<0.01)。实验结束时,sh-KLF3#1组的肿瘤重量也显著减少(图9H,p<0.01)。无论是体外还是体内实验都表明,KLF3是胰腺导管腺癌的危险因素,并且沉默KLF3的表达会抑制胰腺导管腺癌的进展。
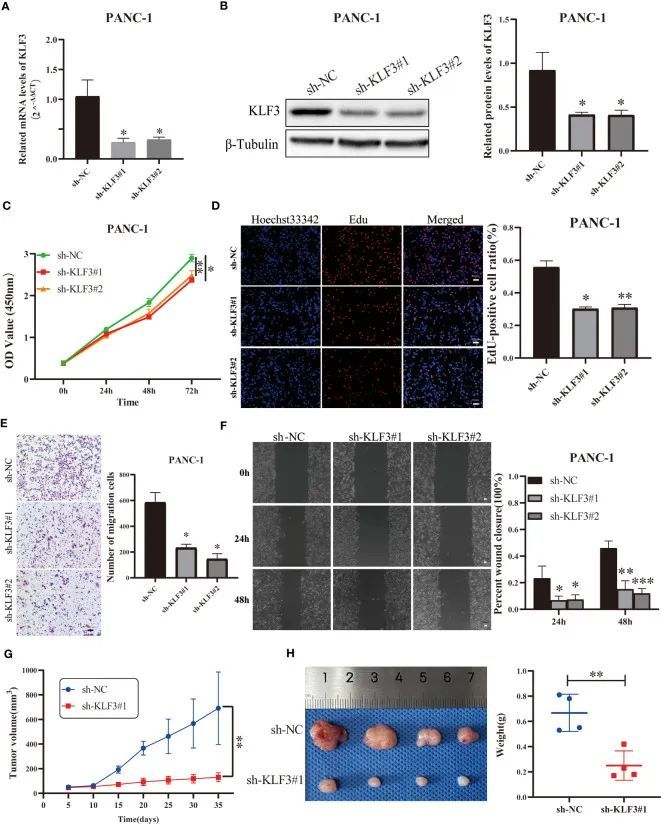
图9 沉默KLF3表达抑制了PAAD在体内和体外的进展
总结
在这项研究中,KLF3在多种肿瘤类型中异常表达,并与临床进展和预后密切相关;KLF3可能是一个潜在的预后标志物,尤其在胰腺导管腺癌中。此外,KLF3对肿瘤微环境的贡献以及免疫细胞浸润的丰度也是不可忽视的。它可能是预测免疫治疗反应的生物标志物,并有潜力指导个体化的癌症免疫治疗。




![Kettle连接数据库[MySQL]报错](https://img-blog.csdnimg.cn/d298ab9bd9774f5f888685e36faafcde.png)