糖基转移酶特异性
大多数糖基转移酶对其供体和受体底物都具有高度的特异性,这导致Saul Roseman及其同事提出了“一种酶 - 一种连接”假说。人B血型α1-3半乳糖基转移酶就是这一概念的例证。该酶催化糖基化反应,其中半乳糖以α键添加到受体底物上半乳糖残基的C-3羟基中(图6.1)。然而,该酶仅作用于α1-2-键中岩藻糖修饰的半乳糖,而先前被其他单糖(如α2-6-连接的唾液酸)修饰的聚糖产生不是底物的聚糖(图6.1)。
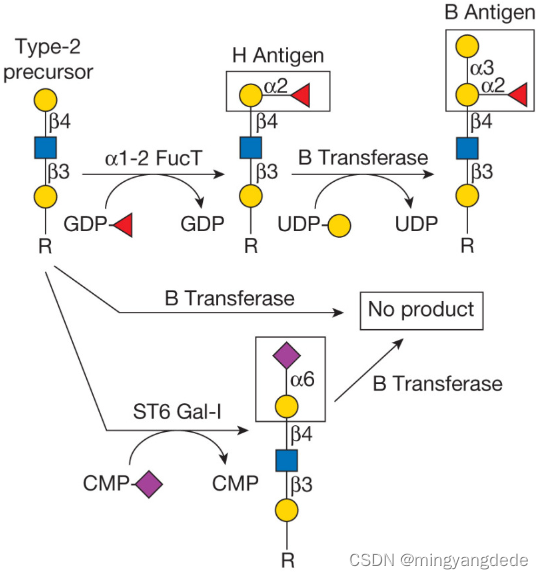
图 6.1.
糖基转移酶的严格受体底物特异性由人B型α1-3半乳糖基转移酶说明。B转移酶将α1-3-连接的半乳糖添加到H抗原(顶部中间)以形成B抗原(更多...)
我们现在知道,在某些情况下,不止一种糖基转移酶可以使用相同的受体来建立相同的连接。例如,人岩藻糖基转移酶III-VII都将α1-3-键中的岩藻糖连接到聚糖上的N-乙酰乳糖胺部分(第14章)。α2-3唾液酸转移酶和β1-4半乳糖基转移酶分别广泛作用于β连接的半乳糖和N-乙酰葡糖胺,提供了松弛受体特异性的例子。在极少数情况下,一种酶可以催化不止一种反应。人岩藻糖基转移酶III可以在α1-3-或α1-4-键中连接岩藻糖,一种称为EXTL2的酶可以将N-乙酰半乳糖胺或N-乙酰葡糖胺以α键连接到葡萄糖醛酸(第17章)。参与N-乙酰乳糖胺形成的β1-4半乳糖基转移酶在特异性上显示出异常的灵活性。当β1-4半乳糖基转移酶与α-乳清蛋白(该复合物称为乳糖合酶)结合时,它会将其受体特异性从N-乙酰葡糖胺转换为葡萄糖,从而能够在产奶过程中合成乳糖和其他低聚糖(第14章)。最后,一些糖基转移酶具有两个独立的活性位点,具有不同的底物特异性。例如,合成硫酸乙酰肝素(EXT1)和透明质酸(HAS)骨架的酶有一个活性位点,催化N-乙酰葡糖胺与葡萄糖醛酸的附着,另一个活性位点将葡萄糖醛酸连接到N-乙酰葡糖胺(第16章和第17章)。然而,上述示例都是大多数糖基转移酶所显示的通常严格的供体、受体和连接特异性的例外,这种特性用于定义和限制在给定细胞类型或生物体中观察到的聚糖结构的数量和类型。
将单糖或寡糖直接转移到多肽或脂质部分的糖基转移酶也显示出高度的底物特异性,下面将更详细地讨论涉及多肽的底物特异性。启动鞘糖脂合成的糖基转移酶将单糖部分转移到鞘脂神经酰胺脂质前体中的最初丝氨酸残基上(见第11章)。由于不同的糖脂具有不同的神经酰胺部分,因此似乎某些糖基转移酶(例如唾液酸转移酶)根据神经酰胺部分的性质差异识别其底物。
![[0xGame 2023] week1](https://img-blog.csdnimg.cn/26c6d04e3c93485b9c1d008dd690aa48.png)







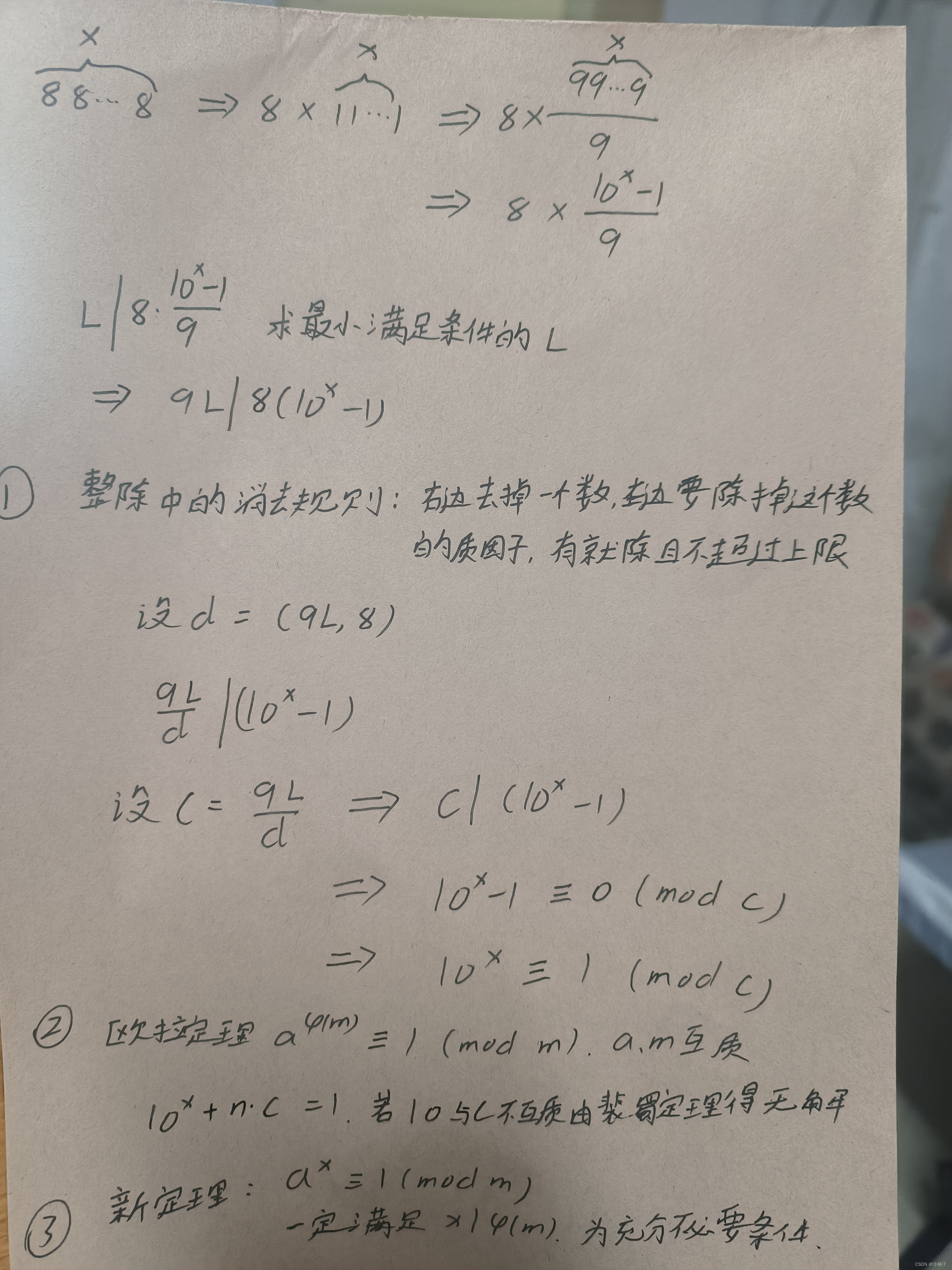

![[补题记录] Atcoder Beginner Contest 297(F)](https://img-blog.csdnimg.cn/b1b85ba027524ec2a40a4e67a743166c.png)