肺癌是最常见的被诊断出的癌症之一,对公共健康构成了严重威胁,也是全球癌症相关死亡的主要原因。大约85%的肺癌是非小细胞肺癌,其中腺癌是主要的病理类型。越来越多的证据表明,肿瘤微环境在局部耐药性、免疫逃逸、癌症转移和复发中起着关键作用。众所周知,巨噬细胞M2型极化、调节性T细胞和MDSC细胞可以促进肺腺癌的进展,而Th2辅助性细胞可以帮助肿瘤免疫逃逸过程,然而,CD8 T细胞和细胞毒性T细胞等是抗肿瘤免疫的主要力量。了解肿瘤微环境对于预防转移、克服获得性耐药性和提高治疗效果具有深远的意义。
1. 肺腺癌中SUMOylation调控基因的遗传变异
流程图显示了作者的研究过程(图1)。作者调查了33个SUMO修饰调控基因在肺腺癌中的作用,即SUMO异构体(SUMO1,SUMO2,SUMO3,SUMO4),SUMO活化酶(SAE1,UBA2),SUMO结合酶(UBE2I),SUMO E3连接酶(BCL11A,CAPN3,CBX4,HDAC4,HDAC7,MUL1,NSMCE2,PIAS1,PIAS2,PIAS3,PIAS4,RANBP2,RANGAP1,RNF212,RWDD3,TOPORS,TRIM27,TRIM28,ZMIZ1),SUMO蛋白酶(HINT1,SENP1,SENP2,SENP3,SENP6,SENP5,SENP7,USPL1)。SUMOylation的可逆过程由上述调控基因调控(图2A)。作者首先对这33个SUMOylation调控基因进行了GO和KEGG富集分析。GO富集分析显示,这33个SUMOylation调控基因在生物过程中显著富集了赖氨酸修饰、蛋白质SUMOylation、小蛋白共价修饰调控等方面,在分子功能方面富集了泛素化蛋白酶活性、SUMO酶活性等。KEGG富集分析显示了其他与SUMOylation相关的通路。
图1 流程图
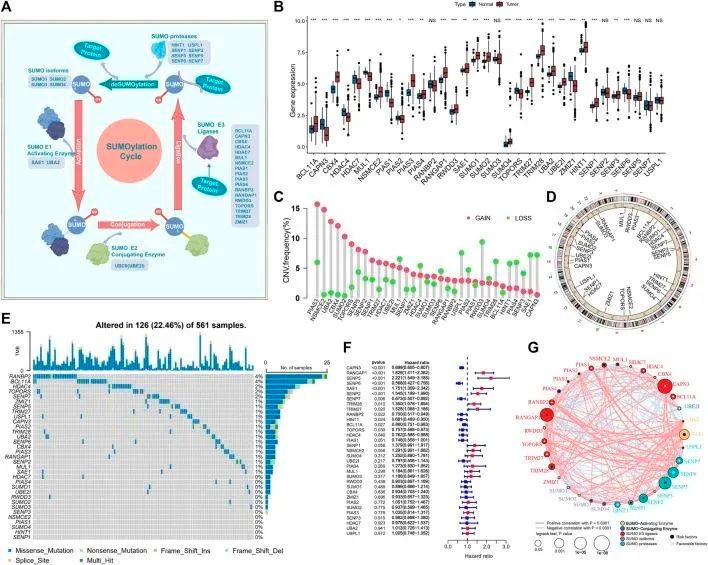
图2 肺腺癌中的SUMOylation调控基因景观
随后,为了全面了解SUMOylation调控基因,作者对33个SUMOylation调控基因进行了Spearman相关性分析,以评估它们的共表达模式,发现CAPN3和PIAS1的表达与其他调控基因之间存在广泛的显著负相关,同时CAPN3和PIAS1的表达之间存在显著的正相关。值得注意的是,大多数SUMOylation调控基因在肿瘤组织中明显上调,总体上,SUMOylation调控基因的表达在肿瘤和正常样本之间存在显著差异(图2B)。基于配对的肿瘤和正常样本的PCA分析确定了在正常和肿瘤样本之间表达显著不同的SUMOylation调控基因。
此外,CNV在33个调控基因中非常常见;PIAS3、NSMCE2、UBA2、CBX4和SUMO2中普遍存在CNV扩增,而RWDD3、USPL1、SAE1和CAPN3中普遍存在CNV缺失(图2C)。CNV广泛出现在各种染色体上的基因中(图2D),但主要集中在1号、3号、4号、6号、12号、15号和19号染色体上。作者进一步评估了SUMOylation调控基因中体细胞突变的普遍性。在561个肺腺癌样本中,有126个(22.46%)发生了变异,主要是SUMOylation调控基因中的错义突变和无义突变。RANBP2和BCL11A的突变频率最高,为4%,其次是HDAC4、TOPORS和SENP7,突变频率为2%;大多数突变发生在SUMO活化剂和E3连接酶的调控基因中,较少发生在SUMO异构体中(图2E)。随后,作者分析了SUMOylation调控基因的突变共存情况,并发现SUMO2与RANGAP1和PIAS4的突变共存。
此外,为了确定33个SUMO化调控基因与肺腺癌患者预后之间的关系,作者采用了Cox风险比例回归模型来确定33个SUMO化调控基因与肺腺癌患者预后之间的关系。森林图显示CAPN3、SENP6、SENP7、RANBP2、HINT1、BCL11A、TOPORS和HDAC4是肺腺癌的保护因子,通常下调表达,而RANGAP1、SENP5、SAE1、SENP2、TRIM28和TRIM27是肺腺癌的危险因子,表达上调(图2F)。多变量Cox比例风险回归分析进一步证实SUMO化调控基因与肺腺癌预后显著相关。总之,作者绘制了SUMO化调控基因与肺腺癌预后之间的关系(图2G)。总结起来,作者确定了SUMOylation调控基因在正常和肺腺癌组织之间存在显著差异,并且与肺腺癌的突变频率和拷贝数变异显著相关。此外,作者证明了特定SUMOylation调控基因的表达变化和遗传变异在肺腺癌的发展和预后中起着关键作用。
2. 根据33个受SUMOylation调控的基因表达,鉴定出两种不同的SUMOylation模式
为了探索不同的SUMO化模式,作者收集了857例肺腺癌患者的数据,这些数据来自GEO数据库的四个数据集,以33个SUMO化调控基因为基础进行无监督一致性聚类。根据CDF曲线下面积的变化(图3A、B),作者确定最佳聚类数为2(K = 2)。随后,作者根据调控基因的mRNA表达数据对这两种SUMO化模式进行主成分分析(图3C),发现这两种不同的修饰模式可以完全通过SUMO化调控基因进行区分。同时,Kaplan-Meier生存分析显示,具有SUMO-C2模式的患者预后生存较差(log-Rank检验p = 7.55e-07)(图3D)。SUMO-C2模式的发生与BCL11A、CAPN3、HDAC4、PIAS4、UBA2、UBE2I、SENP6、SENP7和USPL1的下调以及CBX4、NSMCE2、PIAS3、RANGAP1、TRIM28和SENP2的上调一致(图3E)。热图进一步证实了这33个SUMO化调控基因在这两种SUMO化模式中的表达差异。多元Cox回归结果表明,与Kaplan-Meier结果一致,SUMO化模式可以作为独立的预后因子,与SUMO-C1相比,SUMO-C2与不良预后生存相关,HR = 1.55,p < 0.001(图3F)。
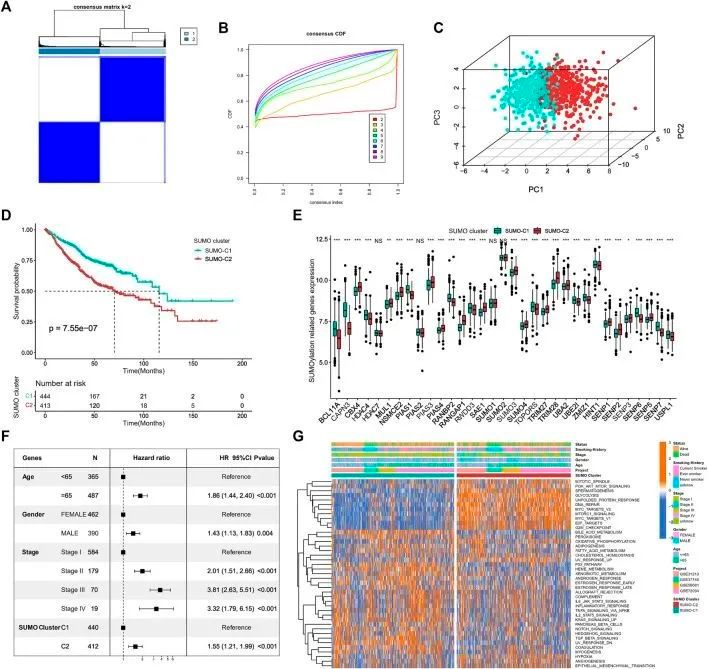
图3 SUMO化模式的鉴定及其相关生物功能
为了进一步探索与两种SUMO化模式相关的关键生物途径的差异,作者使用GSVA算法计算Hallmark基因集得分,并将其转换为基因集的得分矩阵。作者发现,与SUMO-C1和SUMO-C2一致的Hallmark基因集的GSVA得分存在显著差异(图3G),SUMO-C2主要富集于与细胞周期、葡萄糖代谢以及遗传物质复制和修复相关的生物途径,如G2M检查点、E2F靶点、DNA修复、糖酵解以及PI3K-AKT-mTOR信号通路,并在与癌症进展相关的生物过程中高度活跃,如缺氧、血管生成和上皮间质转化。相反,SUMO-C1主要富集于与肿瘤免疫相关的过程,如TNFA通过NF-κB信号通路、IL6-STAT3信号通路、补体、炎症反应以及IL2-STAT5信号通路,移植排斥信号通路。这表明,基于SUMO化调控基因的SUMO化模式可能会影响免疫微环境状态。SUMO-C2与不良预后相关的生物学机制可能是由于SUMO-C1的活跃免疫微环境和SUMO-C2的活跃基质微环境。SUMO-C1可能通过高度激活抗肿瘤免疫和抑制促癌进展的基质微环境,在肺腺癌中呈现出更好的抗肿瘤效果和更好的预后生存。
3.不同的SUMO化模式与不同的免疫微环境相关联
为了探索SUMOylation模式调控免疫微环境的潜在机制,作者使用ssGSEA算法计算了24种不同免疫细胞的丰度。热图用于可视化免疫细胞浸润的差异(图4A),Wilcoxon秩和检验用于比较SUMO-C1和SUMO-C2模式下免疫细胞浸润的差异(图4B)。值得注意的是,SUMO-C1显示出广泛的免疫细胞活跃状态,而SUMO-C2显示出免疫细胞的不活跃状态。B细胞、T细胞、T辅助细胞、中央记忆T细胞(Tcm)、效应记忆T细胞(Tem)、滤泡辅助T细胞(TFH)、Th17细胞、CD8 T细胞、细胞毒性细胞、树突状细胞(DCs)和肥大细胞在SUMO-C1组中显著高于SUMO-C2组。相反,Th2细胞和调节性T细胞在SUMO-C2中显著活化。此后,作者使用EPIC算法和TIMER算法计算了肺腺癌中的免疫细胞浸润水平,以进一步支持免疫细胞浸润水平的差异,并使用Wilcoxon秩和检验比较了SUMO-C1组和SUMO-C2组之间差异的显著性。作者发现SUMO-C1组表现出更高水平的免疫细胞浸润,特别是CD8 T细胞,据报道CD8 T细胞对肿瘤细胞具有杀伤作用,从而产生对肿瘤的保护性免疫(附图S3A,S3B)。此外,每个SUMO化调控基因与免疫细胞之间的Spearman相关性分析显示,CAPN3与多种免疫细胞(如CD8+T细胞(r = 0.32),DCs(r = 0.343),iDCs(r = 0.432),肥大细胞(r = 0.468),Tcm(r = 0.421),Tem(r = 0.275),TFH(r = 0.291),Th2细胞(r = 0.563)和Treg(r = 0.115))密切相关,表明CAPN3是肺腺癌肿瘤微环境中与免疫细胞浸润密切相关的SUMO化调控基因之一。总体而言,肺腺癌中的免疫微环境主要通过调节SUMO化调控基因来调控,主要是通过调节CD8+T细胞、肥大细胞、T辅助细胞、Tcm、Tem和Th2细胞等免疫细胞的水平来实现的(图4C)。
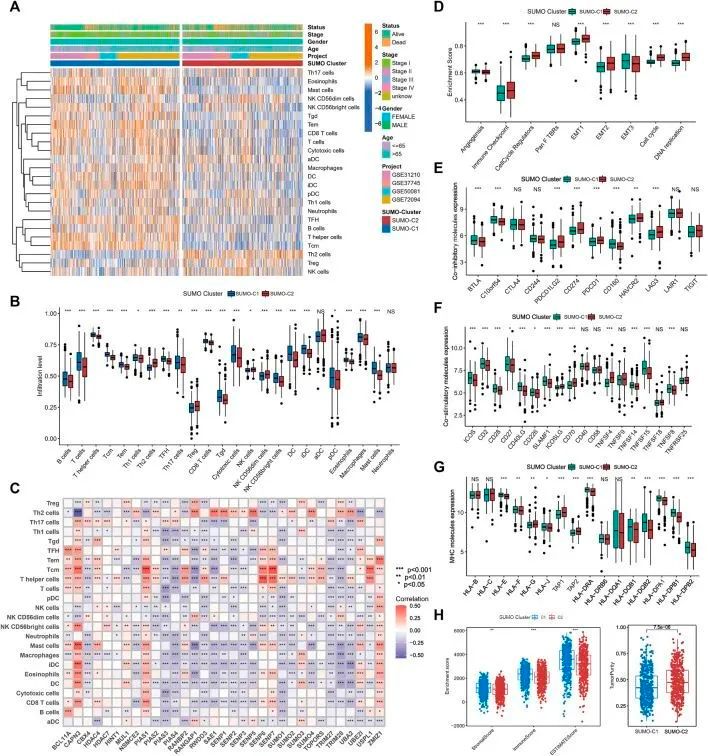
图4 肿瘤微环境在SUMO化模式之间存在显著差异
以上分析支持SUMO-C1代表一种具有肿瘤抑制免疫特性的TME类型。然而,根据作者之前对Hallmark基因集的GSVA富集分析,SUMO-C2表现出主要的促癌生物过程,并促进了基质微环境。此外,作者使用ssGSEA方法评估了血管生成、免疫检查点、细胞周期调节、Pan F TBRS、EMT和DNA复制的富集分数。ssGSEA结果显示,可以促进免疫逃逸的途径,如EMT1、EMT2和免疫检查点途径,在SUMO-C2组中得到了显著激活(图4D)。此外,SUMO-C1组显示出更高的共刺激和MHC分子表达,以及较低的共抑制分子表达(图4E-G),例如CD274、PDCD1和LAG3,这些分子现在常用于肺腺癌的免疫治疗检查点。最后,作者使用Estimate软件包对肺腺癌表达数据进行了免疫评分、基质评分和肿瘤纯度评分的评估,并发现SUMO-C1具有更好的免疫评分和更高的基质评分(图4H),而SUMO-C1具有较低的肿瘤纯度评分,这进一步解释了它与更好的预后的关联。总的来说,以上分析表明SUMO-C2 SUMO化模式促进了沉默的抗肿瘤免疫微环境和活跃的肿瘤发生基质微环境的发展。
4. SUMOylation模式相关基因(SPAGs)的PPI和SUMOylation基因组亚型的鉴定
为了进一步探索不同SUMO化模式下调控的潜在生物过程,作者使用R包limma识别出了906个显著差异表达基因(|FoldChange|>1.5,FDR<0.05)作为SUMO化模式相关基因(SPAGs)。这些差异表达基因与肺腺癌预后也有显著关联,表明SUMO化模式在决定预后中起着关键作用。KEGG功能注释显示SUMO化相关基因在细胞周期相关过程(细胞周期)、细胞粘附(细胞外基质受体相互作用)、免疫激活信号通路(补体和凝血级联反应、IL 17信号通路)等生物通路中显著富集(图5A),而GO功能注释显示富集的生物过程包括细胞周期相变的调节、细胞生长、体液免疫应答、细胞间连接和对缺氧的应答。
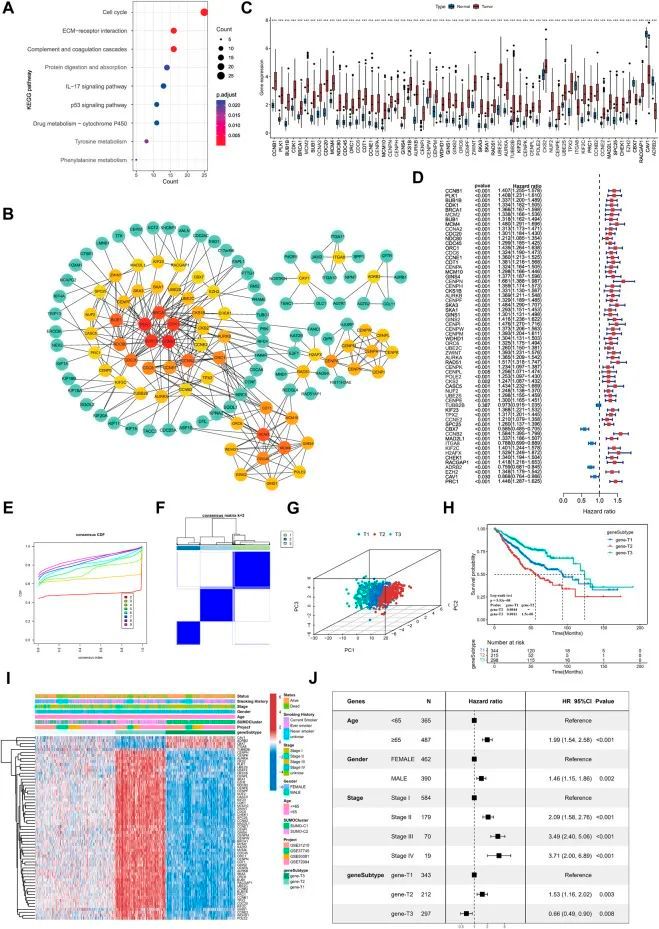
图5
接下来,作者利用STRING数据库构建了SPAGs的蛋白质相互作用网络(PPI,网络类型=物理子网络,最小所需互作用得分=0.7),并使用Cytohubba插件计算了节点之间的关系。然后,作者将与62个基因中的邻近节点≥5相关的基因分类为关键的SPAGs,并绘制了它们的相互作用(图5B)。在关键基因中,CCNB1具有最多的邻近节点,其次是PLK1、BUB1B、CDK1和BRCA1。最近的研究报告指出,PPI网络中的关键基因可以准确代表所有基因的功能特征。通过TCGA数据集进行的差异表达分析显示,关键基因在肺腺癌与正常组织样本中存在显著差异表达(图5C)。同时,关键基因广泛指示了显著的预后意义,CBX7、ITGA8、ADRB2和CAV1是肺腺癌的显著有利因素(图5D)。
根据确定的关键SPAGs进行了无监督的一致性聚类。通过CDF曲线(图5E、F),得到了三个基因亚型,即基因-T1、基因-T2和基因-T3。PCA分析表明,基于关键基因鉴定的三个基因亚型之间存在显著差异(图5G)。Kaplan-Meier生存分析表明,基因-T2与最差的预后相关,基因-T3与最好的预后相关,而基因-T1则属于中间预后结果,表明基因亚型具有不同的临床进展(图5H)。此外,热图显示了62个关键基因在三个基因亚型中的差异表达(图5I)。这与肺腺癌关键基因的预后效用结果一致,因为热图显示CAV1、ADRB2、CBX7和ITGAB8在基因-T3中显著上调,这些基因是肺腺癌的有利因素,而其他肺腺癌的风险因素在基因-T2亚型中显著上调。然后,作者将年龄、性别、病理分期和基因组亚型等预后特征与生存信息结合起来进行多因素Cox分析,结果显示,包括基因组亚型在内的所有上述预后特征都是肺腺癌的独立预后因素;基因-T2与基因-T1相比(HR = 1.53,p = 0.003),基因-T3与基因-T1相比(HR = 0.66,p = 0.008)(图5J)。最后,作者确定SUMO化调控基因在三种基因组亚型中显著差异表达,并且其在基因-T1亚型中的表达介于基因-T2和基因-T3亚型之间,这表明不同的基因组亚型进一步反映了SUMO化模式的差异。
5. SUMOylation评分的计算和预测意义
作者旨在确定SUMOylation修饰模式在肺腺癌中的预后价值和生物学意义,并开发一种基于SUMOylation模式的预后模型,用于评估个体肺腺癌患者的情况。为此,作者首先对62个关键的SPAGs进行单变量Cox分析,并结合LASSO回归筛选出最佳变量。最终,筛选出了8个SUMOylation关键基因,它们在正常组织和肺腺癌组织之间表达差异显著,并与肺腺癌预后显著相关。基于这些基因的表达及其系数,构建了一个基于SUMOylation的预后标志模型。使用Survival软件包将所有肺腺癌样本分为高风险组和低风险组,以计算最佳分割点。生存分析显示,得分较高的患者与较差的预后显著相关(log-rank p = 2.22e-16)(图6B);1年的ROC曲线下面积(AUC)为0.67,3年的AUC为0.68,5年的AUC为0.69,表明基于SUMOylation模型的风险评分相对于现有的众多预后模型具有较高的预测准确性(图6C)。多变量Cox回归分析包括年龄、性别、病理分期、吸烟史和风险评分,证实风险评分是评估患者预后的独立预测因子(低风险 vs. 高风险,HR = 0.42 (0.33, 0.54),p < 0.001)(图6D)。ADRB2和CBX7的表达与风险评分显著负相关(图6E)。高风险组观察到更多的死亡事件。
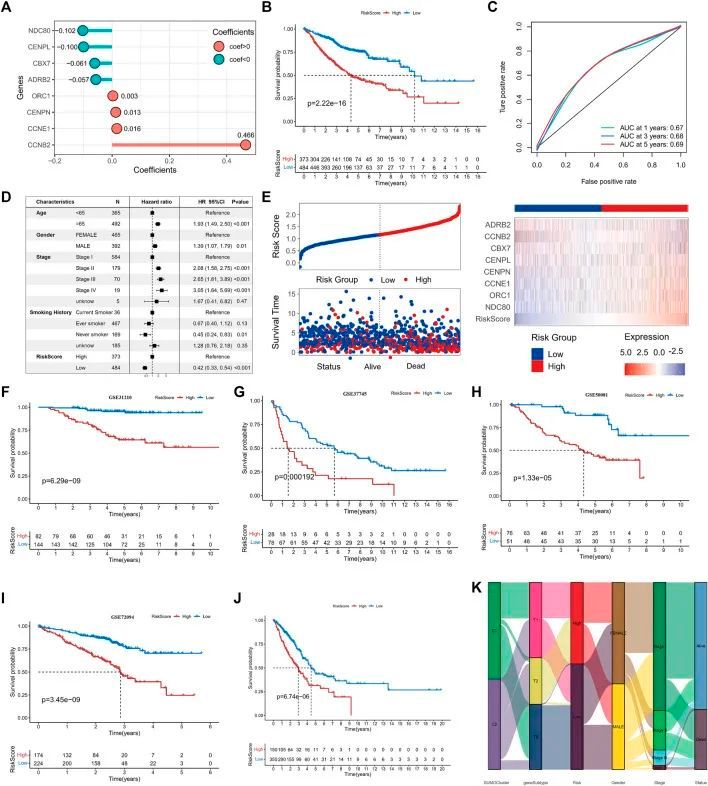
图6 SUMOylation评分的构建和预后价值验证
使用了四个数据集,GSE31210(图6F),GSE37745(图6G),GSE50081(图6H)和GSE72094(图6I),以及外部数据集TCGA-LUAD(图6J)来进一步验证SUMOylation评分的稳定性和预后价值。生存分析的结果显示,在所有数据集中,log-rank检验的p值均小于0.001,表明SUMOylation模型风险评分能够一致地预测患者的预后结果;ROC分析还显示了风险评分在预测肺腺癌预后方面的高诊断价值。TCGA肺腺癌队列的多变量Cox回归分析结合了年龄等各种预后因素,进一步证实了风险评分是肺腺癌的独立危险因素(低风险组与高风险组,HR = 0.52(0.38, 0.71),p < 0.001)。为了更好地理解SUMOylation模式与基因组亚型之间的直接关系,作者构建了一个桑基图,并观察到绝大多数SUMO-C2和一小部分SUMO-C1组成了基因组亚型-T1,然后几乎全部组成了低风险评分组(图6K)。
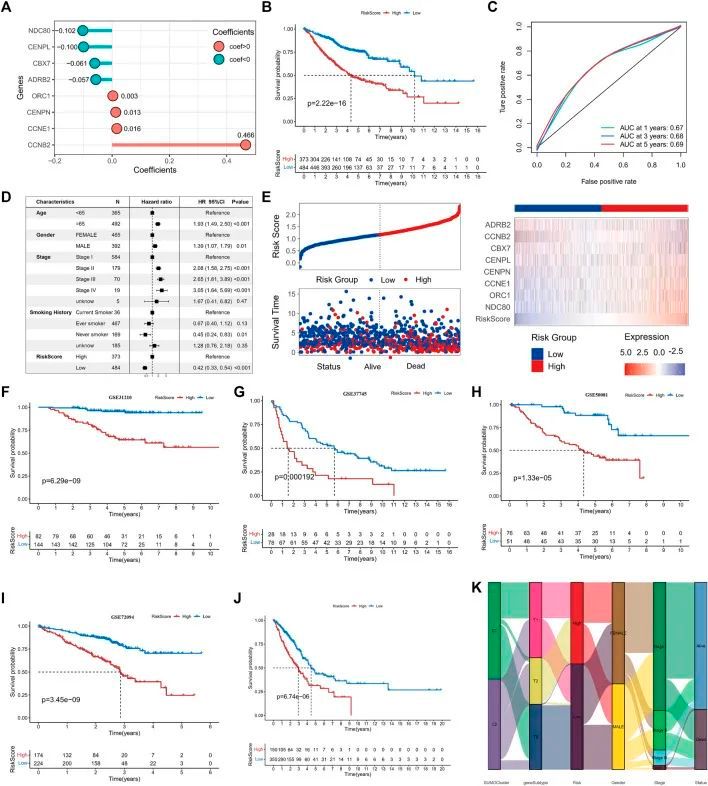
图6 SUMOylation评分的构建和预后价值验证
使用了四个数据集,GSE31210(图6F),GSE37745(图6G),GSE50081(图6H)和GSE72094(图6I),以及外部数据集TCGA-LUAD(图6J)来进一步验证SUMOylation评分的稳定性和预后价值。生存分析的结果显示,在所有数据集中,log-rank检验的p值均小于0.001,表明SUMOylation模型风险评分能够一致地预测患者的预后结果;ROC分析还显示了风险评分在预测肺腺癌预后方面的高诊断价值。TCGA肺腺癌队列的多变量Cox回归分析结合了年龄等各种预后因素,进一步证实了风险评分是肺腺癌的独立危险因素(低风险组与高风险组,HR = 0.52(0.38, 0.71),p < 0.001)。为了更好地理解SUMOylation模式与基因组亚型之间的直接关系,作者构建了一个桑基图,并观察到绝大多数SUMO-C2和一小部分SUMO-C1组成了基因组亚型-T1,然后几乎全部组成了低风险评分组(图6K)。
6.风险模型基因的实验验证
为了验证模型基因的表达水平,作者收集了18对肺腺癌患者的肿瘤组织以及癌旁正常组织,并进行了定量实时PCR。作者还分析了TCGA肺腺癌队列中模型基因的表达水平和预后价值。NDC80、CENPL、ORC1、CENPN、CCNE1和CCNB2在TCGA队列以及18对肺腺癌患者样本中均显著上调,高表达与肺腺癌的不良预后显著相关。然而,CBX7和ADRB2在肺腺癌肿瘤组织中显著下调,可能作为肺腺癌的有利预后因子。通过Wilcoxon秩和检验的比较显示,SUMO-C2与较高的风险评分相关(图7A),基因-T1具有中等风险评分,基因-T2具有最高风险评分,基因-T3具有最低风险评分,这意味着高风险和低风险评分的差异可能反映了不同SUMO化模式和基因组亚型所致的预后差异。为了进一步确定SUMO化评分与免疫浸润和其他生物过程之间的关系,研究了高风险和低风险评分组之间肿瘤发生微环境的差异。免疫检查点、细胞周期调节因子、EMT1、EMT2、细胞周期和DNA复制在高风险组中显著活跃(图7B)。通过Estimate软件包评估免疫浸润水平,发现高风险组的免疫评分显著较低,肿瘤纯度较高(图7C)。此外,Spearman相关分析显示SUMOylation评分与免疫评分之间存在显著的负相关,SUMOylation评分与肿瘤纯度之间存在显著的正相关,进一步证实了通过风险评分对不同SUMOylation模式中活跃生物过程的评估的准确性。
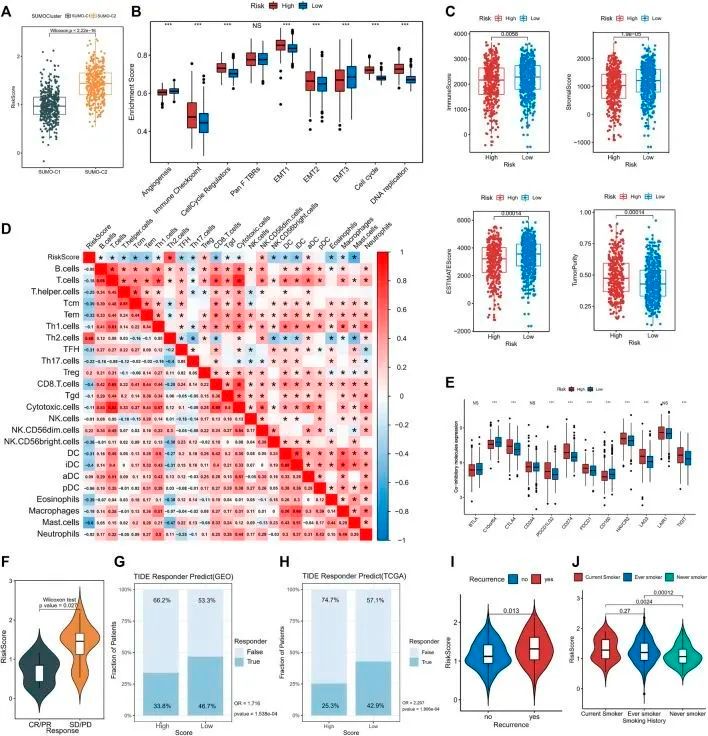
图7 SUMOylation得分与肿瘤微环境和临床特征的关联
随后,作者使用Spearman分析来研究风险评分与不同免疫细胞亚群之间的相关性,结果显示风险评分与各种免疫细胞水平呈显著负相关。风险评分与Th2细胞(r = 0.68)和Treg细胞(r = 0.2)呈显著正相关,与CD8+T细胞(r = -0.4)、Tem细胞(r = -0.33)、Tcm细胞(r = -0.39)、TFH细胞(r = -0.31)、CD56(明亮型)自然杀伤细胞(r = -0.36)、DCs(r = -0.31)、不成熟树突状细胞(iDC)(r = -0.4)和肥大细胞(r = -0.6)等免疫细胞呈负相关。此外,在肺腺癌中,Th1细胞、CD8 T细胞、T细胞、细胞毒性细胞以及巨噬细胞和iDCs的浸润程度之间存在密切相关性(图7D)。这些发现表明SUMO化调控基因参与了肺腺癌肿瘤的免疫细胞浸润和免疫调节。其中,Th2细胞、Treg细胞、CD8 T细胞和肥大细胞参与了免疫动态调节。作者随后评估了高风险组和低风险组之间的免疫检查点表达,以进一步研究SUMO化对免疫治疗反应的影响,并发现临床常见的免疫检查点共抑制分子,如CD274、PDCD1、CTLA4、PDCD1LG2、HAVCR2、LAG3和TIGIT,在高风险组中表达增加(图7E),而共刺激分子,如CD2、CD28和CD40LG,在高风险组中表达减少(附图S7D),表明SUMO化得分广泛调节免疫检查点的表达。此外,SUMO化还通过降低MHC分子的表达来抑制免疫微环境的激活(附图S7E)。对肺癌数据集GSE126044中的免疫治疗队列进行的SUMOylation模式在免疫治疗反应中的后续分析表明,响应组(CR/PR)具有低风险评分,而非响应组具有高风险评分(图7F),这解释了高风险患者免疫治疗反应较差的原因。同时,作者根据TIDE算法评估了GEO队列(高风险 vs. 低风险,OR为1.716,p值<0.001,图7G)和TCGA队列(高风险 vs. 低风险,OR为2.207,p值<0.001,图7H)中高和低SUMOylation评分组的肺腺癌患者的免疫治疗反应,并指出低风险患者更有可能从免疫治疗中获益。此外,复发性肺腺癌患者中观察到显著高的SUMOylation评分(图7I),吸烟者中观察到显著高的SUMOylation评分(图7J),这表明SUMOylation评分可能在全面评估肺腺癌患者的临床预后因素方面具有有效性。
7.肺腺癌化疗药物敏感性预测及诺模图构建
由于上述结果已经证实SUMOylation会导致肺腺癌肿瘤微环境发生显著变化,因此作者使用SUMOylation评分来表征肺腺癌患者对不同化疗药物的敏感性,以指导联合化疗方案的选择。根据肺腺癌组织中的mRNA水平,作者使用pRRophetic软件包计算了不同SUMOylation评分组的肺腺癌患者对各种化疗药物的IC50,并发现低SUMOylation评分组对AKT抑制剂VIII、贝沙罗汀、厄洛替尼、GDC0941、MK-2206等药物的敏感性高于高SUMOylation评分组(图8A)。相反,高SUMOylation评分组对A-443654、喜树碱、CGP-60474、顺铂、阿糖胞苷、多西他赛、阿霉素、伊莱斯克洛莫、紫杉醇和RO-3306等化疗药物敏感(图8B)。这些发现表明SUMOylation评分能够准确反映SUMOylation模式之间的显著生物学差异,并与临床预后特征相关。
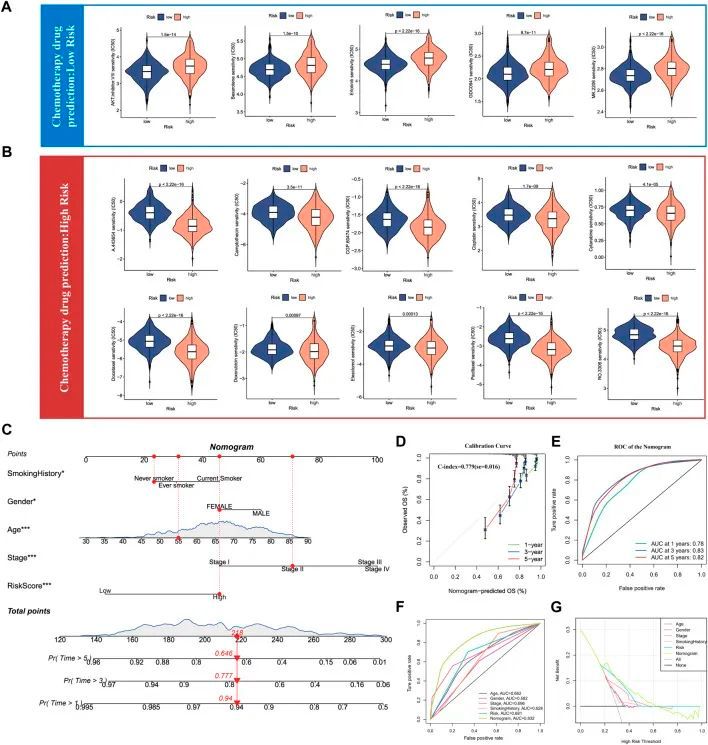
图8 肺腺癌化疗药物敏感性分析和Nomogram构建
与此同时,正如作者之前通过多变量Cox分析所说明的,年龄、性别、病理分期、吸烟史和SUMOylation评分都可以作为肺腺癌独立的预后因素。作者将上述显著的预后因素结合起来构建柱状图,以更准确、高效地预测肺腺癌患者的总体生存率(图8C)。校准曲线显示,通过诊断模型预测的1年、3年和5年的生存率与实际肺腺癌患者的生存率非常接近(图8D),而时间相关的ROC曲线显示1年、3年和5年的AUC分别为0.78、0.83和0.82,表明该模型具有较高的预测准确性。杨等人报道,0.9≥ AUC>0.8表示具有出色的区分度,这表明该模型具有显著的预后表现(图8E)。此外,对多个临床预后特征的预测性能进行比较后发现,相对于其他任何临床特征,该模型在ROC曲线(图8F)和DCA决策曲线(图8G)上提供了最佳的预测效用。最后,为了进一步验证多因素回归模型Nomogram的准确性,作者使用三个独立的肺腺癌队列评估了Nomogram的ROC曲线下面积(AUC),分别为0.79、0.81和0.89。在三个独立的肺腺癌队列中进行验证支持作者的Nomogram的准确性明显优于大量已报道的肺腺癌预后模型(Mo等,2020年;Song等,2020年;Chen等,2021年)。
总结
SUMO化模式可以很好地决定肺腺癌的肿瘤微环境特征,特别是免疫细胞浸润状态。SUMO化评分表明SUMO化与免疫细胞相互作用之间的关系,并具有显著的预后价值,可用于预测肺腺癌的免疫治疗和化疗反应。总之,SUMO化模型和评分对于确定肿瘤微环境状态和预后预测具有很高的价值。