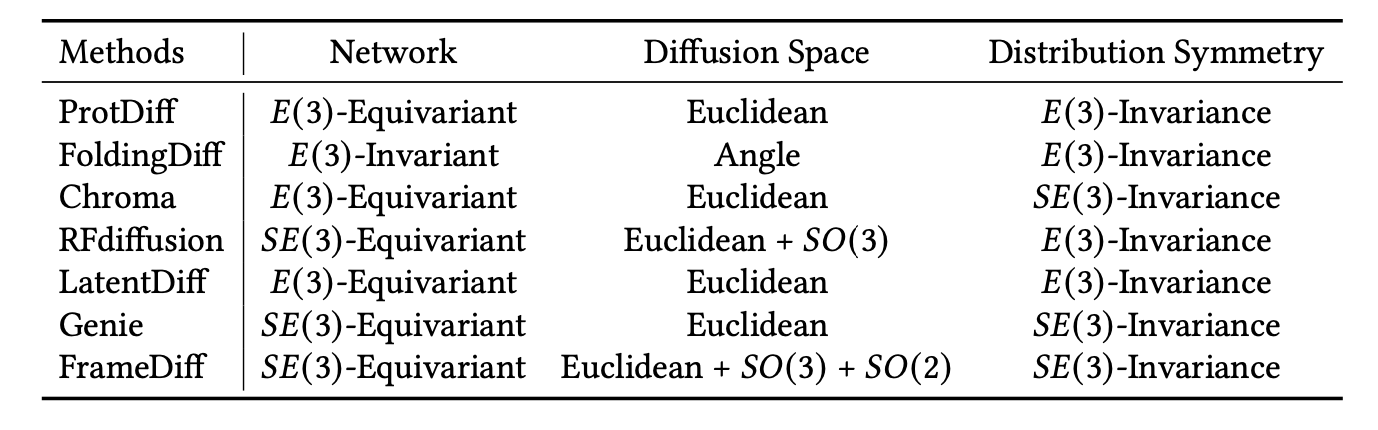
SUMOylation是后转录蛋白质修饰的重要组成部分,以动态方式调节着数千种蛋白质。SUMOylation的失调在许多癌症中被检测到。然而,SUMOylation在前列腺癌(PCa)中的全面作用尚不清楚。
1. 不同表达的与预后相关的SRG的鉴定
作者从3个独立的队列中获得了总共663名患者,包括TCGA-PRAD、GSE46602和GSE70770,并将这些患者纳入以下分析中。TCGA-PRAD队列以3:2的比例随机分为两个队列,即TCGA_train和TCGA_test。这些患者的基本临床特征总结在表1中。首先,作者从MSigDB网站提取了SRGs,并比较了它们在TCGA数据库中的前列腺癌组织和相邻非肿瘤组织中的表达水平。不同表达的SRGs的分布情况以火山图显示,截断值为|log2FC| > 1和FDR < 0.05(图1A),并以热图形式展示(图1B),其中包括29个上调的SRGs和10个下调的SRGs。然后,作者使用单变量Cox回归模型最终筛选出了11个高风险的SRGs和1个保护性的SRG,这些SRGs与前列腺癌的BCR密切相关(图1C)。此外,这12个基因在484个前列腺肿瘤样本中的突变频率仅为2.27%,并且几个基因之间存在同时突变的情况(图1D、E)。这些发现表明这些预后相关的SRGs非常稳定且相互关联。

图1 在前列腺癌中鉴定出12个关键差异表达的SRG
2. 在TCGA队列中构建预测模型
作者使用LASSO回归和10折交叉验证从12个候选基因中筛选出最重要的SRGs(图2A、B)。最后,作者选择了两个SRGs(DNMT3B和NUP210),并使用多变量Cox回归分析构建了预后模型。这两个基因在BCR上的风险比(HR)显示在图2C中,表明它们都是前列腺癌BCR的显著危险因素。作者使用上述公式计算了TCGA队列中每个患者的风险评分。然后,作者将这些患者分为高风险组(n = 212)和低风险组(n = 212),中位数为1(图2D)。作者注意到,随着风险评分的增加,BCR患者的比例也增加(图2E),高风险组的BCR无进展生存率比低风险组在整个TCGA训练队列(图2F)、TCGA测试队列(图2G)和整个TCGA-PRAD队列(图2H)中都要差。与所有差异表达的预后SRGs相比,作者建立的风险评分可以通过主成分分析(PCA)更容易地将这些患者分为两个亚组,无论是在TCGA训练队列还是整个TCGA-PRAD队列。而t-分布随机邻域嵌入(t-SNE)方法也表明风险评分在TCGA-PRAD队列中具有良好的区分能力。

图2 建立预测模型的构建
随后,作者调查了风险评分与年龄(≤65和>65)(图2I)、N分期(N0和N1)(图2J)、T分期(T2、T3和T4)(图2K)、M分期和Gleason评分等多个临床特征之间的关系。作者发现,较高的风险评分与病理分期的增加显著相关,这意味着预后较差。接下来,作者想知道风险评分是否可以作为预测前列腺癌患者预后的独立预测因子。如图2L、M所示,T分期和风险评分在单变量和多变量Cox回归分析中均是独立的预后预测因子。风险评分绘制的ROC曲线下面积(AUC)为0.708,高于年龄(AUC=0.567)、T分期(AUC=0.649)和N分期(AUC=0.536)(图2N)。这些结果表明作者构建的预后模型具有良好的特异性和敏感性。
3. 在GEO队列中验证风险评分
作者已经成功构建了TCGA队列中的风险评分,并验证了它与患者预后和临床病理特征的紧密关联。接下来,作者希望在GEO的两个外部队列(GSE46602和GSE70770)中验证这个风险评分。作者使用上述公式计算了GSE46602和GSE70770队列中每个患者的风险评分。然后,作者根据风险评分的中位数将这些患者分为高风险和低风险亚组。使用PCA和t-SNE方法,作者可以通过风险评分很好地区分GSE46602和GSE70770队列中的患者。与TCGA队列中的患者类似,GSE46602(图S1N)和GSE70770队列中的患者比例与风险评分呈正相关。尽管在GSE46602队列中缺乏统计学意义,但作者注意到高风险组的患者无论是在GSE70770队列(图3A)还是在由GSE46602和GSE70770队列组成的元队列中(图3B),预后都显著较差。然后,作者使用随机效应模型对四个独立队列进行了荟萃分析,并计算了风险评分对前列腺癌预后的汇总风险比(图3C)。毫不意外,风险评分的汇总风险比为1.17(95% CI:1.03-1.33),表明风险评分是前列腺癌复发的有效危险因素。

图3 GEO队列中风险评分的验证
随后,作者构建了一个用于预测前列腺癌患者1年、3年和5年BCR概率的Nomogram,该Nomogram使用风险评分和T分期进行构建,在多变量Cox回归分析中具有统计学意义(图3D)。如Nomogram所示,作者随机选择了一个风险评分高且T4分期的患者,计算得到总分为139,相应的1年、3年和5年BCR无病生存概率分别为0.92、0.711和0.624。Nomogram构建的1年、3年和5年ROC曲线下面积(AUC)分别为0.633、0.675和0.708,表明其具有适度的预测效能(图3E)。1年、3年和5年的校准曲线展示了实际BCR概率和预测BCR概率之间的良好一致性(图3F)。总之,作者建立的模型在外部队列中表现出强大的区分能力,Nomogram在预测前列腺癌患者BCR方面表现良好。
4. 肿瘤突变负荷与风险评分之间的相互作用
接下来,作者想要探讨肿瘤突变负荷(TMB)与风险评分之间的相互作用。首先,作者分析了低风险组(图4A)和高风险组(图4B)中前20个基因的TMB频率。作者发现高风险组的总突变频率(62%)高于低风险组(43.41%)。对于前列腺癌中一些常见的突变位点,如TP53和FOXA1,在高风险组中的突变频率显著较高。如图4C、D所示,TMB与风险评分呈显著正相关。此外,TMB高的患者的无复发生存率较差(图4E)。当将TMB和风险评分结合起来时,作者可以将患者分为四个亚组,并发现风险评分高且TMB高的患者具有最差的临床预后(图4F)。总的来说,TMB和风险评分的组合对于预测前列腺癌患者的预后具有更好的预测能力。
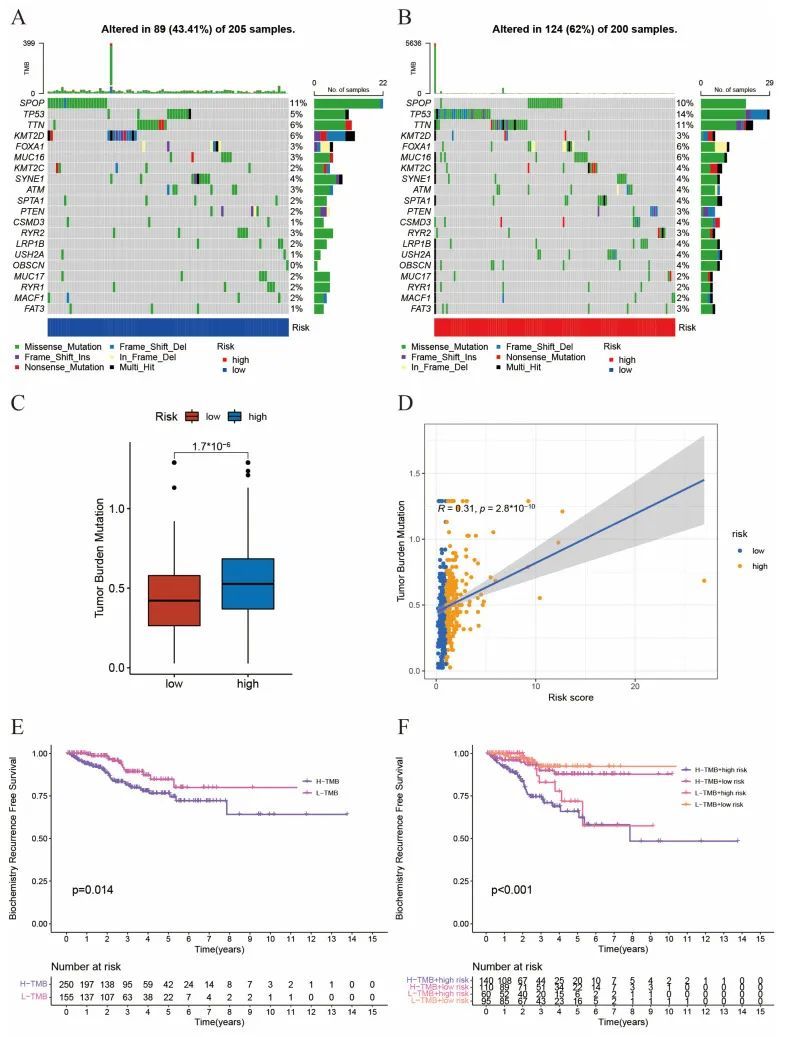
图4 肿瘤突变负荷与风险评分之间的相互作用
5. 肿瘤微环境与风险评分的关系
此后,作者评估了肿瘤微环境(TME)与风险评分之间的关系。首先,作者调查了不同风险评分组中各种常见免疫检查点(ICP)基因的表达水平,发现大多数ICP在高风险组中上调表达,例如CD276、CTLA4和NRP1(图5A、B)。有趣的是,CD276,也被称为B7-H3,在包括前列腺癌在内的各种癌症中是一个有前途的新型免疫治疗靶点。在作者的研究中,作者发现CD276的表达与风险评分显著正相关,这表明风险评分可能是评估靶向B7-H3治疗疗效的预测因子。此外,作者评估了风险评分与三个新发现的标志物ALDH1、CD34和CD117(KIT)[19, 20]之间的相关性,这些标志物据报道与前列腺癌的进展有关。作者发现风险评分与ALDH1的表达水平呈正相关。然后,作者使用ESTIMATE算法探索了风险评分与肿瘤纯度之间的关系(图5C)。作者发现在低风险组中,基质评分、免疫评分和估计评分都显著高于高风险组,这意味着高风险组中肿瘤纯度较高,免疫细胞浸润较低。然后,作者利用七种算法评估肿瘤微环境特征与风险评分之间的关系(图5D、E)。值得一提的是,风险评分与癌相关成纤维细胞浸润比例、M2巨噬细胞浸润比例和T细胞调节细胞(Tregs)浸润比例呈正相关,这些细胞已知会导致免疫抑制和肿瘤促进。而风险评分与M1巨噬细胞浸润比例和CD8 T细胞浸润比例呈负相关,这些细胞可能具有抗肿瘤作用。

图5 肿瘤微环境与风险评分之间的关系
6. 免疫疗法和化疗的药物敏感性分析
作者希望调查风险评分是否能在预测免疫疗法和化疗的疗效方面发挥作用。作者使用免疫表型评分(IPS)来评估免疫疗法的疗效,较高的IPS评分意味着对免疫疗法的反应更好。根据患者对抗PD-1和抗CTLA-4免疫疗法的使用情况,作者将患者分为四个亚组:CTLA-4阴性PD-1阴性(图6A),CTLA-4阴性PD-1阳性(图6B),CTLA-4阳性PD-1阴性(图6C)和CTLA-4阳性PD-1阳性(图6D)。作者发现所有这些亚组的IPS评分均显著低于低风险组,这表明低风险组的患者可能更能从免疫疗法中获益。然后,作者使用oncoPredict软件包来预测一些常用的化疗药物(如多西他赛、顺铂、环磷酰胺、紫杉醇和长春新碱)的疗效,发现高风险组的敏感性评分显著低于低风险组,这表明对化疗的反应更好(图6E-I)。总结一下,作者的研究结果表明,高风险评分的患者可能会从化疗中获益更多,而不是免疫疗法。
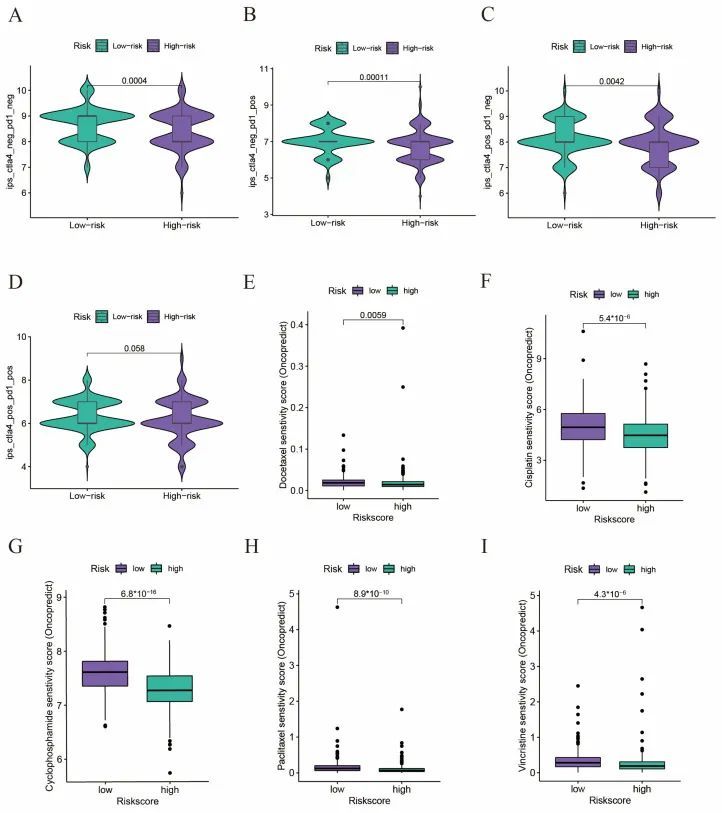
图6 免疫疗法和化疗中的药物敏感性分析
7. 基因集富集分析
此外,作者进行了GSEA分析,分别探索了高风险和低风险亚组中激活的信号通路。作者发现低风险亚组中前五个激活的HALLMARK通路分别是“脂肪生成”、“上皮间质转化”、“雌激素反应后期”、“肌肉生成”和“氧化磷酸化”(图7A)。相反,高风险亚组中富集的前五个信号通路是“E2F靶点”、“G2M检查点”、“干扰素α反应”、“有丝分裂纺锤体”和“MYC靶点V1”(图7B)。此外,GSVA显示风险评分与Wnt/β-Catenin信号通路、PI3K/AKT/mTOR信号通路和MYC信号通路呈正相关,这些通路与细胞生长和肿瘤发生密切相关(图7C)。
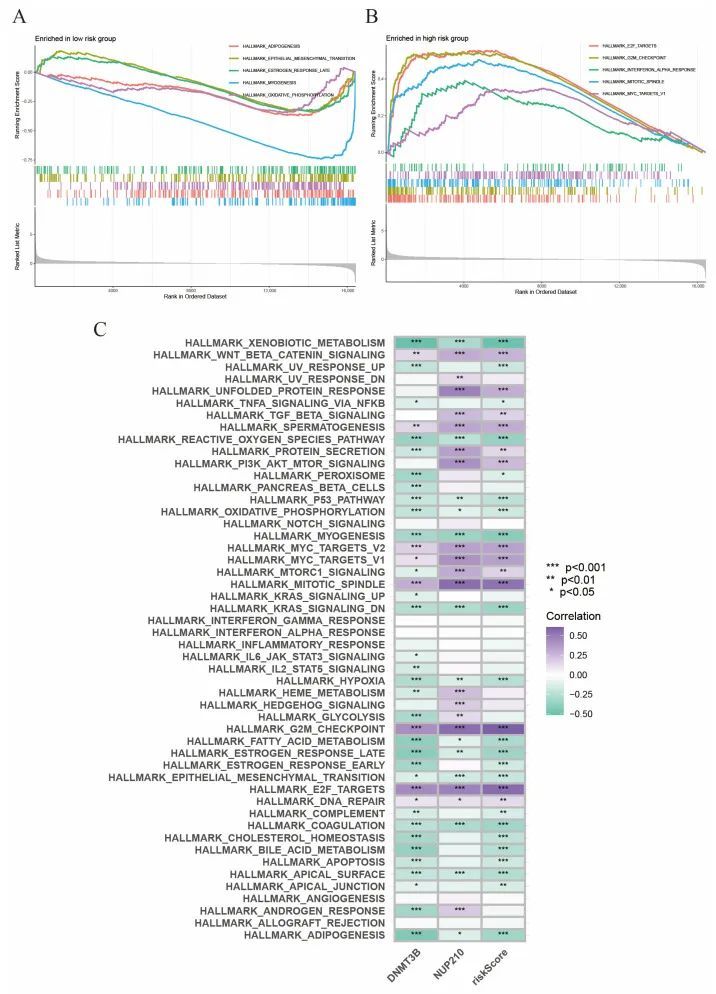
图7 GSEA 和 GSVA
8. 两个关键SRG的实验验证
最后,作者分析了SUMOylation风险模型中这两个重要基因的表达情况。与正常组织相比,DNMT3B(图8A)和NUP210(图8B)在前列腺癌组织中的表达水平上调。RT-qPCR揭示了mRNA水平的表达水平,作者发现NUP210在前列腺癌细胞系中的表达水平明显较高(图8C)。令人惊讶的是,作者在前列腺癌细胞系和正常前列腺细胞系之间并未发现DNMT3B的显著差异(图8D),需要进一步研究。免疫印迹显示,NUP210在前列腺癌细胞系中显著富集,而在正常前列腺上皮细胞系中并未观察到(图8E)。
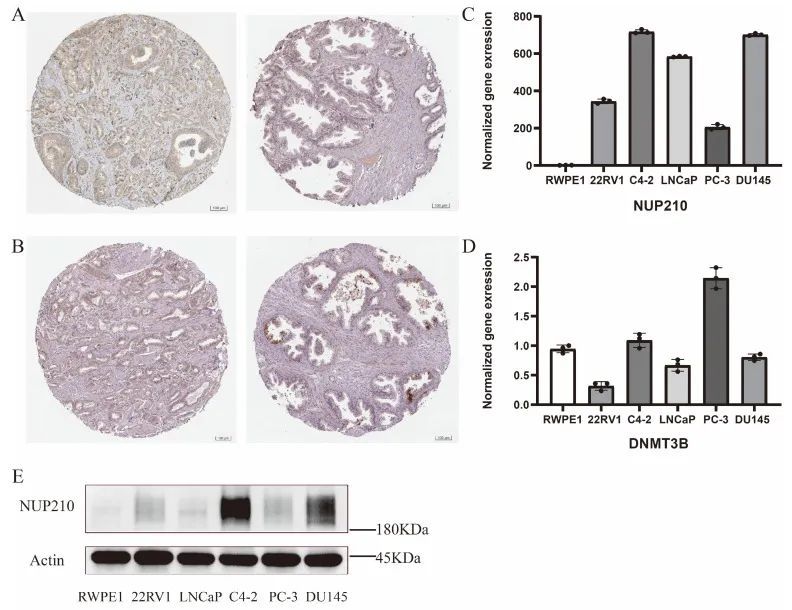
图8 验证了mRNA、蛋白质和组织学水平上两个重要的SRGs
总结
总之,本研究阐明了SUMOylation相关基因在前列腺癌中的综合作用,并为前列腺癌的管理提供了新的见解。同时,作者将风险评分与TMB、TME浸润、预后以及对化疗或免疫治疗的反应进行了相关性分析。作者还建立了一个用于预测前列腺癌患者预后的评分模型。重要的是,作者强调了NUP210的作用,并为进一步研究提供了新的靶点。对SUMOylation的更好理解和利用SUMOylation风险评分可以帮助精确治疗并促进前列腺癌的预后。