肠道微生态工程化改造
Engineering the gut microbiome

Review Article, 2023-6-16, Nature Reviews Bioengineering
DOI:10.1038/s44222-023-00072-2
原文链接:https://www.nature.com/articles/s44222-023-00072-2
第一作者:Xiaowu Bai(白小武);Ziyu Huang(黄子誉)
通讯作者:Guoxin Li(李国新);Tao Zuo(左涛)
合作作者:Anna M. Duraj-Thatte, Matthias P. Ebert, Fen Zhang, Elke Burgermeister, Xue Liu, Benjamin M. Scott
主要单位:
中山大学附属第六医院
中山大学广东省胃肠病学研究所
中山大学人体微生态与老年慢性疾病教育部重点实验室
- 摘要 -
人类胃肠道含有数千种微生物,包括细菌、古细菌、真菌和病毒,它们共同构成了肠道菌群。近十多年的大量研究已经充分证明了肠道菌群与人体健康和疾病之间的密切联系,其生态失调与许多疾病的发病机制有关,包括动脉粥样硬化、哮喘和糖尿病等等。本文系统总结了工程改造肠道微生物组在人类健康和疾病中的应用,并批判性地讨论了它们的转化潜力。除专注于基因工程方法,本文也讲述了跨学科工程化补充策略,例如胶囊、联合电子设备、正交饮食工程和粪便微生物移植(FMT)。对肠道微生物进行工程改造,以诊断和调节菌群失调,进而促进健康和治疗疾病,这是未来重要的研究和发展方向。
- 正文 -
肠道微生物组包含超过330万个基因,是人体基因组的150倍,这种遗传复杂性提供了人类基因之外的大量可操纵遗传模块。通过基因工程改造肠道微生物,可以让微生物定植并产生特定的生物活性产物,比如当需要长期口服药物时,这种工程微生物可以绕过频繁给药的要求。不过,因为肠道菌群是一个复杂的生态系统,单一工程菌可能会在该系统中被淘汰,为此,对肠道菌群中的一组关键微生物联合体进行生态集体编辑可能是一种有前途的方法。
1. 工程微生物的类别
工程细菌
合成生物学中使用的细菌易于基因改造、大规模生长和低毒性影响了药物化合物原位细菌合成载体的选择。因此,大肠杆菌 Nissle 1917和乳酸菌等传统益生菌菌株是工程化和部署到肠道的典型选择。许多被美国食品和药物管理局(FDA)普遍认为安全的乳酸菌可以在小肠和结肠定植,并可以支持各种CRISPR/Cas系统,使其适合异源生产白细胞介素IL-10,抑制病原体生长和生物传感目的。同样,双歧杆菌属的细菌可以选择性地在实体瘤中定植和生长,已被用作递送和生产抗癌剂的载体。来自拟杆菌属的其他菌株产生外膜囊泡以接近和影响宿主的肠上皮细胞和免疫细胞,使它们成为疫苗载体的合适候选者。
胃肠道中天然微生物的巨大多样性在很大程度上仍未得到开发。到目前为止,70% 的肠道微生物尚未离体培养 ,这在很大程度上限制了可用于载体开发的细菌库。另一个限制是,尽管可用于工程微生物的技术范围很广,但大多数天然肠道细菌不适合使用当前技术进行基因改造。这个问题因工程细菌需要在缺氧和恶劣的环境中发挥作用而进一步恶化,即肠道,其中包含其他几种竞争性共生体。因此,需要新技术来设计稳健的基因回路,并赋予经过修饰的微生物物种生存能力,并在肠道中战胜自生细菌。另一个挑战是肠道驻留微生物的组成和功能在横向(即肠粘膜与内腔)和纵向(结肠与回肠)上都不同,这进一步使工程细菌准确递送到目标区域变得复杂。尽管存在这些挑战,但肠道细菌在分类学和遗传水平上的组成和功能多样性具有很大的潜力,可以设计出针对癌症、炎症性肠病(IBD)和糖尿病等疾病的治疗菌株。
工程真菌
除了细菌之外,人类胃肠道也有多种真菌物种,其中一些已经被设计用于治疗应用。例如,布拉酵母菌(Saccharomyces boulardii,酿酒酵母的一个亚种)是一种常用的益生菌,经过改造可在哺乳动物肠道中合成小分子。还有通过改造酵母检测促炎化学物质,同时产生相应的自我调节反应进行中和,这种“可自我调节”的酵母益生菌可抑制小鼠IBD肠道炎症,同时保持肠道微生物组多样性。真菌细胞比细菌大大约100倍,并且与原核细胞不同,真菌细胞可以进行真核细胞的翻译后修饰。因此,改造真菌的工程工具箱更大,并且可能表达比细菌更广泛的化合物。
工程病毒
除了细菌和真菌外,肠道微生物组还含有病毒,其数量是细菌的1-10倍,大部分是噬菌体。噬菌体已被用于靶向人体中的有害微生物,并且已设计出不同的策略来提高其抗菌活性并扩大其应用范围。例如,将基因dspB引入噬菌体基因组,使宿主细菌能够表达生物膜扩散酶,以分解细菌生物膜,并在表达时增加其抗菌活性。将CRISPR-Cas基因和靶向宿主细菌DNA的RNA指导序列引入噬菌体基因组,使它们能够在感染宿主细菌后充当序列特异性抗菌剂。工程化噬菌体的好处包括与细菌相比,它们的基因组更小,物理尺寸更小,这有利于基因编辑和肠道内的靶向扩散。此外,噬菌体在体外是无法存活的生物实体,这简化了它们的保存和运输,特别是与厌氧细菌相比。最后,噬菌体是不可复制的,并且在其细菌宿主耗尽后会迅速从哺乳动物体内清除,因此它们被认为对于临床应用来说通常是安全的。
2. 肠道微生物组的整体调节
传统上单独使用单一微生物菌株或少数益生菌菌株对于治疗某些疾病是无效的,包括乳糜泻和胃肠炎。整体肠道微生物组的工程广泛包括重塑肠道微生物组的组成和生态的任何方法,从天然肠道细菌的大规模遗传改造到外源或合成微生物群落的大规模输入。这种方法比工程化单一微生物更强大(图2a),对肠道环境挑战具有更强的抵抗力,由于资源共享和分工而减少代谢负荷,并增强代谢能力。实现整体微生物组工程的主要障碍是,大多数肠道相关微生物都难以进行基因改造,并且没有可用的工具来进行基因改造。一次改造不止一种生物体。
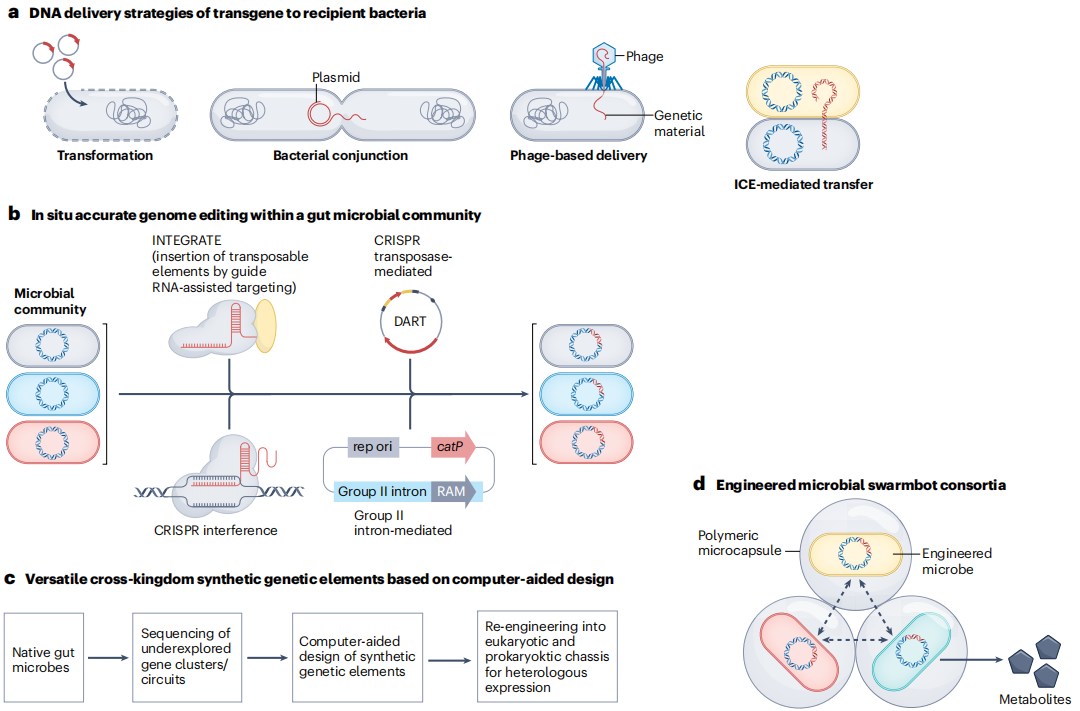
图2 肠道微生物的整体调节策略
a,用于编辑肠道细菌的DNA递送方法,包括转化、质粒接合、基于噬菌体的递送以及整合和接合元件(ICE)介导的转移。
b,通过引导RNA辅助靶向(INTEGRATE)、CRISPR转座子介导的DNA编辑一体化RNA引导CRISPR–Cas转座酶(DART)、CRISPR干扰和基于接合质粒的II组内含子插入转座元件允许对具有肠道微生物群落的物种进行同步且准确的基因组编辑。
c,对来自肠道微生物组的未充分探索的基因簇和回路进行测序并通过计算重新设计以允许广泛的宿主表达。这些重新设计的杂合合成调控元件可以在细菌和酵母异源宿主中表达,并传递到跨界宿主。
d,微生物群机器人由封装在聚合物微胶囊中的不同工程微生物组成,它们以高通量和协同的方式发挥作用。由于空间隔离,胶囊为每个亚群提供了独立的生长空间,而胶囊的多孔结构允许生物大分子的运输,以实现亚群之间的交流或协作。
应对这些挑战的策略可能包括修改微生物群落中的共同或互补电路功能。为此,多重CRISPR(通过在微生物组中设计大量向导RNA或Cas酶)或带有遗传压缩的联合转录编程(将工程转录因子与同源模块启动子配对)可能有用。例如,INTEGRATE方法,允许同时准确地RNA引导DNA整合Klebsiella oxytoca和Pseudomonas putida中的10个基因(图2b)。尽管在这种情况下仅用于两个物种,但这种方法可以扩展到设计多个目标,甚至达到微生物组水平。另一种策略包括结合环境转化测序(ET-Seq,基于非靶向转座子插入,以识别微生物群落中遗传上易处理的成分)和DNA编辑一体化RNA引导的CRISPR-Cas转座酶(DART)系统,从而实现肠道微生物的群落级编辑(图2b)。使用这种技术,已经在婴儿肠道微生物群落中完成了菌株特异性编辑。
为了应对基于外源DNA的遗传修饰,细菌发展出了许多复杂的防御机制,例如限制性修饰和CRISPR-Cas系统,这些机制限制了外源元件的进入,从而降低了基因工程的效率。克服这一问题的一种策略是在工程微生物引入宿主之前或在原位(in situ)提高DNA摄取效率。在这方面,高通量基因转移系统(包括涵盖肠道微生物组所有五个门的88种天然肠道细菌)系统地建立了接合转移条件、质粒复制起点、选择性和反选择性抗生素的多因素池、不同的培养基类型和细菌宿主菌株,以促进DNA转移至受体细菌和下游遗传操作。通过优化管道中报告的接合和转化条件,确定了CRISPR干扰或基于II组内含子的基因转移方法,并将其应用于38种肠道梭菌中的27种(图 2b)。使用该工具集瞄准非模型微生物会导致宿主发生生理变化,包括产生短链脂肪酸和次级胆汁酸。
类似的整体遗传操作策略包括将生物合成基因簇重新设计为合成遗传元件(SGE),这些元件在广泛的原核生物和真核生物宿主中异源表达(图 2c)。具体而言,开发了一种计算机辅助设计策略,将生物合成基因簇重新设计为SGE,包括优化编码序列、耗尽二级结构以及去除内部核糖体结合位点和转录终止子,以将生物合成能力与菌株特异性调控解耦层。接下来,联合开发了用于跨界表达的合成酵母和细菌转录起始,以及用于SGE动员的染色体整合着陆垫。最后,SGEs被转移到五种细菌和一种酵母中,所有六种细菌都产生了具有生物活性的物质。这种异源表达系统能够通过替代的可操纵微生物宿主应用不同的肠道微生物基因簇或电路。
另一种使不同肠道物种的不同遗传元件功能化的方法是通过在原位群落范围内的水平基因转移对哺乳动物微生物群进行遗传修饰。具体来说,将IncPα家族RP4结合系统引入大肠杆菌供体菌株,使修饰后的细菌能够非特异性地结合到小鼠肠道中的革兰氏阴性和革兰氏阳性细菌中。总的来说,这些技术进步大大增加了可用于改造整体肠道微生物组的工具,并提高了我们识别适合DNA转移的微生物的能力,尽管绝大多数肠道微生物仍然顽固。
除了对肠道微生物组进行基因改造外,还提出了由跨越肠道微生物组五个门的天然细菌物种组成的合成微生物群落,以在转移和定植时“改造”受体的肠道微生物组。例如,使用合成微生物群落来改变小鼠体内尿素的群落代谢活性。在肝硬化患者中,细菌脲酶催化宿主来源的尿素在肠道中转化为氨和二氧化碳,导致神经毒性和脑病。用移植的Altered Schaedler菌群(包含八种具有低脲酶活性的细菌)替代内源性小鼠肠道微生物组,有效降低了肝损伤小鼠的发病率和死亡率。
同样,合理设计的11株细菌群落触发了CD8+ T淋巴细胞的刺激,进而分泌IFNγ并增加了小鼠在定植后对单核细胞增生李斯特氏菌感染的抵抗力。来自天然肠道微生物群梭状芽胞杆菌簇IV、XIVa和XVIII的另一个细菌群落(包含17个菌株)增强了调节性T(Treg)细胞的募集,并减轻了小鼠的结肠炎和过敏性腹泻。其他群落可以包括从人类中分离出来的多达104种选定的本地细菌物种,这些细菌在移植到无菌小鼠体内后可以稳定定殖并抵抗致病菌株。数学模型还可用于选择最佳的免疫诱导细菌群落,以实现最佳的微生物生态和微生物-免疫相互作用。该策略有助于合理选择和设计用于免疫调节生物治疗的合成微生物群落。未来,可以通过对每个组成物种进行基因改造,从生态角度增强其整体功能和协作网络,从而进一步改善微生物的合成群落。
与单一菌株相比,工程微生物联合体(来自不同物种或同一物种但不同菌株的微生物的集合,通过交换营养物质、交叉喂养或执行程序化行为彼此相互作用)受益于物种之间的沟通、分散劳作、空间组织、抗扰动的鲁棒性和较低的代谢成本。通过诱导每个种群执行单一职责作为整体回路功能的一部分,可以进一步设计联合体中菌株之间的分工。例如,由封装在由壳聚糖制成的聚合物微胶囊中的各种工程细菌组成的微生物“swarmbot”能够使天然和/或转基因微生物共存,并以高通量方式划分其功能。3D交联聚合物微胶囊捕获天然或工程微生物,但允许小分子和蛋白质的转移。此外,还组装了34株微生物群机器人联盟来表达红色荧光蛋白;每个微生物群机器人都包含一个具有密度依赖性自溶回路的菌株和一个编码用于合成红色荧光蛋白的成分的质粒。通过质谱分析在培养基上清液中确认了微生物群机器人的所有基本成分,并执行了所需的活动(图 2d)。
类似地,更广泛的意义上,FMT和饮食也可以被认为以整体方式“改造”人类肠道微生物组。FMT通过将健康供体的粪便转移到肠道微生物群受到干扰的接受者(例如患有艰难梭菌感染(CDI)、IBD和糖尿的病患者)的胃肠道来重建肠道微生物群平衡。尽管FMT具有总体较高的安全性,并已证明对肠道微生物群失调疾病有效,但FMT的临床实践仍需谨慎。一名骨髓增生异常综合征患者在FMT后死于菌血症:发现产生超广谱β-内酰胺酶(ESBL)的大肠杆菌可从供体传播给受体。因此,FMT必须通过供体微生物组的准确选择或定制修改(例如生物合成和组成微生物的组合)来进一步完善。相比之下,饮食是塑造整个肠道微生物群的一种温和但多能且多功能的策略。此外,饮食调节通常是安全的,一旦达到治疗目标就可以停止。具体来说,正交饮食生态位工程(orthogonal dietary niche engineering,一种基于在饮食中间歇性添加独特营养素以动态调整肠道中感兴趣微生物的存在和丰度的方法)有助于识别能够精确、持久调节肠道的功能性饮食和饮食成分微生物组。与基因工程相比,FMT和饮食调节更具可扩展性且更容易获得,并且宿主发生并发症或效率降低的风险更低。通过FMT和饮食进行肠道微生物组工程需要个性化,因为每个人和疾病都有不同的生态系统,这些生态系统有利于或不利于某些微生物物种的定殖。因此,需要从单个物种和整体微生物组生态学的角度评估肠道生态位中的微生物相容性。
3. 工程微生物的应用
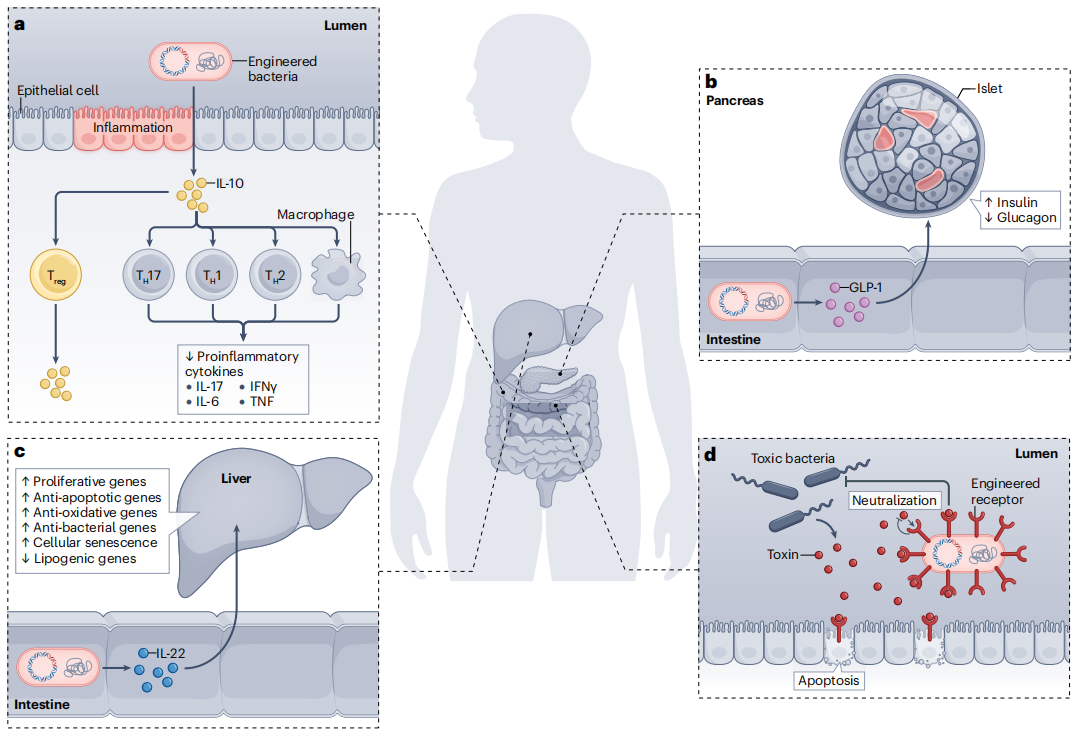
图3 工程微生物作为疾病治疗的转化应用
a,TH17和Treg细胞之间的不平衡与炎症性肠病(IBD)相关。口服分泌IL-10的工程细菌会刺激Treg细胞并抑制炎症性TH17、TH1和TH2细胞以及巨噬细胞。白细胞介素IL-10还可抑制促炎细胞因子(如IL-17、IL-6、IFNγ和TNF)的分泌。
b,口服工程细菌可以在肠道中分泌胰高血糖素样肽-1,通过刺激胰岛素分泌和抑制胰高血糖素分泌来治疗Ⅱ型糖尿病。
c,工程细菌可以在肠道中表达和分泌IL-22,通过肠肝轴促进肝脏再生。
d,旨在表达毒素受体模拟物、吸收和中和病原菌分泌的毒素的工程细菌。
INF,干扰素;GLP-1,胰高血糖素样肽-1;Treg,调节性T细胞;TH17,IL-17阳性T辅助细胞。TH1,1型辅助T细胞;TH2,2型辅助T细胞;TNF,肿瘤坏死因子。
癌症
自2000年代初以来,针对微生物组治疗癌症已成为一个重要的研究领域。与针对靠近血管的肿瘤周围区域的化学疗法和放射疗法不同,工程化的肠道微生物如沙门氏菌属、大肠杆菌、梭菌属和双歧杆菌属,可以到达核心肿瘤块的坏死和缺氧区域并诱导肿瘤细胞凋亡。例如,基因工程沙门氏菌菌株VNP20009和YB1导致肿瘤细胞凋亡和死亡。此外,口服给药后,工程细菌在肠道内原位产生融合到细菌外膜囊泡的肿瘤抗原。含有外膜囊泡的抗原可以作为肿瘤疫苗,减少肿瘤生长并保护小鼠免于再次暴露于肿瘤 。工程微生物也可以被封装以提高递送和治疗效率;例如,大肠杆菌Nissle 1917已经过基因改造,可以在细胞外膜上瞬时表达荚膜多糖,可由异丙基-β-d-硫代吡喃半乳糖苷(IPTG)诱导。这种策略允许工程细菌逃避免疫攻击,靶向肿瘤并从靶向肿瘤转移到远端肿瘤部位,而封装的丧失导致其在体内的有效清除。
将转基因微生物与传统的抗癌治疗相结合可以大大提高癌症治疗的有效性。例如,毒性减弱的鼠伤寒沙门氏菌血清型与放疗相结合可显着减缓小鼠结肠癌的发展。此外,具核梭杆菌(一种被认为会导致结直肠肿瘤发生的细菌)的噬菌体已被设计用于将共价键合的化疗药物输送至结直肠癌。同样,由于肿瘤MHC I类限制性抗原和肿瘤MHC I类限制性抗原之间的交叉反应,施用表达原噬菌体蛋白表位的工程化肠球菌菌株可改善荷瘤小鼠对免疫疗法(例如抗PD-1抗体)的反应。因此,差异工程微生物可以与化疗、放疗或免疫疗法一起部署,以改善癌症治疗,形成有效的抗癌策略。
为预防癌症,早期筛查癌前病变或早期异常至关重要。然而,尽管它们在某些情况下能够感知和消除癌细胞,但仍然缺乏基于肠道微生物的临床可行产品用于诊断和治疗应用。要克服的主要挑战之一是如何设计微生物来检测和富集选定的肿瘤区域。从治疗的角度来看,确保工程微生物产生的分子穿过肠道屏障并到达远处的癌细胞和组织是另一个问题,特别是考虑到一些抗癌分子(如紫杉醇或长春碱)具有复杂的化学结构和高分子权重。这些药物的生物合成需要复杂遗传电路的工程级联。鉴于癌症患者内部和癌症患者之间的高度遗传和表型异质性,部署一种放之四海而皆准的工程微生物是不现实的,即使是在单个患者身上也是如此。因此,任何肠道微生物组工程策略(与其他治疗相结合或相继进行)都必须确保患者分层并考虑到癌症不断发展的性质。
炎症性肠病(IBD)
IBD是一种慢性胃肠道自身免疫性疾病,其特征是长期间歇性肠道炎症。IBD的病因被认为是多因素的,包括环境因素、遗传倾向、肠上皮完整性的破坏、免疫系统的改变,以及重要的是肠道微生物组的菌群失调。尽管接受了各种治疗方案,如氨基水杨酸盐、生物制剂和手术,但相当一部分IBD患者最终还是接受手术切除肠道受影响区域,以缓解症状。IBD是一种消化系统疾病,整个胃肠道呈节段性或持续性炎症,胃肠道沿胃肠道轴排列着肠道微生物群,因此对微生物群进行工程改造以实现IBD的早期诊断和精准干预可能是一种可行的选择。
微生物已经开发出了复杂的系统来检测各种环境信号并做出反应。这些机制可用作人类肠道健康和疾病(包括IBD)的生物标志物,肠腔微生物可以接触到这些生物标志物。微生物传感器通常是单组分或双组分系统。变构转录因子是一种单组分系统,在配体相互作用时触发下游基因表达。相比之下,双组分系统通过磷酸化细胞质反应调节蛋白来检测细胞外信号,细胞质反应调节蛋白通过跨膜组氨酸激酶调节下游基因表达。比色、发光或荧光报告蛋白用于实现快速现场部署数字读数。基于DNA的存储介质元件改为使用DNA修饰酶来将刺激信息保存和存储到核酸序列的可遗传改变中,然后可以使用测序方法检测这些改变。这些合成处理电路是特定于应用的,旨在评估刺激的存在及其随时间的变化。例如,使用基于CRISPR的记录方法(record-seq)改造的大肠杆菌已被用于检测炎症中受刺激基因的瞬时mRNA表达(此处为细菌膜完整性所需的基因,pspG),然后将其逆转录当它们穿过葡聚糖硫酸钠(DSS)诱导的结肠炎小鼠的肠道时,由工程化的Cas1–Cas2复合物进入质粒编码的CRISPR阵列。然后,带条形码的CRISPR阵列分析了肠道中共存的同基因细菌的转录,之后对粪便样本进行微生物深度测序和数据分析。Record-seq的结果不仅区分了DSS暴露或戒断期间的治疗小鼠与对照小鼠,而且还准确报告了结肠炎的表型严重程度。
大肠杆菌还可以被改造为检测和响应氧化还原分子,如一氧化氮、代谢物(硫代硫酸盐)和活性氧副产物,如连四硫酸盐,已知是肠道炎症的标志。例如,包含由ttrR/S基因构建的触发元件、来自鼠伤寒沙门氏菌的PttrBCA启动子和基于λ噬菌体的记忆电路的多个合成构建体已被整合到大肠杆菌NGF-1122的染色体中。接触连四硫酸盐后,细菌启动了一种基于记忆的工程生物过程,该过程驱动合成记忆元件表达Cro和β-半乳糖苷酶,并且即使在没有连四硫酸盐的情况下也能维持其表达。值得注意的是,这种工程细菌在小鼠肠道中保持稳定,并且可以在遗传和感染诱导的炎症小鼠模型中检测连四硫酸盐超过六个月。
工程传感器微生物也可以与附加的电子设备结合使用。例如,通过将超低功率微电子学与传感器细菌(感应肠道信号和检测读出信号)融合,设计了一种可摄入的微生物电子设备。在这项研究中,硫代硫酸盐诱导电路被引入大肠杆菌Nissle 1917,由此暴露于硫代硫酸盐(结肠炎肠道炎症的生物标志物)会引发剂量依赖性生物发光反应。该电子设备的光电探测器捕获细菌在感知结肠炎模型肠道中的硫代硫酸盐时发出的光,然后将其无线发送到手机。
微生物也可以被改造来治疗IBD。与直接施用重组IL-10相比,使用工程微生物生成和递送抗炎细胞因子IL-10更有效且副作用更少(图 3a)。例如,通过将groESL操纵子启动子(细菌在热休克、低pH和暴露于胆汁盐等多种应激条件下合成的蛋白质)和编码IL-10的DNA片段整合到乳酸乳球菌的载体pLB350中,调节IL-10表达是可能的。给二硝基苯磺酸诱导的结肠炎小鼠宿主口服后,工程菌会在胃中遭受热和酸应激,在十二指肠(胃肠道的早期部分)中遭受胆汁应激,从而在胃肠道下游部分产生IL-10并产生抗炎症反应。
大量基因改造的一个警告是,它会降低工程系统的可行性和耐久性。细菌转染允许通过将携带转基因的无毒媒介细菌内化到哺乳动物细胞中来将遗传物质转移到哺乳动物细胞中,可以用作替代合成和递送方法。例如,COX-2(一种在IBD患者结肠粘膜中过度表达的酶)通过直肠施用非致病性侵入性大肠杆菌而被沉默,该大肠杆菌经过改造,可将抗COX-2小干扰RNA转移到上皮细胞中,从而削弱肠道功能。化学诱导结肠炎小鼠的炎症。类似地,乳酸乳球菌被改造为携带编码由真核启动子启动的抗炎肽微生物抗炎分子的质粒。整合到肠上皮细胞后,工程微生物在小鼠肠道中稳定、持续地产生微生物抗炎分子。
与组成型产生生物活性分子的微生物相反,可诱导微生物可以被改造以获得分子的受控合成和释放。例如,卵形拟杆菌(Bacteroides ovatus)使用木聚糖作为唯一的能源,经过改造可以合成人类角质形成细胞生长因子2和转化生长因子β。该过程由木聚糖酶操纵子启动子启动,并由膳食木聚糖诱导,以治疗DSS诱导的结肠炎小鼠的结肠炎。治疗IBD的一个关键挑战是该疾病的频繁缓解和复发性质,这几乎是所有自身免疫性疾病的常见特征。因此,以改造单一微生物或微生物群落来影响普遍存在的肠道微生物组为中心的诊断和治疗策略可能适合且可持续地治疗这些疾病。
代谢性疾病
肠道微生物组通过产生微量营养素、降解膳食产品和基础胆汁酸库,在代谢疾病的发生和发展中发挥重要作用。因此,改造肠道微生物组也是治疗代谢疾病的一种选择。通过对其代谢回路进行基因操作来改造肠道共生体已被广泛研究,以改善高氨血症、苯丙酮尿症和高尿酸血症动物模型的代谢表型。例如,一种口服的大肠杆菌Nissle 1917菌株经过改造,可将肠氨(在病理条件下肠道中过量产生)转化为L-精氨酸,从而降低了小鼠肠道产生的血氨,并减少了全身高氨血症。苯丙酮尿症是一种遗传性疾病,其特点是无法代谢苯丙氨酸,这可能导致神经毒性。大肠杆菌Nissle 1917也经过改造,可表达苯丙氨酸代谢酶,以响应肠道缺氧条件。血液苯丙氨酸通过肠再循环进入胃肠道,口服后被肠道内的工程大肠杆菌Nissle 1917消耗,从而降低小鼠血液苯丙氨酸浓度。
同样,由于人体不表达尿酸氧化酶,尿酸通过肾脏和肠道排出体外,排泄减少往往会引起血清中尿酸升高,从而导致人体出现高尿酸血症。为了克服这个问题,大肠杆菌Nissle 1917被设计为通过整合尿酸氧化酶和氧循环回路的合成基因,在缺氧条件下降解尿酸。被引入肠道后,工程大肠杆菌有效降低了高尿酸血症小鼠的血清尿酸水平。
除了工程化大肠杆菌Nissle 1917菌株外,还定制了少数工程化乳酸菌来合成宿主激素模拟物,以调节宿主体内的葡萄糖和脂质代谢。例如,胰高血糖素样肽-1(GLP-1)是一种肠降血糖素,由肠道L细胞响应膳食摄入脂质和碳水化合物而释放,可刺激胰岛素分泌并抑制胰高血糖素分泌。然而,天然形式的GLP-1具有极短的体内半衰期(2-5 分钟),这严重限制了其临床应用。L.lactis 133可以通过基因操作在口服后在肠道中持续释放胰高血糖素样肽-1(GLP-1),从而增加大鼠的血液胰岛素水平并减轻高血糖(图3b)。产生宿主细胞因子的益生菌也已被开发用于治疗酒精性肝病;例如,酒精相关的肠道菌群失调会降低吲哚3-乙酸的水平,吲哚3-乙酸是芳基烃受体的微生物衍生配体,可下调3型先天淋巴细胞产生的IL-22的表达。IL-22合成减少会降低再生胰岛源3 γ(REG3G)的表达,导致细菌转移至肝脏,引起脂肪性肝炎。工程化的产生IL-22的罗伊氏乳杆菌可增强肠道中REG3G的表达,并改善酒精性肝病小鼠模型的肝损伤和炎症(图 3c)。总体而言,增强微生物固有代谢回路和宿主启发的遗传回路进入肠道微生物的生物合成工程是治疗代谢疾病的两种主要策略。然而,对工程微生物的分子产生和增殖的精确调控目前很难实现。
传染性疾病
工程肠道微生物还可用于治疗胃肠道感染。例如,艰难梭菌感染(CDI)会导致胃肠道中微生物介导的胆汁盐代谢失调。工程大肠杆菌Nissle 1917重置CDI中胆汁盐的平衡,通过将共轭胆汁盐转化为肠道中的非共轭形式,显着减少小鼠的CDI。胃肠道感染的另一个例子是产志贺毒素大肠杆菌菌株(STEC),当被肠道吸收时,会导致腹泻和出血性结肠炎。改造大肠杆菌菌株CWG308以在其表面表达志贺毒素受体的模拟物,导致志贺毒素在肠道中被吸收和中和(图 3d)。口服工程大肠杆菌菌株CWG308可以完全保护小鼠免受致命剂量的STECs136的侵害。
由于多重耐药细菌给医疗保健系统带来了越来越大的负担,因此人们越来越有兴趣使用噬菌体作为胃肠道感染的抗菌疗法。例如,Φ噬菌体CD24–2(艰难梭菌的一种温和噬菌体)已被设计为通过利用艰难梭菌中存在的保守I-B型CRISPR–Cas系统来杀死艰难梭菌。口服给药后,CD24–2以毒素形式递送宿主靶向CRISPR RNA,在艰难梭菌宿主中造成无法修复的基因组损伤。提高细菌对抗生素的敏感性是克服细菌耐药性的另一种方法。例如,对噬菌体进行工程改造,将rpsL基因传递到链霉素抗性大肠杆菌中,导致细菌对抗生素重新敏感,并显着降低最小抑制剂量。rpsL编码的产物S12是一种必需且保守的蛋白质,可与链霉素结合以抑制细菌的生长。rpsL中的特定突变会阻碍细菌对链霉素的亲和力,而噬菌体介导的rpsL传递可逆转细菌对链霉素的耐药性。这种噬菌体介导的工程策略可以显着提高抗生素对抗病原菌的功效。尽管有大量关于工程微生物在临床前模型中的益处的报道,但仍然缺乏临床研究。
参考文献
Bai, X., Huang, Z., Duraj-Thatte, A.M. et al. Engineering the gut microbiome. Nat Rev Bioeng1, 665–679 (2023). https://doi.org/10.1038/s44222-023-00072-2
- 通讯作者简介 -
PROFILE
左涛
中山大学
研究员

国家高层次青年人才,中山大学“百人计划”中青年杰出人才,中山大学胃肠病学研究所副所长,中山大学人体微生态与慢病教育部重点实验室副主任,中山大学实验动物中心副主任,中山大学附属第六医院研究员。获得美国消化道疾病学会(AGA)颁发的“青年研究奖”(连续2次)、香港中文大学研究计划fellowship、欧洲克罗恩病与结肠炎委员会(ECCO)青年委员、国际微生物病毒协会(ISVM)会员、美国微生物学会(ASM)会员、中国人体健康科技促进会肠道微生态与菌群移植专业委员会常务委员、广东省精准医学应用学会微生态医学分会委员、广东省精准医学应用学会长青智库工作委员会委员。以通讯作者和第一作者发表IF>10的文章24篇,包括 Cell Host & Microbe (2) 、Lancet Gastroenterology & Hepatology (1)、Lancet Microbe (1)、Nature Reviews Gastroenterology & Hepatology (2)、Nature Reviews Microbiology (1)、Nature Reviews Bioengineering (1)、Gut (5)、Gastroenterology (4)、Microbiome (2)、Nature Communications (2)、eBioMedicine (1) 、Gut Microbes (1)、Journal of Medical Virology (1)。
PROFILE
李国新
南方医科大学
主任医师,二级教授

李国新,主任医师,二级教授,博士生导师,博士后合作导师,南方医科大学南方医院副院长,英格兰皇家外科学院院士(FRCS)、国际消化外科肿瘤学会(IASGO)中国区副主席、中国腹腔镜胃肠外科研究组(CLASS group)创始人、国家重点研发计划首席科学家、国家卫生健康突出贡献中青年专家、享受国务院政府特殊津贴专家、广东省医学领军人才、广东省特支计划杰出人才(南粤百杰)、广东省胃肠肿瘤精准诊疗重点实验室主任。
猜你喜欢
iMeta简介 高引文章 高颜值绘图imageGP 网络分析iNAP
iMeta网页工具 代谢组MetOrigin 美吉云乳酸化预测DeepKla
iMeta综述 肠菌菌群 植物菌群 口腔菌群 蛋白质结构预测
10000+:菌群分析 宝宝与猫狗 梅毒狂想曲 提DNA发Nature
系列教程:微生物组入门 Biostar 微生物组 宏基因组
专业技能:学术图表 高分文章 生信宝典 不可或缺的人
一文读懂:宏基因组 寄生虫益处 进化树 必备技能:提问 搜索 Endnote
扩增子分析:图表解读 分析流程 统计绘图
16S功能预测 PICRUSt FAPROTAX Bugbase Tax4Fun
生物科普: 肠道细菌 人体上的生命 生命大跃进 细胞暗战 人体奥秘
写在后面
为鼓励读者交流快速解决科研困难,我们建立了“宏基因组”讨论群,己有国内外6000+ 科研人员加入。请添加主编微信meta-genomics带你入群,务必备注“姓名-单位-研究方向-职称/年级”。高级职称请注明身份,另有海内外微生物PI群供大佬合作交流。技术问题寻求帮助,首先阅读《如何优雅的提问》学习解决问题思路,仍未解决群内讨论,问题不私聊,帮助同行。
点击阅读原文,跳转最新文章目录阅读