前言
与结构成像相比,生理成像是一个可以揭示组织和器官功能的领域,而不仅仅是提供形态信息。通过这种方式,它可以为评估人体提供补充信息。在一些疾病中,与结构变化相比,预期组织中的生理变化发生的时间要早得多。然而,由于以下几个原因,使用MRI测量生理过程和参数的评估可能具有挑战性:
1、生理过程可以在短时间内发生变化(甚至在测量过程中)。
2、已知有一些混淆因素(实际上有上百个)可以在短期和长期内影响和改变生理机能(见图1)。
3、大多数生理过程对MR信号的影响通常很小(通常为几个百分点)。如果使用外源性造影剂,影响可能会更大。
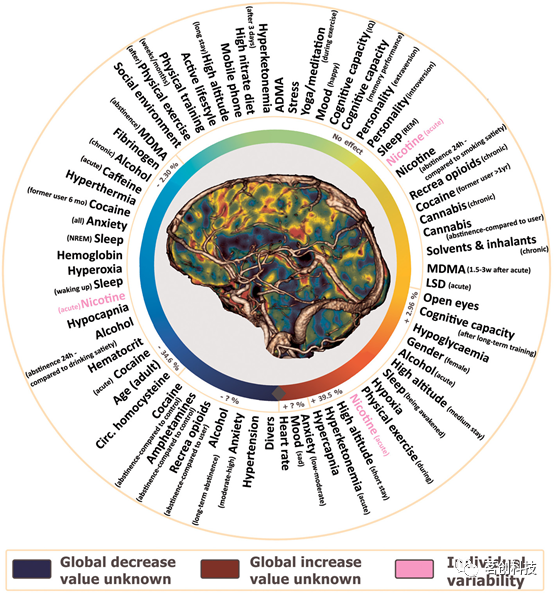
图1.各种因素对全脑灌注的影响(以颜色梯度显示)。
生理学涵盖了人体的许多过程,目前已经开发了多种MR技术来评估这些过程。在这里,本文将集中讨论非常重要(但不是唯一的)描述血液向组织运输的生理参数,即微血管灌注。
灌注是描述血液输送到毛细血管的一种衡量指标。在毛细血管交换部位,水、氧气、营养物质和其他物质进入周围组织,同时将组织中的废物清除到血液中。物理测量单位是每(组织)供应体积的(血液)体积流量,或单位时间内每(组织)体积的(血液)体积流量。在脑灌注中,通常使用脑血流量(CBF)这个术语,尽管从物理角度来看这是一个过于简化的表述。灌注也不应被误解为(血液)速度或(血液)体积。它描述的是单位时间内输送到一定组织体积的血液量。在国际单位制(SI)中,这种灌注的测量单位是[m3/s/kg],但由于人体内的灌注值往往相对较小,所以最常使用的单位是[ml/min/100g]。例如,年轻健康成人的典型灰质灌注约为60[ml/min/100g],因为脑体积中只有一小部分是血管(白质约为1-3%,灰质约为3-5%)。
由于灌注的本质,它不是一个恒定的参数,而是在相当短的时间尺度上的适应和变化,以响应外部或内部刺激和需求。图1列出了一些刺激,并提供了相关研究中灌注变化量的大致概念。从这张图可以看出,全脑灌注可因中毒或运动等原因改变30%以上。众所周知,成人的脑灌注会随着年龄的增长而减少。为了更好地解释全脑绝对灌注值,必须考虑或控制所有潜在的混淆因素。
动脉自旋标记(ASL)
动脉自旋标记(ASL)的基本思想是通过获取两个数据集来分离血液和组织信号,两个数据集的血液磁化强度不同,而组织磁化强度相同。这两个数据集通常称为标记图像和对照图像。通过将这两个数据集进行相减,组织信号(实际上是由静态组织产生的所有信号)将被抵消,只剩下从血液信号标记的位置移动到图像位置的信号。通过标记反转可以实现标记图像和对照图像之间的最大差异,这是最常见的方法,而其他约束条件可能更倾向于饱和标记的方法。无论采用何种准备方式,标记血液自旋的过程被称为“标记”。ASL的所有变体都依赖于血液在实验过程中流动的假设。利用标记和图像读出之间的延迟来评估血液流入血管的不同阶段(如图2所示)。这种延迟被称为流入时间(TI)或标记后延迟(PLD),具体取决于ASL制备的性质。需要注意的是,由于标记是通过纵向磁化反转进行的,因此标记会随着局部T1的衰减而衰减,这实际上导致随时间ASL信号的衰减(ASL“示踪剂”的半衰期通常略高于一秒,因此在组织中检测到ASL信号的能力会在几秒内“消失”)。
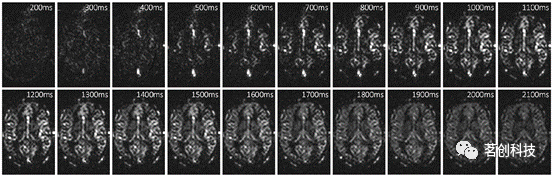
图2.标记血液流入34岁健康受试者的单个脑层。
标记变体
所有已发表的ASL变体可以分为三类:
①脉冲ASL:在相对于成像区域的完全外部和上游的较大区域(~100mm)内的给定时间点,通过短反转脉冲(持续时间~10-15ms)对动脉血水分子进行标记。
②连续ASL(包括伪连续ASL):使用较长的连续射频脉冲(通常为一到几秒钟),并利用流驱动绝热反转技术对垂直流入的动脉血液中的水分子进行标记。
③速度或加速度选择性ASL:加速度选择性是一种较新的ASL技术,成像原理类似于速度选择性ASL,基于血流速度选择性自旋反转,速度选择性标记脉冲使血液饱和或反转的速度快于预定速度,并且仅从速度小于截止值的自旋中获取数据。
脉冲ASL(PASL)
在脉冲ASL(PASL)中,血液在成像部位上游区域进行标记。在标记阶段,通过施加一个持续时间为10-15ms的单个脉冲来反转该区域的磁化。在流入时间内,这将最终导致未受干扰的血液水磁化(对照)或反转磁化(标记)流入成像层。在1990年代和2000年代初期的很长一段时间里,人们开发了许多脉冲ASL变体,并提出了对称和非对称标记方法。其中,FAIR(流动敏感交替反转恢复;对称方法)和STAR(交替射频信号靶标;非对称方法)是每种方法的代表,经常用于脉冲ASL测量(见图3)。
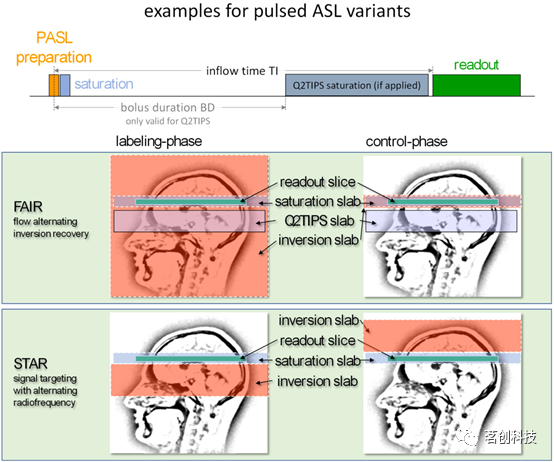
图3.脉冲ASL变体的示例。
连续ASL(CASL)和伪连续ASL(pCASL)
所有脉冲ASL方案的一个缺点是标记区域的空间范围较大。这导致了一系列的动脉运输时间,标记的血团前部到达成像区域所需的时间比后部要短。由于整个团注是在PASL中同时创建的,因此标记的后部会比前部有更多的T1弛豫衰减。
与PASL相比,连续ASL(CASL)方法在较长的时间内将血液在一个明确定义的位置上进行标记,使得标记团注的每个部分到达成像层(假设流速恒定)的时间相同。血液在流入成像层的时间(即,从标记结束到成像开始的时间)被称为标记后延迟(PLD)。它类似于脉冲ASL中使用的流入时间TI,即标记时间(团注持续时间)和PLD的总和等于TI。
在CASL中,RF脉冲的频率不会像绝热RF脉冲那样改变,而是通过使用沿流动方向的磁场梯度来实现频率扫描。在这种梯度下,沿着梯度流动的血水磁化将经历一个逐渐增加(或减小)的净磁场。因此,血水磁化的共振频率会在流动时增加(或减小)。在频率恒定的连续B1发射场下,血水磁化将经历从高(低)到低(高)偏共振频率的频率扫描,而谐振频率恰好在标记区域的中间。与绝热RF脉冲的情况一样,磁化将会发生反转。这就是所谓的流动驱动绝热反转,在所有CASL实验中都会使用这种方法。在过去,施加连续的B1场1-2s,可以通过使用常规的发射线圈或者使用专用于标记的第二个局部线圈来实现。使用第二个线圈的好处是仅局部影响磁化,而不延伸到成像区域,因此可以忽略磁化转移效应。然而,这需要额外的技术设备,这阻碍了该技术在临床环境(以及大多数研究中心)中的应用。但是这种情况在未来可能会发生改变,因为越来越多的现代MRI扫描仪配备了多种发射功能。
为了在没有专用标记线圈的情况下控制磁化效应,目前已经开发了几种技术,其中调幅方法是最常用的。在这种方法中,连续B1场的振幅在对照图像中周期性地改变,这实质上产生了两个相邻的反转切片(见图4)。采用该方案,血水磁化两次反转,使对照组得到(几乎)无扰动磁化。然而,这些CASL方法难以在临床扫描仪上使用,因为它们对连续RF功率有很高的要求。因此,有研究人员开发了一种新方法,该方法不使用长连续RF场,而是以非常快速的方式施加许多短RF脉冲,以确保满足流动驱动绝热反转的条件。典型设置使用0.5ms的RF脉冲,在连续RF脉冲之间有0.4-0.5ms的暂停。使用更强的梯度将RF脉冲的影响限制在一个小范围内。在施加RF脉冲期间的梯度切换必须部分重新聚焦,以产生与经典CASL实验相似的净梯度。这种技术被称为伪连续ASL(pCASL)。事实证明,与之前使用的CASL变体相比,pCASL变体提供了更好的标记效率和更少的磁化转移效应,并已成为ASL测量的准标准。
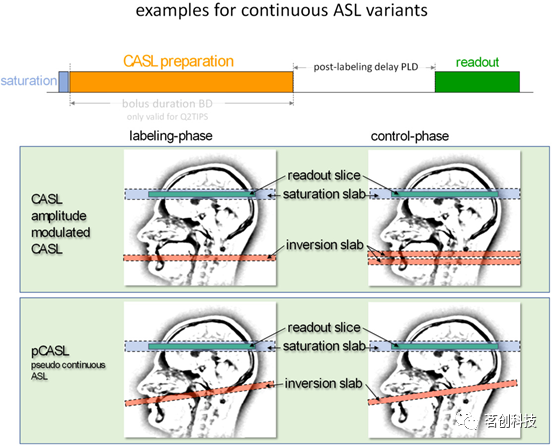
图4.连续ASL变体的示例。
然而,与用于PASL的绝热RF脉冲相比,CASL中使用的流动驱动绝热反转过程,特别是pCASL中使用的绝热反转过程对偏共振更加敏感。因此,必须特别注意确保标记层上的反转过程按预期进行。
速度或加速度选择性ASL
脉冲和连续ASL技术的共同点是血水磁化的反转发生在成像区域之外。两组ASL变体的基本思想是修改成像平面之外的磁化强度,并利用只有血液会从准备区域流向成像区域这一特点。这样做的优点是,即反转过程不必考虑标记位置的静态组织区域,因为它也会受到绝热反转过程的影响,并在ASL准备过程中被标记。对于流动驱动绝热反转来说也是如此,其中标记区域的静态组织磁化也会受到干扰,尽管没有被正确反转。标记位置和成像位置的分离允许使用稳健且(大多数情况下)可靠的反转脉冲。然而,这也有一定的代价。标记血液必须从标记位置流向成像位置,这需要一定的时间,取决于血流速度(即所谓的动脉运输时间,ATT)。对于血液动力学受损的患者来说,这可能会带来一个问题,因为标记可能尚未达到脑组织,并且在读取时仍停留在较大的动脉中,从而产生血管伪影。
背景抑制
ASL依赖于标记图像和对照图像之间发生的信号变化(最多几个百分点)。这使得该技术对两个数据集之间不是由灌注而引起的小差异非常敏感。这可能是由于大量运动、呼吸或射频不一致性引起的信号波动。如果假设每个标记和对照数据集的信噪比为100,则组织信号的正常波动(噪声)与血液信号相同!对于典型的2D图像读出策略,通常可以对大量的测量值进行平均,但对于3D采集方法,噪声污染和信号不稳定性更高。因此,研究人员制定了一些策略,以减少读出时(不需要的)静态组织信号,同时保留(几乎)完整的血液信号。这些背景抑制(BS)方案通常包括在序列开始时放置良好的反转脉冲以及额外的饱和脉冲。其背后的思想是在读取时(几乎)使组织磁化为零。通过适当放置反转脉冲,可以实现对具有一定T1弛豫时间的信号成分的完全抵消。对于不同的T1信号,两个反转脉冲后磁化的典型行为如图5所示。
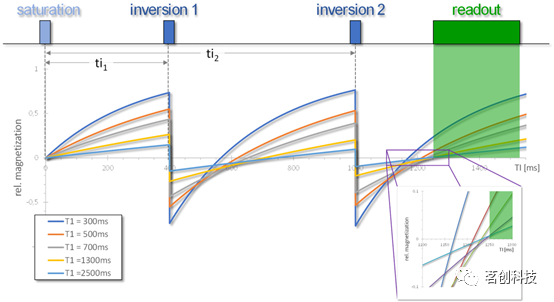
图5.两个反转脉冲的背景抑制方案。
图像采集
在几乎所有情况下,ASL准备部分可以完全独立于图像采集部分。一般来说,可以使用任何读出技术;然而,有些技术比其他技术更合适和高效。通常,准备是ASL测量中最耗时的部分。被标记的血液到达毛细血管交换处的时间不会早于1.5s,甚至会晚于标记开始后。例外情况是速度选择性和相关的ASL变体,其到达时间要短得多。然而,相同的输送时间决定了测量持续时间,虽然在图像读出之后还需要延迟一段时间,以便在成像区域内重新恢复血液磁化。总体而言,几秒钟的最小重复时间对于所有ASL变体通常是相同的。由于时间的限制,仅在一个重复周期内获取成像数据的图像采集技术效率不高(例如,具有少量重聚焦脉冲(快速因子)的快速自旋回波(TSE))。因此,通常采用单次或少次读出技术。
回波平面成像(EPI)由于其快速成像能力,可以在一次ASL制备后获得多个层,因而很早就被使用。但是由于随后的采集,每个层的流入时间会略有不同。这可以在建模和处理步骤中进行校正,并且通常通过利用现代加速方法(例如并行成像和同时多层成像)来最小化。因此,EPI仍然是常用的ASL成像技术,尤其是在脑灌注测量方面。尽管该成像方法具有很多优点,但3D成像变体正逐渐取代2D EPI。
3D成像方法具有提供全脑覆盖和在相同的流入时间(TI)下获取整个成像体积的优势。这样可以更轻松地实现背景抑制,特别是对于在层方向上具有均匀的背景抑制而言。此外,已经证明与EPI相比,3D成像可以显著提高信噪比(SNR),从而相应地减少采集时间。通常,在ASL中使用多个自旋回波和EPI的组合来进行快速的3D成像。回波平面成像序列可以沿不同的轨迹进行,例如笛卡尔轨迹或螺旋轨迹。分割通常用于改善图像质量和减少模糊,但也增加了对运动的敏感性。
此外,还有HASTE(半傅立叶快速自旋回波成像)、平衡稳态自由旋进(bSSFP)和其他读出选项,但大多数适用于非神经区域的测量。有关图像采集以及2D与3D成像策略之间的比较,感兴趣的小伙伴可以参考Alsop等人(2015)和Vidorreta等人(2013)的研究以获取更多细节。
高效获取多个流入时间
标记血液流入成像区域的动态可能因受试者而异,并且对于某些疾病可能具有截然不同的特征。因此,在PASL和CASL中,最好不要使用固定流入时间(或CASL变体中的标记后延迟)的测量,而是在不同流入时间内捕获标记血液的全部流入。然而,这可能非常耗时。因此,人们寻求加速技术,以减少多个流入时间点采集的扫描时间。
ASL序列中最耗时的部分是等待时间,以使标记血液到达成像区域并最终到达毛细血管交换处。为了加快此过程,可以在ASL准备后获取多个数据集。这就是所谓的Look-Locker读出的思想,即在一次准备后获取不同流入时间的多个数据集。为了实现这一点,在较早流入时间点的图像读出必须保留一些标记的血水磁化,以便后续读出使用。这是通过减小激励翻转角来完成的。它最初是为PASL变体开发的,目前也已成功用于pCASL,尽管在早期流入时间点无法获取图像。这种技术适用于梯度回波序列,但不太适用于自旋回波序列,因为重新聚焦脉冲经常干扰标记磁化,参见图6。

图6.Look-Locker ASL读出技术。
对于自旋回波读取,还开发了另一种有效采样标记血液流入的方法,事实证明,该方法对所有读出方法(无论是自旋回波还是梯度回波)都是有效的。
关于ASL的后处理
不同的ASL变体可能会使后处理变得繁琐,尤其是在处理来自不同扫描仪、站点和供应商的数据时。为了简化这一过程,ASL社区定义了一种交换文件格式,该格式可以处理所有不同的变体。这种格式是脑成像数据结构(BIDS,https://bids.neuroimaging.io/)的扩展,被称为ASL-BIDS。虽然这个格式很新,但建议在今后的工作中使用这种格式。
ExploreASL是后处理ASL数据的一种常用方法。这个强大工具(http://www.ExploreASL.org)的功能包括WM/GM分割、空间归一化、运动校正、定量化、部分容积校正和数据统计分析。目前,它仅支持单个TI和单个PLD数据,但计划扩展以支持多个TI/PLD数据。对于多个TI/PLD数据的后处理,可以使用FSL中的BASIL工具箱(https://fsl.fmrib.ox.ac.uk/fsl/fslwiki/BASIL)。
参考文献(上下滑动查看):
Alsop, D.C., Detre, J.A., Golay, X., Gunther, M., Hendrikse, J., Hernandez-Garcia, L., Lu, H., Macintosh, B.J., Parkes, L.M., Smits, M., Van Osch, M.J., Wang, D.J., Wong, E.C., Zaharchuk, G., 2015. Recommended implementation of arterial spin-labeled perfusion MRI for clinical applications: a consensus of the ISMRM perfusion study group and the European consortium for ASL in dementia. Magn. Reson. Med. 73, 102–116.
Buxton, R.B., Frank, L.R., Wong, E.C., Siewert, B., Warach, S., Edelman, R.R., 1998. A general kinetic model for quantitative perfusion imaging with arterial spin labeling. Magn. Reson. Med. 40, 383–396.
Clement, P., Mutsaerts, H.J., Vaclavu, L., Ghariq, E., Pizzini, F.B., Smits, M., Acou, M., Jovicich, J., Vanninen, R., Kononen, M., Wiest, R., Rostrup, E., Bastos-Leite, A.J., Larsson, E.M., Achten, E., 2018. Variability of physiological brain perfusion in healthy subjects - a systematic review of modifiers. Considerations for multicenter ASL studies. J. Cereb. Blood Flow Metab. 38, 1418–1437.
Dai, W., Garcia, D., De Bazelaire, C., Alsop, D.C., 2008. Continuous flow-driven inversion for arterial spin labeling using pulsed radio frequency and gradient fields. Magn. Reson. Med. 60, 1488–1497.
Edelman, R.R., Chen, Q., 1998. EPISTAR MRI: multislice mapping of cerebral blood flow. Magn. Reson. Med. 40, 800–805.
Edelman, R.R., Siewert, B., Darby, D.G., Thangaraj, V., Nobre, A.C., Mesulam, M.M., Warach, S., 1994. Qualitative mapping of cerebral blood flow and functional localization with echo-planar MR imaging and signal targeting with alternating radio frequency. Radiology 192, 513–520.
Ferre, J.C., Bannier, E., Raoult, H., Mineur, G., Carsin-Nicol, B., Gauvrit, J.Y., 2013. Arterial spin labeling (ASL) perfusion: techniques and clinical use. Diagn. Interv. Imaging 94, 1211–1223.
Golay, X., Guenther, M., 2012. Arterial spin labelling: final steps to make it a clinical reality. MAGMA 25, 79–82.
Gunther, M., Bock, M., Schad, L.R., 2001. Arterial spin labeling in combination with a look-locker sampling strategy: inflow turbo-sampling EPI-FAIR (ITS-FAIR). Magn. Reson. Med. 46, 974–984.
Gunther, M., Oshio, K., Feinberg, D.A., 2005. Single-shot 3D imaging techniques improve arterial spin labeling perfusion measurements. Magn. Reson. Med. 54, 491–498.
Kim, S.G., Tsekos, N.V., 1997. Perfusion imaging by a flow-sensitive alternating inversion recovery (FAIR) technique: application to functional brain imaging. Magn. Reson. Med. 37, 425–435.
Le Bihan, D., 2019. What can we see with IVIM MRI? NeuroImage 187, 56–67.
Luh, W.M., Wong, E.C., Bandettini, P.A., Hyde, J.S., 1999. QUIPSS II with thin-slice TI1 periodic saturation: a method for improving accuracy of quantitative perfusion imaging using pulsed arterial spin labeling. Magn. Reson. Med. 41, 1246–1254.
Mutsaerts, H., Petr, J., Groot, P., Vandemaele, P., Ingala, S., Robertson, A.D., Vaclavu, L., Groote, I., Kuijf, H., Zelaya, F., O’Daly, O., Hilal, S., Wink, A.M., Kant, I., Caan, M.W.A., Morgan, C., De Bresser, J., Lysvik, E., Schrantee, A., Bjornebekk, A., Clement, P., Shirzadi, Z., Kuijer, J.P.A., Wottschel, V., Anazodo, U.C., Pajkrt, D., Richard, E., Bokkers, R.P.H., Reneman, L., Masellis, M., Gunther, M., Macintosh, B.J., Achten, E., Chappell, M.A., Van Osch, M.J.P., Golay, X., Thomas, D.L., De Vita, E., Bjornerud, A., Nederveen, A., Hendrikse, J., Asllani, I., Barkhof, F., 2020. ExploreASL: an image processing pipeline for multi-center ASL perfusion MRI studies. NeuroImage 219, 117031.
Talagala, S.L., Ye, F.Q., Ledden, P.J., Chesnick, S., 2004. Whole-brain 3D perfusion MRI at 3.0 T using CASL with a separate labeling coil. Magn. Reson. Med. 52, 131–140.
Tannus, A., Garwood, M., 1997. Adiabatic pulses. NMR Biomed. 10, 423–434.
Vidorreta, M., Wang, Z., Rodriguez, I., Pastor, M.A., Detre, J.A., Fernandez-Seara, M.A., 2013. Comparison of 2D and 3D single-shot ASL perfusion fMRI sequences. NeuroImage 66, 662–671.
Wong, E.C., Buxton, R.B., Frank, L.R., 1998. Quantitative imaging of perfusion using a single subtraction (QUIPSS and QUIPSS II). Magn. Reson. Med. 39, 702–708.
Wong, E.C., Cronin, M., Wu, W.C., Inglis, B., Frank, L.R., Liu, T.T., 2006. Velocity-selective arterial spin labeling. Magn. Reson. Med. 55, 1334–1341.
Wong, W.H.E., Maller, J.J., 2016. Arterial spin labeling techniques 2009–2014. J. Med. Imaging Radiat. Sci. 47, 98–107.
Ye, F.Q., Frank, J.A., Weinberger, D.R., Mclaughlin, A.C., 2000. Noise reduction in 3D perfusion imaging by attenuating the static signal in arterial spin tagging (ASSIST). Magn. Reson. Med. 44, 92–100.










![Shell常用的几个正则表达式:[:alnum:], [:alpha:], [:upper:], [:lower:], [:digit:] 认知](https://img-blog.csdnimg.cn/b5e7837c39254e0da4b4037432ea734e.png)