【化学】必修一:金属及其化合物
钠及其化合物
钠单质
物理性质
- 颜色:银白色,有金属光泽;
- 密度:\(\mathrm{\rho_{H_2O}>\rho_{Na}>\rho_{煤油}}\)(钠可以在煤油中进行保存);
- 熔点:低于 \(100\mathrm{℃}\);
- 硬度:柔软,可用小刀切割;
- 自然界中存在形态:只有化合态。
化学性质
-
与氧气的反应:
\[\mathrm{4Na+O_2=2Na_2O(失去金属光泽)}\\ \mathrm{2Na+O_2\xlongequal{\triangle}Na_2O_2(淡黄色)} \]钠的连续氧化:从钠反应得到氧化钠再反应得到过氧化钠,第一个反应钠化合价由 \(0\to +1\),第二个反应氧化合价由 \(-2\to -1\)。
钠在空气中久置:
\[\mathrm{Na\xrightarrow{O_2}Na_2O\xrightarrow{H_2O}NaOH\xrightarrow{CO_2}Na_2CO_3\cdot 10H_2O\rightarrow Na_2CO_3} \] -
与水反应:
\[\mathrm{2Na+2H_2O=2NaOH+H_2↑}\\ \mathrm{2Na+2H_2O=2Na^++2OH^-+H_2↑} \]将钠单质加入到含有酚酞的水溶液中现象:浮熔游响红
浮:密度小于水;
熔:熔点低;放热;
游响红:生成氢气。
-
与盐溶液反应:
先与水反应,生成的 \(\mathrm{NaOH}\) 再与盐溶液反应。
注意:钠加入到饱和氢氧化钠水溶液中,氢氧化钠析出。
钠的氧化物
| 名称 | 氧化钠 \(\mathbf{Na_2O}\) | 过氧化钠 \(\mathbf{Na_2O_2}\) |
|---|---|---|
| 阴阳离子个数比 | \(\mathrm{Na^{+}:O^{2-}=2:1}\) | \(\mathrm{Na^+:{O_2}^{2-}=2:1}\) |
| 化合物类型 | 离子化合物(碱性氧化物) | 离子化合物(非碱性氧化物、过氧化物) |
| 性质 | 碱性氧化物通性 | 强氧化性 |
| 颜色、状态 | 白色、固体 | 淡黄色、固体 |
| 稳定性 | 不稳定、加热生成 \(\mathrm{Na_2O_2}\) | 较稳定 |
| 与水 | \(\mathrm{Na_2O+H_2O=2NaOH}\) | \(\mathrm{2Na_2O_2+2H_2O=4NaOH+O_2↑(转移电子数:2e^{-})}\) |
| 与 \(\mathbf{CO_2}\) | \(\mathrm{Na_2O+CO_2=Na_2CO_3}\) | \(\mathrm{2Na_2O_2+2CO_2=2Na_2CO_3+O_2↑}\) |
| 与盐酸 | \(\mathrm{Na_2O+2HCl=NaCl+H_2O}\) | \(\mathrm{2Na_2O_2+4HCl=4NaCl+2H_2O+O_2↑}\) |
| 与 \(\mathbf{SO_2}\) | \(\mathrm{Na_2O+SO_2=Na_2SO_3}\) | \(\mathrm{Na_2O_2+CO_2=Na_2SO_4}\) |
| 与品红/石蕊 | 遇品红不变色,与石蕊变蓝 | 品红因氧化褪色;遇到石蕊先变蓝,后褪色(生成 \(\mathrm{H_2O_2}\)) |
一般性规律:
- \(\mathrm{Na_2O_2}\) 与 \(\mathrm{H_2O}\) 和 \(\mathrm{CO_2}\) 的反应中均既做氧化剂又做还原剂,均生成氧气;
- \(\mathrm{Na_2O_2}\) 与 \(\mathrm{SO_2}\) 反应时并不是按照跟 \(\mathrm{H_2O}\) 和 \(\mathrm{CO_2}\) 的反应规律反应的,因为 \(\mathrm{SO_2}\) 还可以被氧化(硫元素化合价可以上升),但 \(\mathrm{H_2O}\) 和 \(\mathrm{CO_2}\) 中氢元素和碳元素已经到达最高价态,不能被氧化。
- 不能电解 \(\mathrm{NaCl}\) 溶液制备金属和氧气。因为在水溶液中制备出来的钠单质会直接与水发生反应又生成 \(\mathrm{NaOH}\)。所以制备钠和氯气应该使用电解熔融的 \(\mathrm{NaCl}\)。
- \(1\mathrm{mol}\) 钠发生氧化还原反应,无论发生了什么反应,转移的电子数永远是 \(1\mathrm{N_A}\)。
碳酸钠与碳酸氢钠
| 物质 | 碳酸钠 \(\mathbf{Na_2CO_3}\) | 碳酸氢钠 \(\mathbf{NaHCO_3}\) |
|---|---|---|
| 俗名 | 纯碱、苏打 | 小苏打 |
| 色态 | 白色粉末 | 细小白色粉末 |
| 溶解性 | 易溶于水 | 在水中比碳酸钠小 |
| 热稳定性 | 稳定,受热难分解 | 受热易分解:\(\mathrm{2NaHCO_3\xlongequal{\triangle}Na_2CO_3+H_2O+CO_2↑}\) |
| 与酸反应 | \(\mathrm{{CO_3}^{2-}+2H^+=H_2O+CO_2↑}\) | \(\mathrm{{HCO_3}^-+H^+=H_2O+CO_2↑}\) |
| 与 \(\mathbf{CO_2}\) 反应 | \(\mathrm{Na_2CO_3+CO_2+H_2O=2NaHCO_3}\) | 不反应 |
| 与 \(\mathbf{NaOH}\) 反应 | 不反应 | \(\mathrm{NaHCO_3+NaOH=Na_2CO_3+H_2O}\) |
| 与 \(\mathbf{Ca(OH)_2}\) 反应 | \(\mathrm{Ca^{2+}+{CO_3}^{2-}=CaCO_3↓}\) | 少量:\(\mathrm{Ca^{2+}+2OH^-+2{HCO_3}^-=CaCO_3↓+{CO_3}^{2-}+2H_2O}\) 过量:\(\mathrm{{HCO_3}^-+OH^-+Ca^{2+}=CaCO_3↓+H_2O}\) |
| 与可溶性钙盐、钡盐反应 | 生成 \(\mathrm{CaCO_3}\)、\(\mathrm{BaCO_3}\) 沉淀 | 无沉淀生成 |
说明:
-
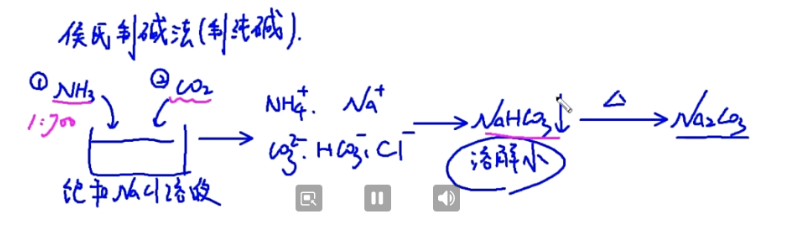
侯氏制碱法(制备纯碱):先将氨气和二氧化碳分别通入到饱和 \(\mathrm{NaOH}\) 溶液(先通氨气:溶解后使得溶液变为碱性增大二氧化碳的吸收效果),碳酸氢钠析出(因为溶解度最小),将碳酸氢钠加热后,得到碳酸钠。
图解:
-
验证碳酸钠与碳酸氢钠热稳定性的套管实验:
实验装置:
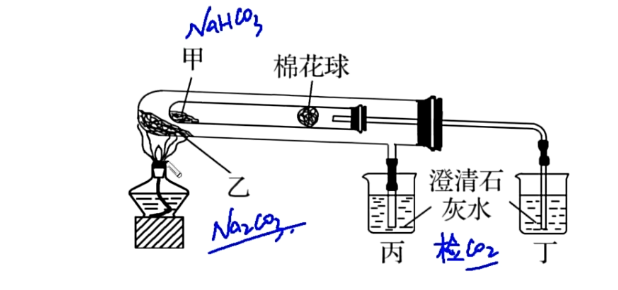
外部试管温度高,故必须放碳酸钠,以此说明碳酸氢钠热稳定性更强。固体不可以颠倒。
-
碳酸氢钠受热分解的应用:①烘焙;②干粉灭火器;
-
不能用 \(\mathrm{Ca(OH)_2}\) 检验二者,因为两者现象相同,均生成白色沉淀;
-
可以用可溶性钙盐、钡盐检验二者,碳酸钠生成白色沉淀,碳酸氢钠无沉淀;
-
二者相互转换:
\[\mathrm{Na_2CO_3\xleftrightarrow[加热或加氢氧化钠溶液]{通二氧化碳或滴加少量酸}NaHCO_3} \] -
鉴别:
- 固体:
- 溶解度:\(\mathrm{Na_2CO_3>NaHCO_3}\);
- 加酸:立即冒泡,快:\(\mathrm{NaHCO_3}\)(可作制酸剂,碳酸钠不能作,因为其腐蚀性强);
- 加热:分解:\(\mathrm{NaHCO_3}\)(是固体,不是水溶液);
- 水溶液:
- \(\mathrm{pH}\):\(\mathrm{Na_2CO_3>NaHCO_3}\);
- 加酸:逐滴加酸,立即冒泡:\(\mathrm{NaHCO_3}\);
- 沉淀:假如氯化钙、氯化钡等可溶性钡盐,产生白色沉淀:\(\mathrm{Na_2CO_3}\)
- 固体:
-
除杂:
- \(\mathrm{Na_2CO_3}\) 固体(\(\mathrm{NaHCO_3}\)):加热;
- \(\mathrm{NaHCO_3}\) 溶液(\(\mathrm{Na_2CO_3}\)):通入二氧化碳;
- \(\mathrm{Na_2CO_3}\)溶液(\(\mathrm{NaHCO_3}\)):假如适量氢氧化钠溶液。
焰色反应
-
概念:很多金属或它们的化合物在灼烧时都会使火焰呈现出特征颜色,根据火焰呈现的特征颜色,可以判断试样中所含的金属元素,化学上把这样的定性分析操作称为焰色反应。
-
实验操作:

注意事项:
- 使用盐酸洗净而不是硫酸的原因:盐酸具有挥发性,硫酸不易挥发;
- 用铂丝或铁丝灼烧,不能用铜丝或玻璃棒代替铂丝的原因:二者焰色反应与火焰颜色差别不大不会干扰试验,玻璃棒本身有钠元素会干扰试验。
- 灼烧钠化合物和单质,火焰呈黄色;
- 透过蓝色钴玻璃,钾化合物及其单质呈紫色。
- 焰色反应属于物理变化不属于化学变化。
常见金属焰色:

铝及其化合物
铝单质
-
铝元素是地壳中含量最多的金属元素;
-
活泼,常温下就能与氧气反应,生成一层致密的氧化铝薄膜;
-
与酸的反应
-
稀 \(\mathrm{H_2SO4}\)、\(\mathrm{HCl}\):\(\mathrm{2Al+6H^+=2Al^{3+}+3H_2↑}\);
-
稀硝酸(具有氧化性):跟硝酸根反应,不是跟氢离子反应:\(\mathrm{Al+4HNO_3(稀)=Al(NO_3)_3+NO↑+2H_2O}\)
铝加入溶液中如果只生成氢气,那么溶液中不能大量存在 \(\mathrm{{NO_3}^-}\)。
-
浓硝酸、浓硫酸:常温 \(\to\) 钝化。
钝化的三个条件:①铁或铝;②常温(冷);③浓硫酸或浓硝酸。
-
-
与碱的反应:\(\mathrm{2Al+2NaOH+2H_2O=2NaAlO_2+3H_2↑}\)(化学计量数:四 2 一 3)
-
铝的制备:
铝在地壳中主要以铝土矿等矿物形式存在,提纯 \(\mathrm{Al_2O_3}\) 后,用电解法制备铝。
\(\mathrm{2Al_2O_3(熔融)\xlongequal[冰晶石]{电解}4Al+3O_2↑}\)
-
铝热反应:是指工业上用铝粉来还原一些金属氧化物得到难溶金属的反应,用于冶炼稀有金属、野外焊接铁轨、定向爆破等。
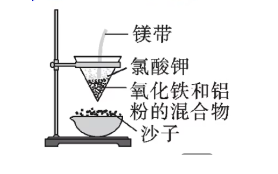
注意:工业上不用铝热反应制备铁。
氧化铝
- 物理性质:白色固体,熔点高,硬度大,难溶于水。
- 用途:①制耐火材料;②冶炼铝
- 两性氧化物:既能与强酸反应生成盐和水又能与强碱反应生成盐和水。
- 与强酸反应:\(\mathrm{Al_2O_3+6H^+=2Al^{3+}+3H_2O}\)
- 与强碱反应:\(\mathrm{Al_2O_3+2OH^-=2{AlO_2}^-+H_2O}\)
氢氧化铝
-
物理性质:白色固体,难溶,胶体,吸附能力强能凝聚水中的悬浮物。
-
两性氢氧化物:
- 与强酸反应:\(\mathrm{Al(OH)_3+3H^+=Al^{3+}+3H_2O}\)
- 与强碱反应:\(\mathrm{Al(OH)_3+OH^-={AlO_2}^-+2H_2O}\)
-
热稳定性:\(\mathrm{2Al(OH)_3\xlongequal{\triangle}2Al+3H_2O}\)
-
制备:
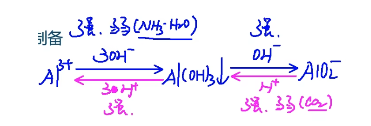
\(\mathrm{Al^{3+}}\) 变 \(\mathrm{Al(OH)_3}\) 强碱、弱碱均可,一般制备时用弱碱更好,因为强碱无法控制量,有可能生成偏铝酸根。\(\mathrm{Al(OH)_3}\) 变 \(\mathrm{{AlO_2}^-}\) 只能用强碱。弱碱无法让沉淀溶解。
同理,\(\mathrm{{AlO_2}^-}\) 变 \(\mathrm{Al(OH)_3}\) 强酸、弱酸均可,一般制备时用弱酸更好,因为强酸无法控制量,有可能生成铝离子。\(\mathrm{Al(OH)_3}\) 变 \(\mathrm{Al^{3+}}\) 只能用强酸。弱酸无法让沉淀溶解。
- 可溶性铝盐溶液与氨水反应:\(\mathrm{Al^{3+}+3NH_3·H_2O=Al(OH)_3↓+3{NH_4}^+}\);
- 由偏铝酸盐制取:过量二氧化碳通入偏铝酸钠溶液,即:\(\mathrm{{AlO_2}^-+CO_2+2H_2O=Al(OH)_3↓+{HCO_3}^-}\)
铝三角
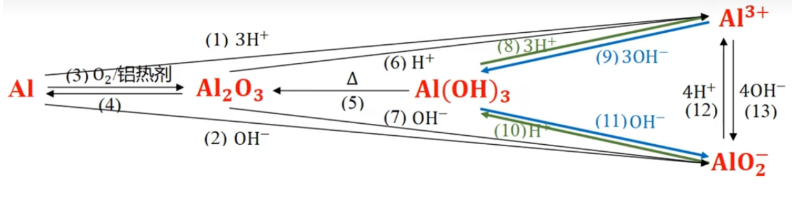
一般性规律:
- \(\mathrm{Al、Al_2O_3、Al(OH)_3、{AlO_2}^-}\) 加酸(氢离子)最终的归宿都是 \(\mathrm{Al^{3+}}\);
- \(\mathrm{Al、Al_2O_3、Al(OH)_3、Al^{3+}}\) 加碱(氢氧根离子)最终的归宿都是 \(\mathrm{{AlO_2}^-}\)。
- \(\mathrm{Al_2O_3}\) 无法一步变成 \(\mathrm{Al(OH)_3}\)。只可能是先加酸变 \(\mathrm{Al^{3+}}\) 再加碱,或先加碱变 \(\mathrm{AlO_2}^-\) 再加酸。
方程式:
重要考点总汇
-
两性:只要遇到过量强酸最终反应物就是 \(\mathrm{Al^{3+}}\),只要遇到过量强碱最终反应物就是 \(\mathrm{AlO_2}^-\);
-
用途:
- \(\mathrm{Al}\):铝合金;航空航天材料(通常添加适量锂,低密度、高强度);
- \(\mathrm{Al_2O_3}\):耐热材料;炼铝材料;刚玉(与 \(\mathrm{C}\) 和 \(\mathrm{SiO_2}\) 区别:钻石是 \(\mathrm{C}\),宝石是 \(\mathrm{Al_2O_3}\),玛瑙是 \(\mathrm{SiO_2}\))
- \(\mathrm{Al(OH)_3}\):净水剂;制酸剂;阻燃剂。
- 可溶性铝盐:净水剂。
图像题型总结
-
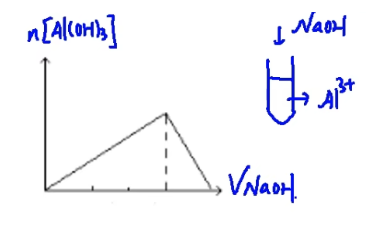
\(\mathrm{Al^{3+}+3OH^-=Al(OH)_3}↓\)
\(\mathrm{Al(OH)_3+OH^-={AlO_2}^-+2H_2O}\)
\(\mathrm{Al^{3+}}\thicksim 3\mathrm{OH^-}\thicksim \mathrm{Al(OH)_3}\thicksim \mathrm{OH^-}\)
-
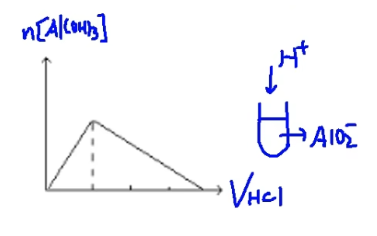
\(\mathrm{{AlO_2}^-+H^++H_2O=Al(OH)_3↓}\)
\(\mathrm{Al(OH)_3+3H^+=Al^{3+}+3H_2O}\)
\(\mathrm{{AlO_2}^-}\thicksim \mathrm{H^+} \thicksim \mathrm{Al(OH)_3}\thicksim 3\mathrm{H^+}\)
拓展:
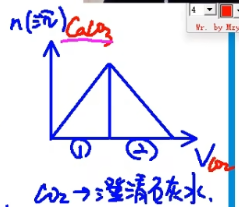
\(\mathrm{Ca(OH)_2+CO_2=CaCO_3↓+H_2O}\)
\(\mathrm{CaCO_3+CO_2+H_2O+Ca(HCO_3)_2}\)
\(\mathrm{Ca(OH)_2}\thicksim \mathrm{CO_2} \thicksim \mathrm{CaCO_3}\thicksim \mathrm{CO_2}\)
-
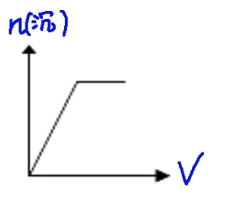
① \(\mathrm{Al^{3+}+3NH_3\cdot H_2O=Al(OH)_3↓+3{NH_4}^+}\)
② \(\mathrm{{AlO_2}^-+CO_2(过量)+H_2O=Al(OH)_3+{HCO_3}^-}\)
-
\(\mathrm{I}.\) \(\mathrm{H^++NH_3\cdot H_2O={NH_4}^++H_2O}\)
\(\mathrm{II.}\) ① \(\mathrm{Al^{3+}+3NH_3\cdot H_2O=Al(OH)_3↓+3{NH_4}^+}\)
② \(\mathrm{{AlO_2}^-+CO_2(过量)+H_2O=Al(OH)_3+{HCO_3}^-}\)
两种情况:过量 \(\mathrm{NH_3\cdot H_2O}\) 通入既有氢离子又有铝离子的溶液中;过量 $\mathrm{CO_2} $ 通入既有氢氧根又有偏铝酸根的溶液中。
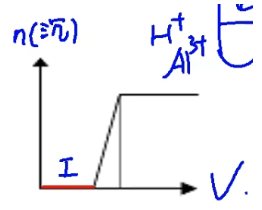
-
\(\mathrm{I}.~① ~\mathrm{Mg^{2+}+2OH^-=Mg(OH)_2↓}\) \(②~\mathrm{Al^{3+}+3OH^-=Al(OH)_3↓}\)
\(\mathrm{II}.~\mathrm{Al(OH)_3+OH^-={AlO_2}^-+2H_2O}\)

补充:如果是铝离子和铁离子反应也是相同的图像。
-
\(\mathrm{I}.~\mathrm{H^++OH^-=H_2O}\)
\(\mathrm{II}.~① ~\mathrm{Mg^{2+}+2OH^-=Mg(OH)_2↓}\) \(②~\mathrm{Al^{3+}+3OH^-=Al(OH)_3↓}\)$
\(\mathrm{III}.\) \(\mathrm{{NH_4}^++OH^-=NH_3\cdot H_2O}\)
\(\mathrm{IV}.~\mathrm{Al(OH)_3+OH^-={AlO_2}^-+2H_2O}\)
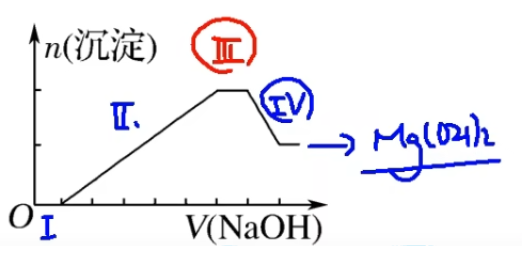
注意:沉淀达到最大值时,溶液中阳离子只有 \(\mathrm{Na^+}\),且所有的 \(\mathrm{Cl^-}\) 都被反应掉。
铁及其化合物
铁单质
物理性质
银白色金属光泽,粉末为黑色;有良好的导电导热性、延展性;铁能被磁铁吸引。
自然界存在形态
主要以化合态存在,有游离态(陨铁)。
化学性质
- 与 \(\mathrm{O_2}\):
- 常温:铁锈(成分为 \(\mathrm{Fe_2O_3\cdot} x\mathrm{H_2O}\));
- 点燃:\(\mathrm{3Fe+2O_2\xlongequal{点燃}Fe_3O_4}\)
-
与非金属反应:
对于氧化性较强的物质:
\[\mathrm{2Fe+3Cl_2\xlongequal{点燃}2FeCl_3}\\ \mathrm{2Fe+3Br_2\xlongequal{}2FeBr_3} \]注意:无论铁是否过量,铁与氯气反应只生成氯化铁,过量的铁不会再跟氯化铁反应生成氯化亚铁,因为生成固体氯化铁,不是水溶液中的三价铁离子。
对于氧化性较弱的物质:
\[\mathrm{Fe+I_2\xlongequal{\triangle}FeI_2}\\ \mathrm{Fe+S\xlongequal{\triangle}FeS} \] -
与水反应:
方程式:
\[\mathrm{3Fe+4H_2O(g)\xlongequal{高温}Fe_3O_4+4H_2} \]实验装置:
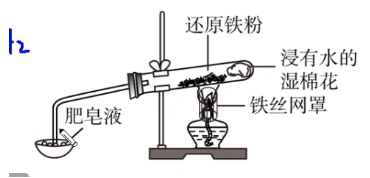
湿棉花:提供高温水蒸气;
小木条:将其靠近肥皂液会有爆鸣声,证明肥皂液破裂,生成氢气。
-
与酸反应
-
稀盐酸、稀硫酸:\(\mathrm{Fe+2H^+=Fe^{2+}+H_2↑}\)
-
稀硝酸(过量):
\[\mathrm{Fe+HNO_3(稀)=Fe(NO_3)_3+NO↑+2H_2O}\\ \mathrm{Fe+{NO_3}^-+4H^+=Fe^{3+}+NO↑+2H_2O} \]产物是 \(\mathrm{Fe^{3+}}\)。
稀硝酸(少量):
\[\mathrm{3Fe+8HNO_3(稀)=3Fe(NO_3)_2+2NO↑+4H_2O}\\ \mathrm{3Fe+2{NO_3}^-+8H^+=3Fe^{2+}+2NO↑+4H_2O} \]相当于铁过量,\(\mathrm{Fe^{3+}}\) 重新被氧化成 \(\mathrm{Fe^{2+}}\)。
-
浓硫酸、浓硝酸:
-
冷、常温:钝化。(不是不反应,是不连续反应。)
-
加热不钝化:
\[\mathrm{Fe+6HNO_3(浓)\xlongequal{\triangle}Fe(NO_3)_3+3NO_2↑+3H_2O} \\ \mathrm{2Fe+6H_2SO_4(浓)\xlongequal{\triangle}Fe_2(SO_4)_3+3SO_2↑+6H_2O} \]
-
-
铁的氧化物
| 化学式 | \(\mathbf{FeO}\) | \(\mathbf{Fe_2O_3}\) | \(\mathbf{Fe_3O_4}\) |
|---|---|---|---|
| 俗名 | / | 铁红(赤铁矿) | 磁性氧化铁 |
| 色态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
| \(\mathbf{Fe}\) 价态 | \(+2\) | \(+3\) | \(+2,+3,+3\) |
| 与 \(\mathbf{H_2}\) | \(\mathrm{FeO+H_2\xlongequal{高温}Fe+H_2O}\) | \(\mathrm{Fe_2O_3+3H_2\xlongequal{高温}2Fe+3H_2O}\) | \(\mathrm{Fe_3O_4+4H_2\xlongequal{高温}3Fe+4H_2O}\) |
| 稳定性 | \(\mathrm{6FeO+O_2\xlongequal{\triangle}2Fe_3O_4}\) | 稳定 | 稳定 |
| 与 \(\mathbf{HCl}\) 或 \(\mathbf{H_2SO_4}\) | \(\mathrm{FeO+2H^+=Fe^{2+}+H_2O}\) | \(\mathrm{Fe_2O_3+6H^+=2Fe^{3+}+3H_2O}\) | \(\mathrm{Fe_3O_4+8H^+=Fe^{2+}+2Fe^{3+}+4H_2O}\) |
| 与 \(\mathbf{HNO_3}\) | \(\mathrm{3FeO+{NO_3}^-+10H^+=3Fe^{3+}+NO↑+5H_2O}\) | 同上 | \(\mathrm{Fe_3O_4+{NO_3}^-+28H^+=9Fe^{3+}+NO↑+14H_2O}\) |
注意:
- 四氧化三铁不是碱性氧化物,因为其与酸反应生成两种盐;
- 四氧化三铁与酸的反应实际上可以看做 \(\mathrm{FeO}\) 和 \(\mathrm{Fe_2O_3}\) 与酸反应的方程式叠加形成;
- 目前学过的生成四氧化三铁的反应只有三个:①铁在氧气中燃烧;②铁与水蒸气反应;③氧化铁受热分解。
铁的氢氧化物
| 名称 | 氢氧化亚铁 \(\mathbf{Fe(OH)_2}\) | 氢氧化铁 \(\mathbf{Fe(OH)_3}\) |
|---|---|---|
| 物理性质 | 白色固体,不溶于水 | 红褐色固体,不溶于水 |
| 与 \(\mathbf{HCl}\) | \(\mathrm{Fe(OH)_2+2H^+=Fe^{2+}+2H_2O}\) | \(\mathrm{Fe(OH)_3+3H^+=Fe^{3+}+3H_2O}\) |
| 与稀硝酸 | \(\mathrm{3Fe(OH)_2+10HNO_3=3Fe(NO_3)_3+NO↑+8H_2O}\) | 同上 |
| 加热 | \(\mathrm{Fe(OH)_2\xlongequal{\triangle}FeO+H_2O(无 ~O_2)}\) | \(\mathrm{2Fe(OH)_3\xlongequal{\triangle}Fe_2O_3+3H_2O}\) |
二者转化:在空气中,\(\mathrm{Fe(OH)_2}\) 能够非常迅速地被氧气氧化成 \(\mathrm{Fe(OH)_3}\);
反应方程式:\(\mathrm{4Fe(OH)_2+O_2+2H_2O=4Fe(OH)_3}\)
现象:白色沉淀迅速变成灰绿色,最终变成红褐色。
铁三角
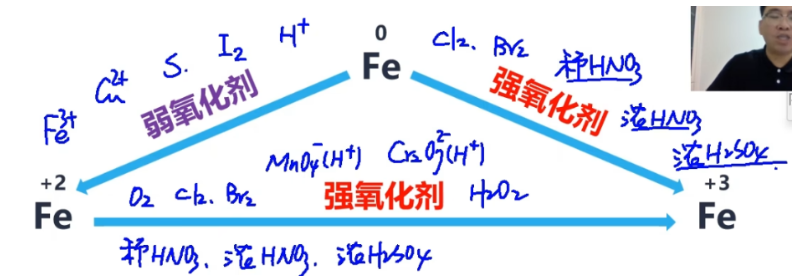
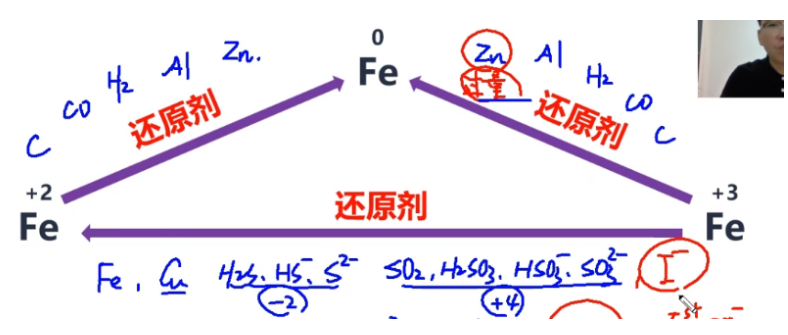
一般性规律:
- 铁和 \(\mathrm{H^+}\)、\(\mathrm{I_2}\)、\(\mathrm{S}\)、\(\mathrm{Cu^{2+}}\)、\(\mathrm{Fe^{3+}}\) 等弱氧化剂反应生成二价铁;
- 铁和 \(\mathrm{Cl_2}\)、\(\mathrm{Br_2}\)、稀硫酸、浓硫酸、浓硝酸(两浓酸一稀酸)等强氧化剂反应生成三价铁;
- 二价铁可以和 2. 中的所有氧化剂反应生成三价铁;除此之外,也可以与酸性高锰酸钾 \(\mathrm{{MnO_4}^-}\)、酸性重铬酸钾 \(\mathrm{{Cr_2O_7}^{2-}}\)、\(\mathrm{H_2O_2}\) 等强氧化剂反应生成三价铁。
- 不管是二价铁还是铁与“两浓酸一稀酸“反应,生成物均遵循:稀硫酸变一氧化氮,浓硝酸变二氧化氮,浓硫酸变二氧化硫(浓酸变二氧化物,稀酸变一氧化物)。
- 二价铁和三价铁可以通过 \(\mathrm{Zn}\)、\(\mathrm{Al}\) 等活泼金属(活泼性比铁强),以及 \(\mathrm{H_2}\)、\(\mathrm{CO}\)、\(\mathrm{C}\) 等常见的强还原剂还原为铁单质。
- 一般情况下,三价铁变铁单质的还原剂需要过量(若不过量可能会反应生成二价铁)。
- 三价铁可以通过 \(\mathrm{Fe}\)、\(\mathrm{Cu}\) 等金属(活泼性似乎小于等于铁),以及 \(\mathrm{S^{2-}}\)、\(\mathrm{S^{4+}}\)、\(\mathrm{I_2}\) 等弱还原剂还原出二价铁;
- 三价铁离子与铜的反应不是置换反应,同时这也是“用氯化铁溶液来腐蚀铜制印刷电路板”的离子反应。
- 三价铁与弱还原剂反应遵循:二价硫变硫单质,四价硫变硫酸根离子(价态 +2)。
重点方程式(此处只写上面未提到的且较为重要的):
氢氧化亚铁的制备
-
制备原理:\(\mathrm{FeSO_4+2NaOH=Fe(OH)_2↓+Na_2SO_4}\)
-
关键:
- 溶液中不含三价铁和氧气等物质:
- 新配制作 \(\mathrm{FeSO_4}\) 溶液且加入少量铁粉(防止 \(\mathrm{Fe^{2+}}\) 被氧化) ;
- 配制 \(\mathrm{FeSO_4}\) 溶液的蒸馏水、氢氧化钠溶液均需煮沸(除去 \(\mathrm{O_2}\));
- 制备过程中要保证生成的氢氧化亚铁沉淀处在隔绝空气的体系中。
- 溶液中不含三价铁和氧气等物质:
-
实验装置:
-
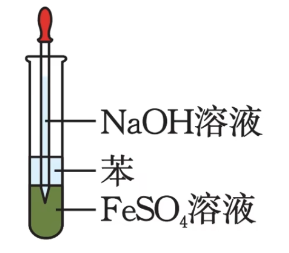
有机物覆盖层法:
将吸取氢氧化钠溶液的胶头滴管直接伸入硫酸亚铁溶液中进行挤压,使氢氧化钠直接与硫酸亚铁溶液反应。
其中,苯与水互不相溶,且 \(\rho_笨<\rho_水\),也可以用正己烷替换苯。
四氯化碳不能替换苯,因为其密度大于水。
-
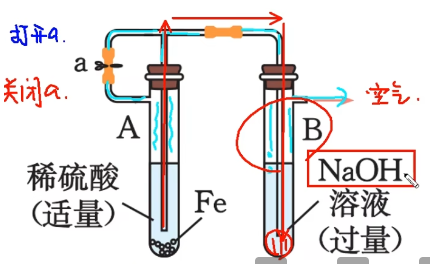
还原性气体(\(\mathrm{H_2}\))保护法:
-
先打开止水夹 a:稀硫酸与铁反应生成的 \(\mathrm{H_2}\) 会充满整个装置,并排除装置内的空气。
-
再关闭 a:氢气在试管 A 内由于压强会将液面向下挤压,生成的硫酸亚铁被压入导管,进入 B 装置内,与氢氧化钠溶液发生反应,生成白色沉淀。
-
-
\(\mathbf{Fe^{2+}}\) 和 \(\mathbf{Fe^{3+}}\) 的检验
- 直接观色:二价铁:浅绿;三价铁:棕黄色;
- 与 \(\mathrm{KSCN}\) 溶液反应:二价铁:无明显变化;三价铁:显红色;(最常使用检验三价铁)
- 利用三价铁离子的氧化性(与 \(\mathrm{KI}\) 淀粉溶液反应):二价铁:不反应;三价铁:溶液变蓝。
- 利用二价铁离子的还原性(与酸性高锰酸钾溶液反应):二价铁:紫色褪去;三价铁:不反应;
- 利用沉淀:
- 与 \(\mathrm{NaOH}\) 溶液反应:二价铁:白色沉淀,迅速灰绿,最终红褐;三价铁:直接生成红褐色沉淀;
- 与 \(\mathrm{K_3[Fe(CN)_6]}\)(铁氰化钾) 反应:蓝色沉淀;三价铁:无现象。(最常使用检验二价铁)
- 检验有二价铁无三价铁:先加入 \(\mathrm{KSCN}\) 溶液,不变红(排除三价铁),再加入 \(\mathrm{H_2O_2}\) 或氯水,溶液变红。不能加入高锰酸钾作为还原剂,因为它本身为紫红色,干扰试验。
\(\mathbf{Fe}\)、\(\mathbf{Cu}\) 与 \(\mathbf{FeCl_3}\)、\(\mathbf{CuCl_2}\) 溶液的反应问题
- 原理:
氧化性:\(\mathrm{Fe^{3+}>Cu^{2+}>Fe^{2+}}\)(两铁夹一铜)
还原性:\(\mathrm{Fe>Cu>Fe^{2+}}\)
-
反应的先后顺序(根据氧化还原反应“强者先行”):
- \(\mathrm{Fe+Cu}\to \mathrm{FeCl_3}\) 溶液:铁先铜后;
- \(\mathrm{Fe}\to \mathrm{FeCl_3+CuCl_3}\) 溶液:先三价铁再铜离子;
-
互斥性(判断剩下的物质跟谁会反应):
- 反应完还有铁:三价铁、铜离子不存在;
- 反应完还有铜:三价铁不存在;
- 反应完还有三价铁:铁、铜不存在(无固体);换句话说,只要有固体一定没三价铁。
- 反应完还有铜离子:铁不存在;
铁及其化合物与酸反应的思维模型
-
观察开始反应物质和结尾反应物质,不考虑中间量,直接根据三大守恒计算;
-
确认反应方程式&反应先后顺序:
例:\(\mathrm{Fe}\)、\(\mathrm{FeO}\)、\(\mathrm{Fe_2O_3}\) 和 \(\mathrm{Fe_3O_4}\) 与稀 \(\mathrm{H_2SO_4}\) 反应,若假如硫氰化钾溶液不变红,则说明溶液中无 \(\mathrm{Fe^{3+}}\),即 \(\mathrm{Fe}\) 和 \(\mathrm{FeO}\) 反应生成 \(\mathrm{Fe^{2+}}\),\(\mathrm{Fe_2O_3}\) 反应生成 \(\mathrm{Fe^{3+}}\),\(\mathrm{Fe_3O_4}\) 反应生成 \(\mathrm{Fe^{2+}}\) 和 \(\mathrm{Fe^{3+}}\),后两者生成的 \(\mathrm{Fe^{3+}}\) 再与过量铁粉反应生成 \(\mathrm{Fe^{2+}}\),除去 \(\mathrm{Fe^{3+}}\)。
-
考虑让第一步反应过量的剩余物质在第二步再次进行反应,需要弄清“剩余物质”都是什么,且物质的量是多少。