圣犹太儿童研究医院(St. Jude Children's Research Hospital)的科学家们发现,免疫细胞和肿瘤细胞在它们的局部环境中争会夺谷氨酰胺。谷氨酰胺是一种营养物质,对抗癌活性具有重要意义。如果癌细胞垄断谷氨酰胺,则可以阻止免疫细胞破坏癌细胞。研究结果表明,将谷氨酰胺直接供给肿瘤细胞有助于启动免疫系统的抗癌活性。研究人员还鉴定了一个可能作为潜在药物靶点的分子通路。研究成果于2023年7月5日发表在《自然》杂志上。

“这是肿瘤细胞和免疫细胞之间关于营养物质的拔河比赛”,圣犹太免疫学部的通讯作者Hongbo Chi博士说。“如果肿瘤细胞使用了所有可用的谷氨酰胺,那么一种称为树突状细胞的特殊免疫细胞类型就会缺乏谷氨酰胺,从而导致抗肿瘤免疫功能受损。但是,如果我们直接向肿瘤微环境中补充足够的谷氨酰胺,则将抑制肿瘤生长,因为树突状细胞会利用谷氨酰胺并激活适应性免疫反应。” 树突状细胞能激活抗癌免疫细胞T细胞。
该研究表明,在肿瘤微环境中重新提供谷氨酰胺会显著减弱肿瘤生长,因为树突状细胞能更好地激活抗癌T细胞。肿瘤微环境由癌细胞周围的化学物质和细胞组成。众所周知,癌细胞会分泌许多信号,“关闭”肿瘤微环境中的免疫反应,尤其是那些可杀伤肿瘤的T细胞。圣犹太团队是首个在这个局部环境中发现营养素成为癌细胞和树突状细胞之间主要的信号分子的团队。
改进抗癌疗法
“我们非常高兴能在谷氨酰胺、治疗效果和树突状细胞之间建立联系,”圣犹太免疫学部的第一作者Chuansheng Guo博士 (郭传生,浙大医学院毕业)说。“这对免疫检查点阻断和采用细胞转移疗法的疗效至关重要。”
免疫检查点阻断疗法抑制癌细胞向免疫细胞发送的“关闭”信号,这些信号会抑制肿瘤微环境中的免疫反应。这些治疗方法已经取得了很高的疗效,但仅在少数患者中有效。研究人员发现,将谷氨酰胺与检查点疗法结合使用,可增强小鼠的抗癌活性。
Chi博士说:“这篇论文提供了一个概念证明,即营养素可以与检查点抑制剂协同作用,作为肿瘤治疗的新策略。”
帮助或阻碍癌细胞杀手的机制
尽管许多癌症研究关注T细胞,因为它们具有直接杀死癌细胞的活性,但这项研究是首次研究肿瘤微环境如何影响树突状细胞(激活T细胞)的研究之一。研究人员发现,如果没有谷氨酰胺,树突状细胞无法激活直接杀死癌细胞的T细胞。
Chi博士解释说:“尽管T细胞是抗癌免疫的基石,但它们不能独自完成任务。我们可以把树突状细胞看作是驱动器,T细胞看作是汽车。如果没有驱动器,汽车就不会移动。此外,像谷氨酰胺这样的营养物质可以被视为驱动器的许可证。”
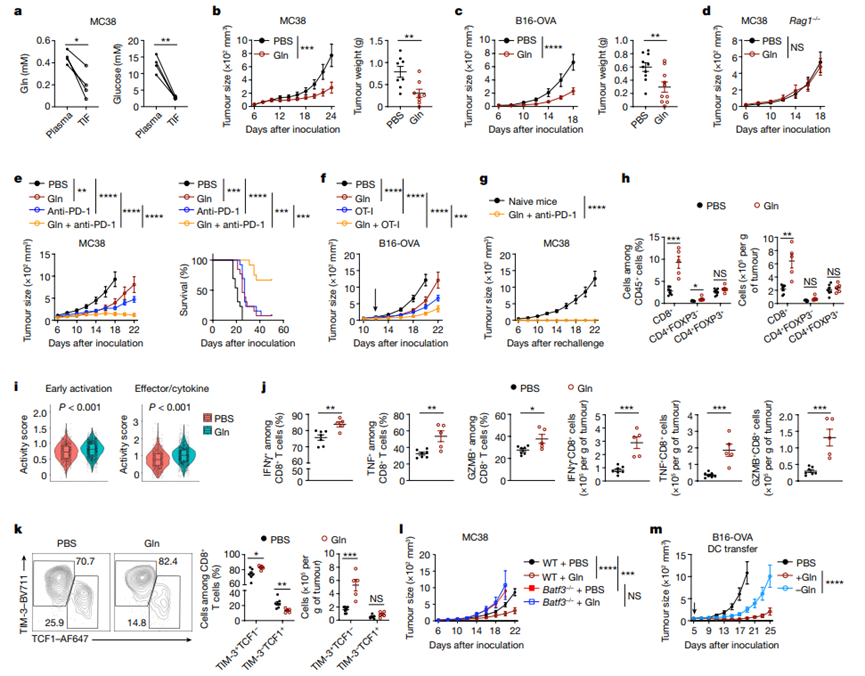
肿瘤内谷氨酰胺补充促进cDC1介导的抗肿瘤免疫
类似地,当研究人员去除树突状细胞中响应或摄取谷氨酰胺的蛋白质时,树突状细胞未能激活癌细胞杀手T细胞。这些蛋白质(FLCN和SLC38A2)在感知和获取营养物质方面很重要,但先前的研究并没有将其与免疫细胞的抗癌反应联系起来。它们或许可作为潜在的药物靶点来改善癌症治疗。
Chi博士说:“我们对这些发现非常兴奋。除了增强治疗干预外,我们还通过展示营养物质如何介导细胞间通信提供了概念上的突破。”

肿瘤细胞通过与免疫细胞的相互作用来逃避T细胞介导的杀伤作用,其机制尚不完全清楚。树突状细胞(DCs),尤其是类型1即传统DCs(cDC1s),介导T细胞的初级免疫应答和对肿瘤的治疗效果。DC功能由模式识别受体调控,尽管其他参与的信号尚未完全明确。营养素正在成为调节适应性免疫的新兴介质,但营养素是否影响DC功能或调节先天免疫细胞和适应性免疫细胞之间的通信尚未明确。本研究中,我们鉴定了谷氨酰胺作为一个细胞间代谢检查点,决定肿瘤-cDC1相互作用并授权cDC1在激活细胞毒性T细胞方面的功能。肿瘤内谷氨酰胺的补充可通过增强cDC1介导的CD8+ T细胞免疫应答抑制肿瘤生长,并克服对检查点阻断和T细胞介导的免疫治疗的治疗抵抗性。从机制上讲,肿瘤细胞和cDC1通过转运蛋白SLC38A2竞争谷氨酰胺摄取来调节抗肿瘤免疫应答。营养素筛选和整合分析显示谷氨酰胺是促进cDC1功能的主要氨基酸。此外,谷氨酰胺通过FLCN信号传导影响TFEB功能。在DC1中选择性缺失FLCN会以TFEB依赖性方式损害cDC1功能,并通过消除谷氨酰胺补充的抗肿瘤治疗效果表现出与SLC38A2缺乏相同的表型。我们的发现建立了肿瘤细胞与cDC1之间通过谷氨酰胺介导的细胞间代谢交叉作用,为肿瘤免疫逃避奠定了基础,并揭示了cDC1的谷氨酰胺获取和信号传导可作为DC激活的限制性事件和癌症治疗的潜在靶点。
阅读原文内容:
https://www.sciencedaily.com/releases/2023/07/230705143007.htm
查看原文信息:
https://www.nature.com/articles/s41586-023-06299-8
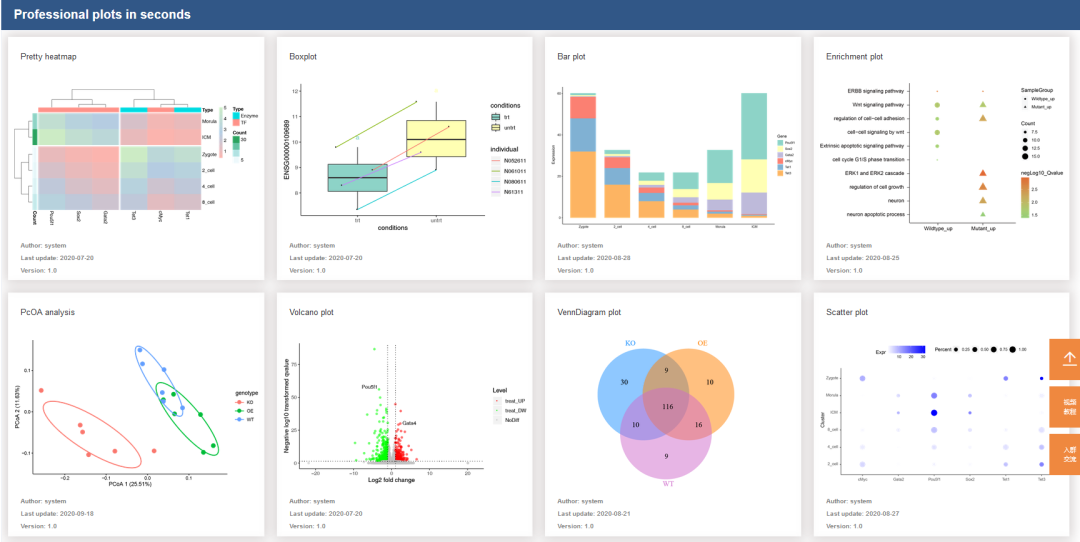
往期精品(点击图片直达文字对应教程)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
机器学习