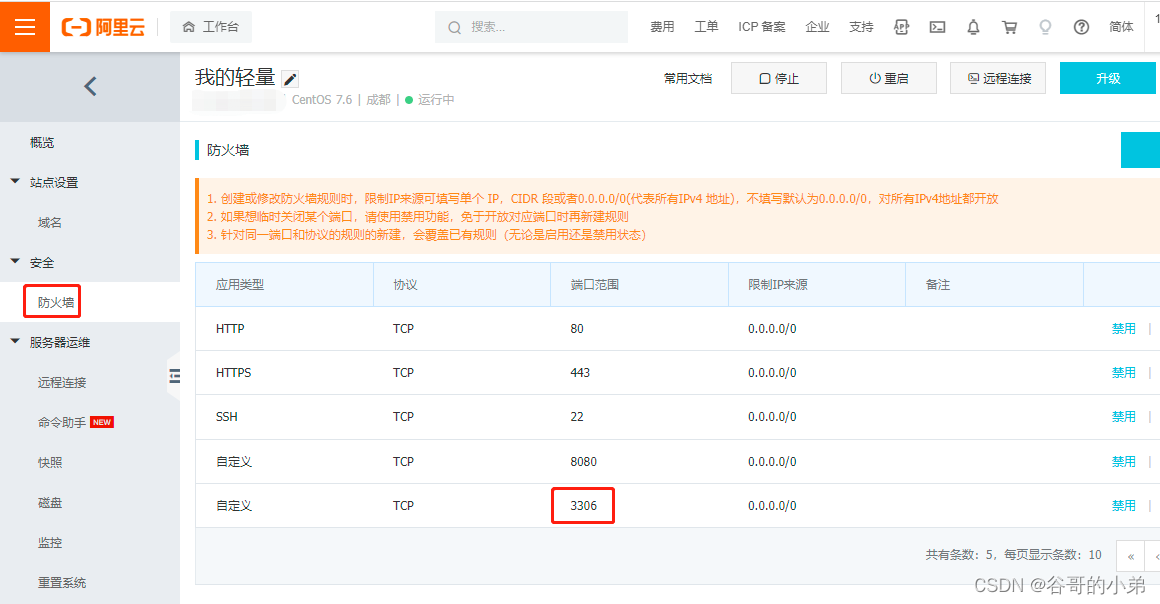
文章信息
题目:GhMYB7 promotes secondary wall cellulose deposition in cotton fibres by regulating GhCesA gene expression through three distinct cis-elements
刊名:New Phytologist
作者:Junfeng Huang,Wenliang Xu et al.
单位:Central China Normal University
日期:10 July 2021
01
摘要
棉纤维是天然纺织品最重要的来源。成熟棉纤维的次生细胞壁 (SCW) 在任何植物中都含有最高比例的纤维素含量 (> 90%)。需要严格控制 SCW 纤维素合成的开始和进展以平衡纤维伸长和细胞壁沉积。然而,在棉花纤维生长过程中控制纤维素合成的调控机制仍然难以捉摸。
在这里,我们进行了遗传和功能分析,证明 R2R3-MYB GhMYB7 控制棉纤维纤维素的合成。
棉花中GhMYB7的过度表达加速了纤维细胞中 SCW 纤维素的生物合成,并导致纤维更短、壁更厚。相比之下,GhMYB7的 RNA 干扰 (RNAi) 沉默延迟了纤维 SCW 纤维素的合成,并导致细长的纤维壁更薄。此外,我们证明 GhMYB7 通过直接结合各自 GhCesA4、GhCesA7 和 GhCesA8 启动子中的三个不同的顺式元件来调节棉纤维 SCW 纤维素合酶。我们发现这种纤维素合成的调控机制也被其他 GhMYBs “劫持”。
总之,我们的研究结果揭示了棉纤维用来调节 SCW 纤维素合成的一种迄今为止未知的机制。我们的研究结果还为棉纤维 SCW 厚度的遗传改良提供了策略。
02
技术路线
Gossypium hirsutum cv. Coker 312
Vector construction and transformation
RNA extraction and RT-PCR
Crystalline cellulose analysis
RNA-Seq analysis
Microscopic analysis
03
主要结果
3.1 棉花中GhMYB7的过度表达导致纤维变短变厚,而GhMYB7的RNA干扰(RNAi)导致纤维变长变薄
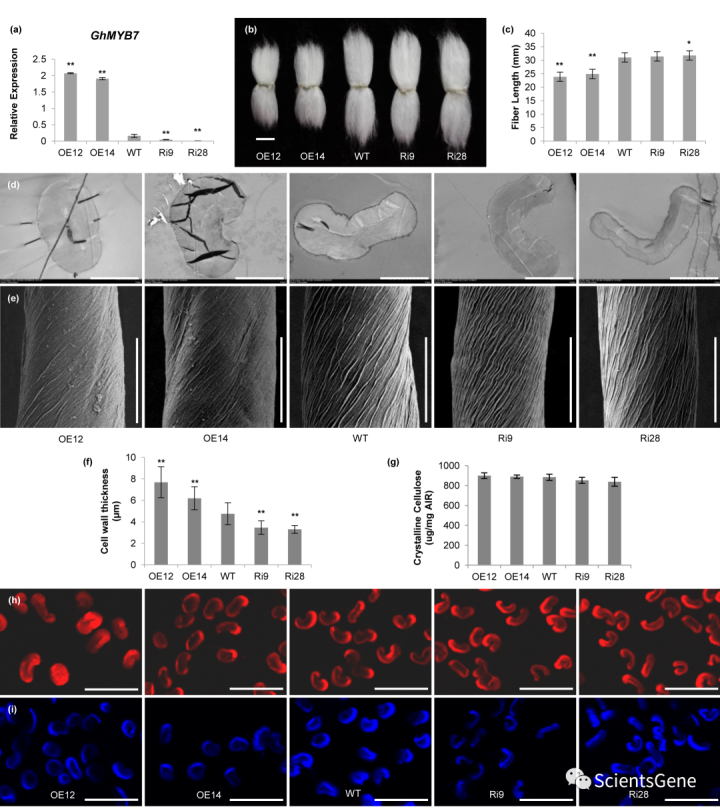
为了研究GhMYB7在棉花纤维发育过程中的功能,我们构建了过表达(OE)和RNA干扰(RNAi)载体,并将其转化棉花。我们获得了8个OE和15个RNAi沉默的转基因株系。其中,我们选择了两个表现出GhMYB7表达显著升高的独立OE系(OE12和OE14),以及两个表现为GhMYP7表达显著降低的独立RNAi沉默系(Ri9和Ri28),用于进一步的纤维表型分析(图1a,S1)。在棉花生长发育过程中,不同基因型的植株高度和大小没有明显变化(图S2a)。接下来,我们在相同的环境下,在相似的果枝上收获棉铃,并测量成熟纤维的长度。如图1b和1c所示,OE植物的成熟纤维明显短于野生型,而RNAi沉默系的纤维稍长。湖北省农业科学院测定的纤维质量证实了这些结果(表S1)。
成熟纤维横切面的进一步透射电镜观察表明,与野生型相比,GhMYB7的过度表达增加了棉花纤维细胞壁的厚度,而RNA干扰降低了细胞壁厚度(图1d,f)。扫描电子显微镜显示,成熟GhMYB7 OE纤维表面的原纤维排列与野生型纤维明显不同(图1e)。OE纤维的表面看起来更光滑,而野生型纤维细胞的表面可以清楚地看到凹槽。RNAi系的微纤丝排列角度比野生型的更陡。这些结果表明,转基因纤维具有不同结构特征的细胞壁。尽管细胞壁厚度大幅度降低,但成熟转基因纤维中的纤维素含量并没有发生显著变化,这是通过结晶纤维素分析或比较两种纤维素特异性染料的荧光强度来测量的:桥胺坚牢大红4B(S4B)和钙氟白色(图1g-i)。一致地,成熟纤维中乙醇不溶残留物(AIR)的单糖组成分析表明,转基因株系和野生型之间的总葡萄糖(Glc)没有明显变化(表S2)。此外,我们发现转基因系和野生型之间的绒毛纤维长度和种子大小没有明显差异(图S2b,c)。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 1
3.2 GhMYB7过度表达导致纤维中次生壁纤维素的早熟沉积,而GhMYB7 RNAi沉默延迟纤维纤维素的合成
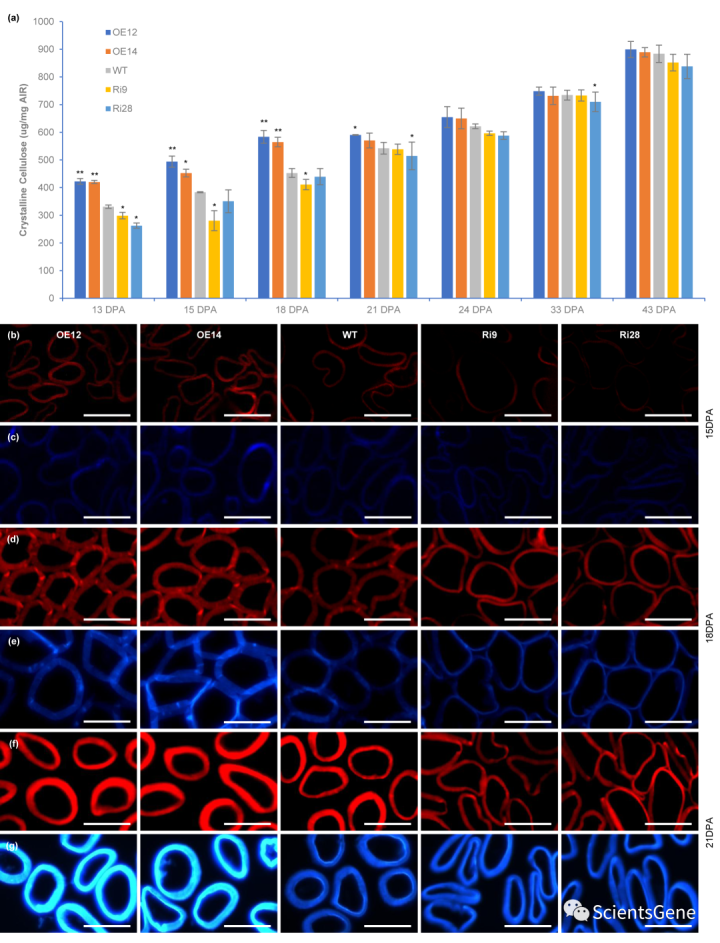
由于成熟转基因棉纤维的纤维素含量与野生型相似,我们接下来研究了转基因棉纤维和野生型棉纤维在棉花纤维发育不同阶段的纤维素沉积。如图2a所示,在13种野生型DPA棉纤维中,结晶纤维素含量约占总细胞壁的33%,在15种DPA纤维中占38%,在18种DPA光纤中占45%,最后在43种DPA纤中约占88%。然而,在GhMYB7 OE系中,沉积的纤维素含量在13-21 dpa之间显著高于野生型。相比之下,在RNAi系中,纤维素含量从13到21 dpa低于野生型,之后野生型和RNAi株系之间的差异逐渐消除(图2a,表S3)。
同时,我们比较了使用S4B和钙荧光白对横截面的纤维素染色。在15个DPA纤维中,OE系中观察到明显的荧光,而在相同显微镜设置下,RNAi和野生型纤维中观察到的荧光要低得多(图2b,c)。在18个DPA纤维上,在RNAi细胞系中可以清楚地观察到荧光,但远弱于OE细胞系。此外,OE系的纤维细胞壁比RNAi和野生型纤维厚(图2d,e)。在这里,OE系的纤维横截面呈圆形,而沉默系则略微压缩和扁平(图2f,g)。纤维中SCW纤维素合成开始时间的显微镜分析表明,GhMYB7过度表达促进了早期SCW纤维素的合成,而GhMYP7下调延迟了这一过程,这与结晶纤维素分析一致。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 2
3.3 GhMYB7过度表达在纤维发育过程中促进GhCesAs的表达
由于GhMYB7的过度表达导致SCW纤维素合成的早期开始,我们接下来试图研究这是否是由于GhCesA表达水平的变化所致。因此,我们在纤维发育期间对GhCesAs进行了qRT PCR分析。我们选择了三个具有代表性的基因GhCesA4-2、GhCes A7-3、Gh CesA8-2,因为它们在纤维中的表达均高于它们的同源基因。
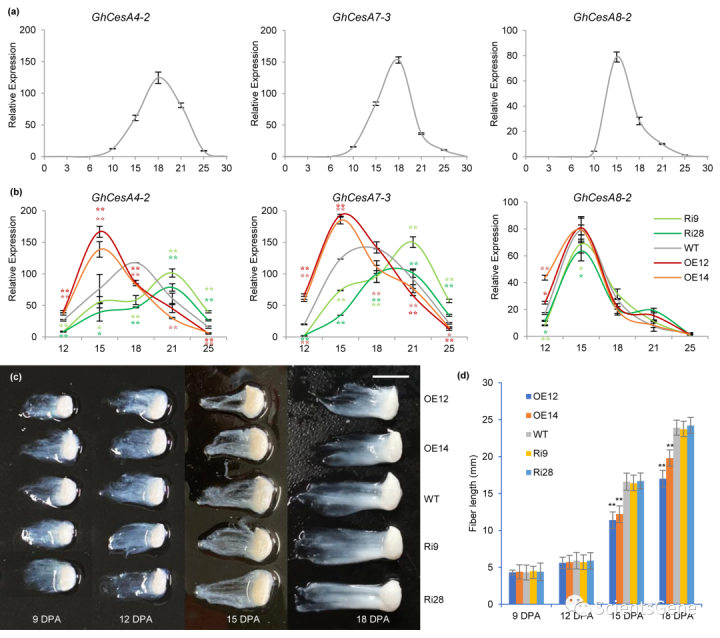
与野生型相比,GhMYB7的转录水平在OE系和RNAi系中分别持续上调和下调(图S3)。三种GhCesAs的表达在10 DPA时较低,但随后几乎线性增加,GhCes14-2和GhCesesA7-3的表达量高达18 DPA,GhCesA8-2的表达量为15 DPA(图3a),此后表达水平下降。然而,GhCesA4-2和GhCea7-3的表达都受到了极大的诱导,并且在OE系的15个DPA纤维中达到了最高水平,之后表达缓慢下降。相比之下,GhCesA8-2没有显示类似的表达曲线,更接近野生型纤维的表达曲线(图3b)。
在RNAi沉默系中,GhCesA4-2和GhCea7-3的表达直到21个DPA纤维才达到高峰,令人惊讶的是,其表达量略高于OE系和野生型细胞。为了评估棉花纤维伸长率是否与GhCesAs的表达谱相关,我们测量了所有品系中从9 DPA到18 DPA的纤维长度。如图3c和3d所示,转基因株系与野生型9 DPA和12 DPA纤维之间只有细微差异。然而,与野生型相比,OE系15和18 DPA纤维的纤维长度大大缩短。这些发现表明,GhMYB7的过度表达促进了SCW GhCesA基因的早熟表达,导致了纤维中SCW纤维素的早期沉积,从而抑制了纤维的过早伸长。相反,GhMYB7 RNAi沉默导致GhCesA基因延迟表达,导致SCW纤维素沉积延迟,使纤维延长。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 3
3.4 GhMYB7通过直接结合其启动子激活次级壁GhCesAs的表达
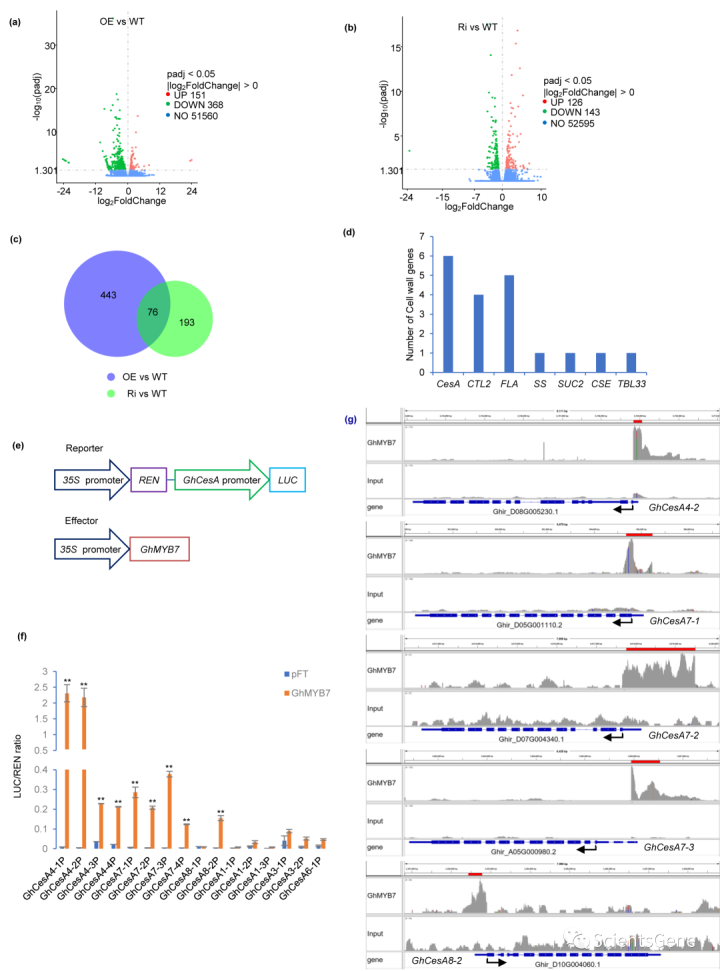
为了了解哪些基因受GhMYB7表达改变的影响,我们首先收集了15条DPA纤维进行RNA测序。转录组学结果表明,与野生型相比,OE系中有519个基因显著改变,其中151个基因上调,368个基因下调(数据集S2,图4a)。相比之下,RNAi系中有269个基因发生了变化,其中126个基因上调,143个基因下调(数据集S3,图4b)。
我们首先关注OE系上调和RNAi系下调的细胞壁相关基因(数据集S2、S3、图4c、d)。值得注意的是,CesA基因代表了最丰富的细胞壁基因类别,在OE和RNAi沉默的纤维中表现出相反的表达,这表明GhCesA可能是GhMYB7的靶基因(图4d,S4)。与这一发现一致,GO分析显示,OE系中差异表达基因(DEG)上调,RNAi沉默系中DEG下调,纤维素生物合成过程高度富集(图S5、S6)。我们还通过qRT PCR证实了GhMYB7转基因系纤维中10个SCW GhCesAs的表达变化(图S7)。
为了测试GhMYB7是否能激活GhCesA启动子,我们在烟叶中进行了瞬时反式激活分析(TAA)(图4e)。如图4f所示,GhCesA4-1和GhCes A4-2启动子均被强烈激活,并且在十个启动子中表现出最高的诱导率。相比之下,GhCesA7-4和GhCes A8-2启动子仅被弱激活。除GhCesA8-1外,其他GhCes A启动子中度激活,未检测到反式激活。应该注意的是,六个PCW GhCesA启动子没有被GhMYB7明显激活(图4f)。
为了证实这些结果,我们接下来通过染色质免疫沉淀测序(ChIP Seq),利用18种DPA野生型纤维中的特异性多克隆抗GhMYB7抗体,探索了GhMYP7与植物启动子之间的相互作用(图S8)。我们测序了一个ChIP(抗GhMYB7)和一个对照(无抗体)库。GhMYB7的IP实验中有1999个峰值和2559个峰值(图S9,数据集S4)。我们发现,SCW GhCesAs的几个启动子区域(如GhCes14-2、GhCesesA7-1、Gh CesA7-2、Gh-CesA7-3和GhCes A8-2)在GhMYB7沉淀染色质中显著富集(图4g)。因此,GhMYB7可以结合并激活多个SCW GhCesA启动子。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 4
3.5 GhMYB7通过SMRE直接与GhCesA4-2启动子结合
为了了解GhMYB7介导转录调控的机制,我们接下来分析了GhCesA基因的启动子区域,以确定GhMYB7识别的顺式作用调控基序。7-bp序列ACC(A/T)A(A/C)(T/C)是拟南芥中的次生壁MYB反应元件(SMRE)。因此,我们在10个SCW GhCesA基因的启动子区域中寻找SMRE基序。如图S10所示,这些启动子中有一到五个SMRE。
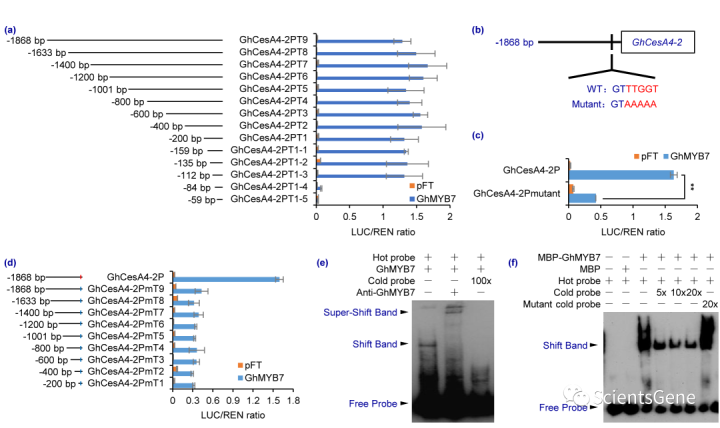
为了测试SMRE位点是否真的是GhMYB7识别的响应元件,我们首先截断了GhCesA4-2的启动子区域,并确认持有SMRE位点的区域是通过TAA激活GhMYP7所必需的(图5a)。我们选择了GhCesA4-2启动子,因为它只包含一个SMRE,并显示出高诱导活性(图4f,S10a)。我们还在该区域创造了一系列突变,并通过EMSA验证了GhMYB7与SMRE位点结合(图S11a-d)。
接下来,我们将SMRE位点(GTTTGGTA)突变为GTAAAAAA并进行TAA,这表明激活显著降低(图5b,c)。此外,类似于图5a中的启动子缺失序列,但SMRE基序发生突变,清楚地表明GhMYB7激活需要该基序(图5d)。这些数据证实,SMRE是GhMYB7激活的GhCesA4-2启动子中的顺式元件。
为了确保GhMYP7与SMRE位点的结合具有序列特异性,我们最终用生物素标记的50 bp DNA片段(包含SMRE基序)培育纯化的GhMYB7蛋白并进行EMSA。该分析显示探针的流动性发生了变化,并且在添加GhMYB7抗体(抗GhMYP7-GhMYB7蛋白DNA探针)时形成了超位移带(图5e)。
此外,添加未标记的冷探针以剂量依赖的方式有效地与结合竞争,冷探针的突变失去了与热探针竞争的能力(图5f)。总之,我们的数据表明SMRE是GhMYB7结合激活GhCesA4-2启动子的基序。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 5
3.6 GhMYB7通过一个新的应答元件ATCAAA直接与GhCesA7-3启动子结合
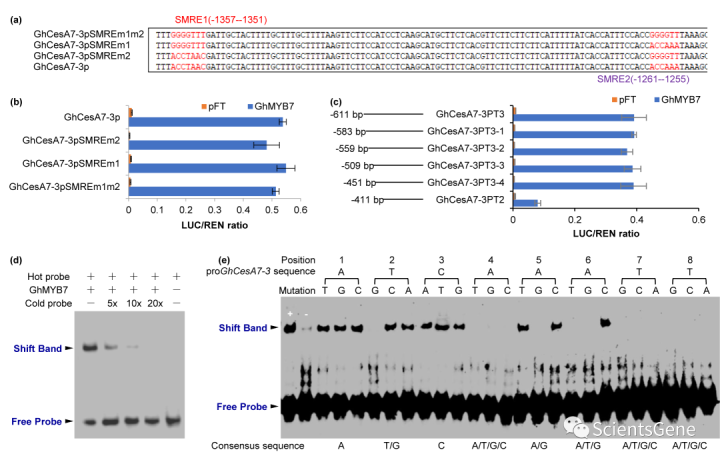
为了确定GhMYB7是否也使用SMRE激活其他GhCesA启动子,我们在GhCea7-3启动子中单独或同时突变两个SMRE,以评估对GhMYP7激活的影响(图6a)。我们选择GhCesA7-3是因为它是四种GhCea7亚型的代表,并且其启动子很容易被GhMYB7激活(图4f)。有趣的是,TAA实验表明,GhCesA7-3启动子中单个或两个SMRE的突变并未导致GhMYB7启动子激活的任何减少(图6b),这表明GhMYP7可能与SMRE以外的其他元素结合。为了鉴定这种顺式元件,我们从GhCesA7-3启动子的5'端开始,产生了一系列缺失。TAA结果表明,GhCes A7-3的启动子区域-611 bp至-411 bp,不包含任何SMRE相关位点,是GhMYB7诱导激活的原因(图S12a)。
进一步的缺失分析结合TAA将GhMYB7激活序列从GhCesA7-3基因的起始密码子缩小至-451 bp至-411 bp区域(图6c)。为了确定GhMYB7是否能与该区域的元素结合,我们使用生物素标记的50 bp片段(起始密码子包含-451 bp到-411 bp)作为热探针进行了EMSA。与GhMYB7重组蛋白孵育后,探针显示出明显的带移(图6d)。随着竞争对手未标记冷探针浓度的增加,培养结果显示,结合明显呈剂量依赖性降低。当以20倍摩尔过量使用时,未标记的50 bp片段消除了GhMYB7与热探针的结合(图6d)。
为了确定GhCesA7-3启动子50 bp区域内的特定GhMYB7结合基序,我们在该区域进行了一系列点突变。50 bp序列中八个核苷酸的连续突变导致六个突变的寡核苷酸被用作EMSA的竞争对手(图S12b)。突变m1、m2、m3、m5和m6有效地超过了GhMYB7与野生型50 bp片段的结合,而m4没有(图S12c),表明8 bp的ATCAAATT是GhMYP7识别的假定核心序列。
GhCesA7-3启动子中的ATCAATATT到CGACCCAA的进一步突变导致GhMYB7的活性显著丧失,如通过TAA测试,确认GhMYB7通过直接结合启动子中的该位点激活GhCesA7-3的表达(图S12f)。为了定义一致的GhMYB7结合基序,通过一次用所有其他三个核苷酸替换一个核苷酸,进一步突变8-bp寡核苷酸,产生24个突变寡核苷酸,每个寡核苷酸都包含一个单核苷酸突变(图6e,S12d)。这些突变的寡核苷酸用于挑战GhMYB7与原始8-bp核心序列的结合。所得EMSA结果显示,作为GhMYB7响应性顺式作用调控元件的6-bp基序[a(T/G)CN(a/G)(a/T/G)](图S12e)。这个6 bp基序是一种新的TF-DNA结合顺式元件,以下称为纤维二次壁MYB结合元件2(FSMBE2)。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 6
3.7 GhMYB7通过应答元件CAACCG直接与GhCesA8-2启动子结合
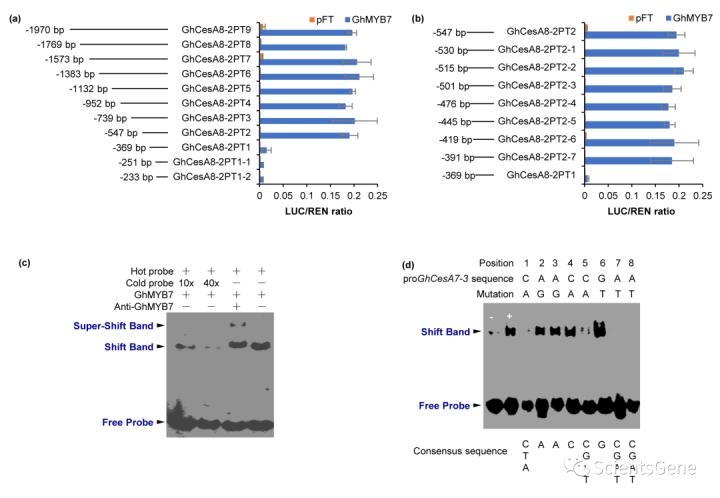
鉴于GhMYB7与GhCesA4-2和GhCea7-3启动子中的不同顺式作用调控元件结合,我们接下来试图确定GhMYP7在GhCes A8-2启动子中可能结合的位点。该启动子包含多达六个SMRE位点(图S10)。GhCesA8-2启动子与TAA的一系列5'缺失表明,位于-547 bp和-369 bp(起始密码子上游)之间的DNA片段(包含一个SMRE)足以被GhMYB7激活(图7a)。起始密码子上游-391 bp和-369 bp之间的DNA片段进一步缺失导致GhMYB7活性丧失(图7b),表明GhMYP7响应元件位于该片段中。奇怪的是,该碎片不包含任何SMRE(图S10)。
接下来,我们使用带有相应50 bp片段(起始密码子上游-391 bp和-369 bp)的EMSA作为探针。当与重组GhMYB7蛋白孵育时,生物素标记的50 bp片段显示出明显的带移,表明GhMYP7与50 bp片段结合。添加未标记的50 bp片段探针以剂量依赖的方式有效地与结合竞争,因为随着未标记冷探针浓度的增加,移位的条带逐渐消失(图7c)。此外,当抗GhMYB7抗体与重组GhMYP7蛋白和标记的热探针孵育时,除GhMYB7 DNA移位带外,还形成了由抗GhMYB7-GhMYSB7-DNA组成的超移位复合物(图7c)。这些数据进一步证实了蛋白质与DNA的相互作用是序列特异性的。
为了确定核心结合基序,如图S13所示,对50 bp片段进行顺序突变。EMSA分析显示,8 bp基序CAACCGAA为核心响应序列(图S13b)。当野生型8-bp基序CAACCGAA突变为AGGAATGG时,TAA实验中的启动子活性显著降低(图S13d),证实GhMYB7通过与8-bp基阵结合来激活GhCesA8-2启动子。为了检查核心序列中的所有核苷酸是否都是关键的,通过一次替换一个核苷酸来突变8-bp基序CAACCGAA,以生成八个突变序列(图7d)。因此,最后一个6-bp基序[(C/T/A)AAC(A/T/C/G)G]被鉴定为GhMYB7响应性顺式作用调控元件,随后被命名为FSMBE3。应注意,通过反式激活和EMSA分析鉴定的GhMYP7的上述三个不同结合位点与ChIP Seq结果一致(图S14a,b,C)
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 7
3.8 由GhTCP4、GhMYB7、GhFSN1和GhMYP46_D13组成的四层转录调控网络调节纤维SCW GhCesA基因
考虑到GhFSN1、GhMYB7和GhMYP46_D13在纤维次生细胞壁增厚阶段共表达,我们选择研究GhFSN1是否可以转录激活GhMYB7和GhMYB46_D13,类似于基于NAC-MYB的调控网络,控制拟南芥中SCW生物合成。因此,我们对烟草叶片细胞进行了瞬时双荧光素酶分析。我们的结果表明,GhFSN1不激活GhMYB7启动子(图S23);然而,GhMYB7激活了GhFSN1启动子(图S23)。
最近的一份报告显示,GhTCP4A也激活了GhFSN1启动子(Cao等,2020)。因此,我们考虑GhMYB7和GhTCP4之间是否存在调节关系。双荧光素酶分析结果表明,GhTCP4激活了GhMYP7启动子(图S23)。我们还发现GhMYB7参与并激活了GhMYP46_D13启动子(图S24),GhMYB46_D13也被GhFSN1激活(图S25)。
因此,我们提出了SCW GhCesA基因的四层转录调控网络(图10)。在该网络中,GhTCP4构成第一层,而GhMYB7位于第二层。因此,GhMYB7除了通过分别通过FSMBE1、FSMBE2和FSMBE3与相应启动子直接结合来激活GhCesA4-2、GhCesesA7-3和GhCea8-2外,还调节GhFSN1及其下游TF(GhMYP46_D13)。因此,GhTCP4、GhMYB7、GhFSN1和GhMYP46_D13以协调方式发挥作用,促进棉纤维中的纤维素生物合成,最终影响棉纤维SCW厚度和纤维长度。
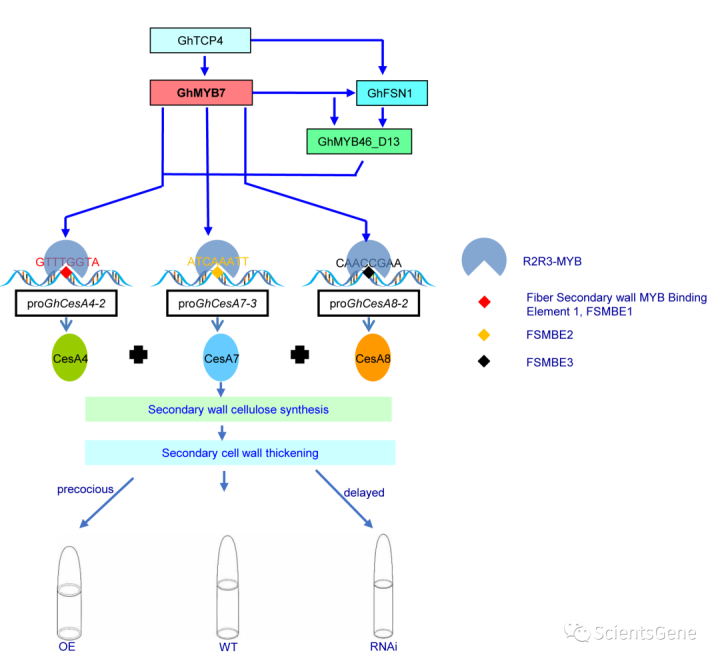
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 10
04
结论
这里,我们表明,棉花中GhMYB7的过度表达促进了SCW纤维素在纤维中的沉积,并导致纤维变短变厚。此外,我们证明,GhMYB7通过分别与GhCesA4、GhCea7和GhCeseA8启动子中的三种不同顺式元件直接结合,驱动SCW纤维素合成。我们的研究结果扩展了我们对纤维素合成调控的理解,并为棉纤维中纤维素合成的特定调控元件提供了新的见解。
05
获取原文
原文链接:
https://nph.onlinelibrary.wiley.com/doi/10.1111/nph.17612
PDF获取:
https://www.scientsgene.com/h-nd-113.html#_np=107_423
文末附件。
END
赛思基因www.scientsgene.com有限公司致力于开发转基因和基因编辑中的“硬核科技”,突破遗传转化中的基因型限制,辅助基因编辑育种。目前公司拥有国内数量最多的稳定遗传转化体系,包括但不限于油茶、花生、藜麦、大白菜、小白菜、辣椒、菜心、油菜、紫菜薹、樱桃萝卜、胡萝卜、甘蓝、抱子甘蓝、宝塔菜、紫/黄/绿花椰菜、青花菜、西瓜、南瓜、甜瓜、茄子、梨树、枣树、大豆、棉花等遗传转化体系。
赛思基因可为广大科研和育种工作者提供稳定的,非嵌合的,多品种的过表达、基因沉默株系和基因编辑突变体。期待与您的深入合作,共同推动中国种业的进步。