文章信息
题目:Group IIc WRKY transcription factors regulate cotton resistance to Fusarium oxysporum by promoting GhMKK2-mediated flavonoid biosynthesis
刊名:New Phytologist
作者:Lijun Wang,Chen Wang,Xingqi Guo et al.
单位:Shandong Agricultural University
日期:21 June 2022
01
摘要
WRKY 转录因子 (TFs) 是应对病原体感染的关键调节因子。Vasinfectum ( Fov ) 是棉花最具破坏性的病原体,然而,WRKY TFs 对尖孢镰刀菌的调控机制,目前尚不清楚。
在这里,转录组测序表明 IIc 组 WRKY TF 亚家族是响应Fov的最重要的 TF 亚家族。功能获得和功能丧失实验表明,IIc 组 WRKY TF 正向调节棉花对Fov的抗性。一系列染色质免疫沉淀测序、酵母单杂交试验和电泳迁移率变化试验表明,IIc 组的 WRKY TFs 直接与GhMKK2的启动子结合并调节其表达。
重要的是,鉴定了一种由 GhMKK2、GhNTF6 和 GhMYC2 组成的新型丝裂原活化蛋白激酶 (MAPK) 级联反应。功能分析表明,IIc 组 WRKY TFs 通过上调 GhMYC2 介导的几个类黄酮生物合成相关基因的表达,诱导 GhMKK2-GhNTF6 通路增加对Fov的抗性,从而导致类黄酮积累。
总之,我们的研究证明了一种新的疾病防御机制,WRKY-MAPK 通路通过该机制促进类黄酮生物合成以防御病原体感染。该途径提高了我们对植物免疫中 WRKY TF 和 MAPK 级联反应模式以及植物类黄酮在病原体防御中的重要作用的理解。
02
技术路线
1、cotton (G. hirsutum L. cv. Lumian 22)
2、four-week-old plants were infected with a Fov sporesuspension (106 conidia/ml) via the root wounding method
3、Library construction, transcriptome sequencing (RNA-seq) and data analysis
4、Gene cloning, bioinformatics analysis and genetic transformation
5、RNA extraction and real-time quantitative PCR (RT–qPCR) assays
6、Agrobacterium-mediated VIGS
7、ChIP-sequencing (ChIP-seq)
8、Yeast one-hybrid (Y1H) assays
9、Luciferase (LUC) reporter system assays
10、Yeast two-hybrid (Y2H) assays
11、Determination of the flavonoids content
03
主要结果
3.1 转录组分析确定IIc WRKY TFs是参与棉花对Fov抗性的最重要的TFs之一
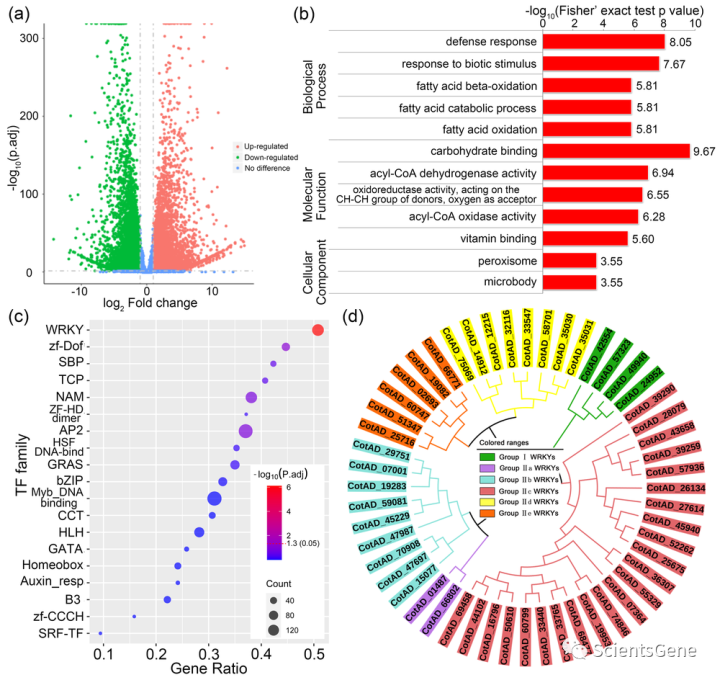
Fov是棉花种植中最具威胁性的病原体之一。进行转录组测序以鉴定Fov感染后棉花中差异表达的基因,并阐明棉花对Fov抗性的分子机制。结果显示52818个基因,其中7385个上调,8480个下调(表达变化>2倍,Padj<0.05)(图1a和表S3)。然后,对上调基因进行基于GO的富集分析(图1b和表S4)。对于生物过程,大多数上调基因被分配到防御反应(GO:0006952)和生物刺激反应(GO:0009607)(图1b)。在分子功能类别中,与碳水化合物(GO:0030246)和酰基辅酶A脱氢酶活性(GO:0003995)相关的基因最多(图1b)。在细胞成分类别中,上调基因主要富集于过氧化物酶体(GO:0005777)和微体(GO:0042579)(图1b)。
基于这些结果,Fov入侵诱导了棉花生物过程的各种显著变化。TFs是调节基因表达的主要基因,在植物对病原体的抗性中起着重要作用。对差异表达的TF进行聚类分析,以从我们的转录组数据中获得更多见解。结果表明,WRKY TF比其他TF更显著,52个WRKY tf上调(图1c和S1a,表S5)。进一步的分析表明,大多数上调的WRKY TF被分配到了组Ⅷc WRKY TF亚家族(图1d和S1b)。我们的转录组数据表明,第一类 WRKY TF是棉花对Fov抗性的最重要的TF。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 1
3.2 第一类WRKY TFs在棉花对Fov的抗性中起着关键作用
使用农杆菌介导的VIGS方法在棉花中沉默了12个Ⅰ组WRKY TF,以确认Ⅱc组WRKY TF在棉花抗Fov中的功能。在接种后三周,第一组c WRKY TFs的转录水平明显降低(图S2)。棉花植株和Ⅰc WRKY TF组沉默棉花植株的根部均受到损伤,随后用Fov孢子悬浮液(106分生孢子/ml)感染。Fov感染后第7天,尽管不同的Ⅰc WRKY TF沉默棉花植株表现出不同程度的易感性,但所有Ⅰc WRKY TF沉默棉花植株的叶片表现出比对照更明显的黄化迹象(图2a和S3a)。
此外,Ⅲc WRKY TF沉默棉花组的病原体疾病指数显著高于对照组(图2b和S3b,方法S1)。将一组Ⅰd WRKY TF GhWRKY21用作非功能对照,以排除实验系统的人为影响。如图S4所示,尽管GhWRKY21在接种后三周在棉花中被沉默,但GhWRK121沉默棉花的抗性与对照棉花没有明显差异。选择四个棉花组Ⅰc WRKY TF[CotAD_07364(NbOE07364-1/2)、CotAD_43658(NbOE43658-1/2)、CotAD_45940(NbO45940-1/2)和CotAD_ 50610(NbO-50610-1/2)],通过根癌杆菌介导的叶盘法导入本氏烟 ,以进一步探索棉花组Ⅱc WRKY TFs的功能(图S5)。对6周龄的T3转基因植物进行随后的功能分析。与对照相比,NbOE07364-1/2、NbOE43658-1/2、Nb OE45940-1/2和NbOE50610-1/2系对Fov的抗性显著增加,Fov感染后5天,病变面积明显更小,病原体疾病指数更低(图2c和d)。
此外,台盼蓝组织化学染色表明,Fov感染后,所有过表达(OE)系的叶片比Vec系的叶片染色更浅(图2c)。因此,棉花组Ⅷc WRKY TFs正向调节棉花对Fov的抗性。

编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 2
3.3 第一类c WRKY TFs与GhMKK2启动子中的W-box元件相互作用
通过其保守的WRKY结构域,WRKY TF识别并结合靶启动子的W-box序列。通过分析差异表达的WRKY TFs中WRKY结构域的结构,我们注意到同一亚科成员的WRKY结构域是保守的,但在不同的家族之间发现了显著的差异(图S6a)。
这一结果表明,第一类c WRKY TFs可能通过结合其启动子中的相同W盒来共同调节靶基因的表达。进行ChIP-seq分析以鉴定启动子中与棉花基团Ⅷc WRKY TFs结合的W-box元件。将瞬时表达四种Ⅰc组WRKY TFs(CotAD_07364、CotAD_16796、CotAD_45940、CotAD_68477)的棉花原生质体混合在一起进行ChIP序列分析。去除低质量数据后,鉴定出516个含有W-box顺式元件的启动子区(图S6b和表S6)。在Fov感染后从棉花中获得的转录组序列与ChIP-seq数据之间进行相关性分析,以筛选由组Ⅷc WRKY TFs调节的Fov诱导基因,结果显示52个基因(图S6c)。
ChIP seq鉴定的516个基因中的其他464个可能是对Fov感染没有反应的IIc WRKY TF结合基因。在预测这52个筛选基因的功能后,选择CotAD_23706进行进一步分析。从棉花中分离并克隆了CotAD_23706。全长CotAD_23706序列为1387 bp,包含187 bp的5’-非翻译区(UTR)、201 bp的3’-UTR和999 bp的开放阅读框(ORF),编码由332个氨基酸组成的蛋白质。序列分析表明,CotAD_23706是丝裂原激活蛋白激酶(MAPKK)家族的成员,与拟南芥中的AtMKK2高度同源,具有保守的激活基序(S/T-xxxxx-S/T,氨基酸192-198);因此,我们将其命名为GhMKK2(图S7a)。系统发育树分析还证明,与AtMKK2一样,GhMK2属于A组MAPKK家族(图S7b)。
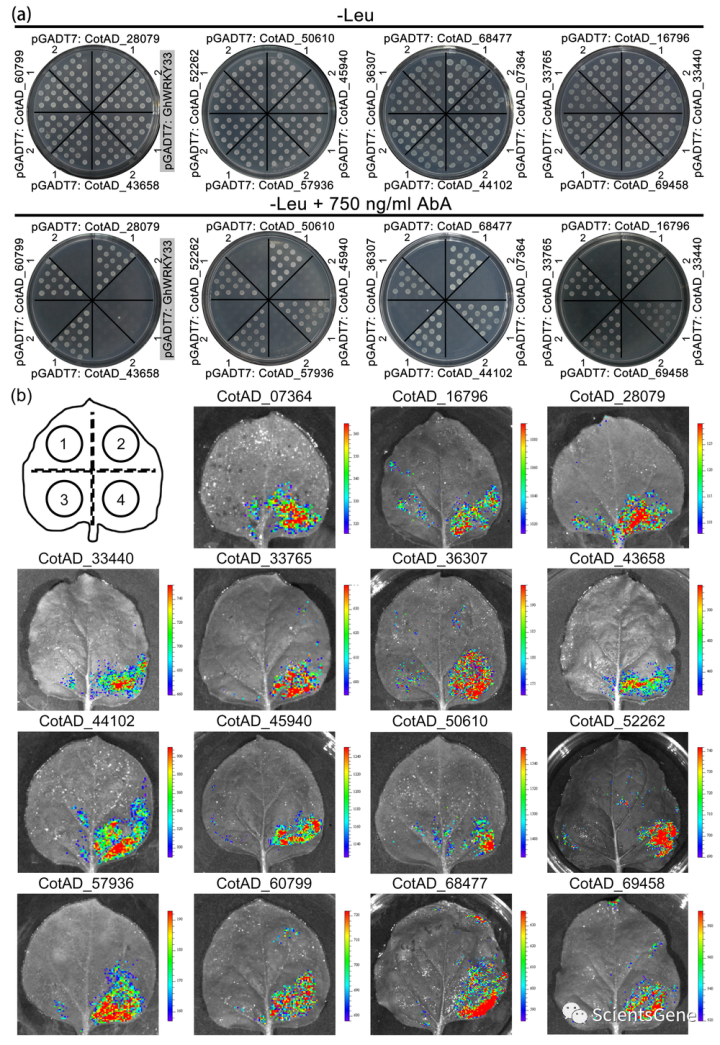
此外,克隆了GhMKK2转录起始位点上游的2311bp片段,并从-1508至-1503碱基序列中鉴定了W-box顺式元件(图S7c)。进行Y1H分析,以验证棉花Ⅰc WRKY TFs是否与GhMKK2启动子中的W-box元件结合。将棉花Ⅱc WRKY TFs插入pGADT7载体中。如图3a所示,只有阳性表达棉花组Ⅷc WRKY TFs的proGhMK2::pAbAi Y1H菌株能够在补充有750 ng/ml AbA的SD/–Leu培养基上生长(图3a)。将表达GhWRKY33的proGhMKK2::pAbAi Y1H菌株(acotton组ⅧWRKY TF)用作阴性对照(图3a)。使用具有突变W-box元件的proGhMKK2Mu::pAbAi Y1H菌株来阐明棉花Ⅰ族c WRKY TFs与GhMKK2启动子中的W-box元件之间的结合是否是特异性的。用棉花组Ⅷc WRKY TFs转化后,表达proGhMK2Mu::pAbAi的Y1H细胞在补充750 ng/ml AbA的SD/–Leu培养基上不能存活(图3a)。
为了进一步验证棉花基团Ⅷc WRKY TFs与GhMKK2启动子中的Wbox元件之间的直接相互作用,将LUC报告系统应用于烟叶。与proGhMKK2::LUC和35S::GhWRKYs共转化后,在烟草叶片中观察到显著的LUC活性(图3b)。此外,进行了电泳迁移率转移试验(EMSA)(方法S2),其结果表明,棉花组Ⅷc WRKY TF(CotAD_07364、CotAD_28079、CotAD_36307和CotAD_43658)与生物素探针相互作用,当冷探针与生物素探头竞争时,结合降低。同时,突变探针的添加不影响IIc WRKY组蛋白和生物素探针之间的结合,表明IIc WRKY组蛋白与GhMKK2启动子中的W-box之间的结合特异性(图S8)。综上所述,这些数据表明棉花基团Ⅷc WRKY TFs直接结合GhMKK2启动子中的W-box元件。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 3
3.4 GhMKK2正调控棉花对Fov的抗性
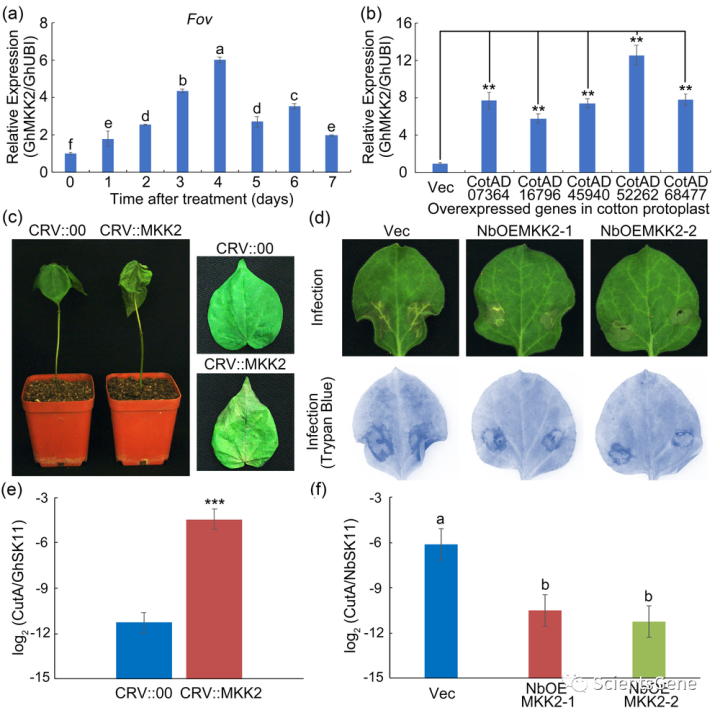
分析GhMKK2表达模式以阐明GhMKK2表达是否由Fov诱导。如图4a所示,Fov感染后,GhMKK2转录水平显著升高。然后,棉花Ⅰc WRKY TF在棉花原生质体中过表达,以进一步证实其对GhMKK2表达的影响。在Ⅰc WRKY TF过表达原生质体内检测到的GhMKK2转录物水平高于对照原生质(图4b)。
采用VIGS沉默棉花中的GhMKK2并确定其功能(图S9a)。Fov感染7天后,GhMKK2沉默(CRV::MKK)棉花比空载体对照(CRV::00)棉花受损更严重(图4c)。还测定了病原体疾病指数。如图4e所示,CRV::MKK2棉花的病原体疾病指数远高于CRV::00棉花。然后,产生过表达GhMKK2的转基因烟草(图S9b),并使用6周龄的T3转基因和空载植物进行进一步分析。GhMKK2的过表达显著提高了转基因烟草对Fov的抗性,在Fov感染后5天,转基因烟草叶片的病变面积和病原体疾病指数比Vec叶片小得多(图4d和f)。此外,台盼蓝染色显示,Fov感染后,转基因烟草叶片中积累的蓝色染色比Vec叶片中的更少(图4d)。这些结果表明,GhMKK2在棉花抗Fov中起着重要作用。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 4
3.5 GhMKK2调节病原体诱导的类黄酮生物合成
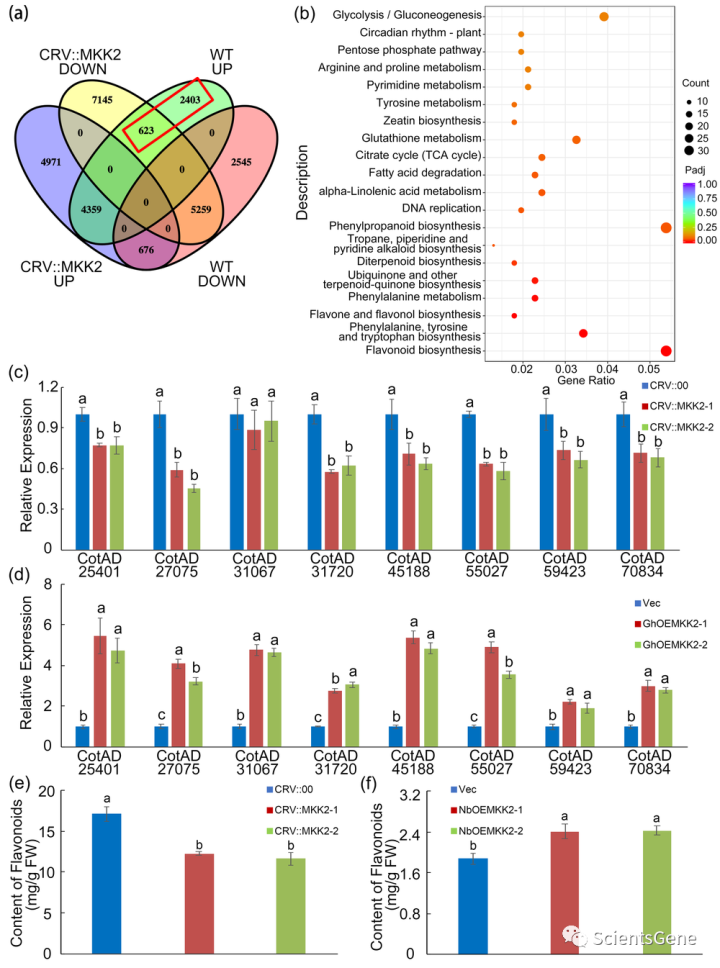
对有或无Fov感染的GhMKK2沉默棉花进行转录组测序,以阐明GhMKK2调节棉花对Fov抗性的机制。Fov感染后,GhMKK2沉默棉花中23033个基因的转录发生了显著变化,10006个基因转录增加,13027个基因转录减少(表达变化>2倍,Padj<0.05)(表S7)。然后,对野生型(WT)棉花和GhMKK2沉默棉花之间的转录组数据进行补充分析,无论是否感染Fov。在WT棉花中,其表达因Fov感染而增加,但在GhMKK2沉默棉花中表达减少或未检测到的基因被认为是Fov诱导的GhMKK2调节基因。并且筛选了3026个基因(Fov感染后GhMKK2沉默棉花中623个下调基因和2403个未检测基因)(图5a和表S8)。KEGG富集分析用于确定这些筛选基因调控的关键生物学过程。 结果表明,3026 Fov诱导的GhMKK2调节基因在多个途径中富集,类黄酮生物合成途径(KEGG ID:ath00941)是最显著富集的途径(富集了33个相关基因)(图5b和表S9)。使用RT–qPCR确认了8个基因(从33个类黄酮生物合成相关基因中随机选择)的转录水平。如图5c所示,Fov感染后,GhMKK2沉默棉花中所选基因(CotAD_31067除外)的表达明显降低。
然后,在过表达GhMKK2的棉花原生质体中测量这些基因的表达水平,所有选择的基因均上调(图5d)。还测量了GhMKK2沉默棉花或GhMKK2过表达烟草中的类黄酮含量。Fov感染后,GhMKK2沉默棉花中的类黄酮含量显著降低,但在GhMKK2过表达烟草中增加(图5e和f)。
在棉花原生质体中分别过表达四个Ⅰc组WRKY TF(CotAD_07364、CotAD_52262、CotAD_45940和CotAD_ 50610),以确定II组WRKY-TF是否影响棉花中类黄酮生物合成。所选类黄酮生物合成相关基因的表达增加(图S10a)。
此外,Fov感染后,NbOE07364-1/2、NbOE43658-1/2、Nb OE45940-1/2和NbOE50610-1/2烟草品系中的类黄酮含量高于空载体品系(图S10b)。为了进一步确认IIc组WRKY TF介导的类黄酮生物合成是否需要GhMKK2级联,进一步分析了Fov感染后GhMKK2沉默棉花的RNAseq数据。尽管在Fov感染的GhMKK2沉默棉花中也诱导了大多数Fov诱导的IIc组WRKY TFs(23个中的19个)的表达(表S8),但在Fov病毒感染后,33个类黄酮生物合成相关基因的转录水平未被检测到(33个中的3个)或下调(33个中的30个)(表S7)。
基于这些结果,第一类c WRKY TFs通过促进GhMKK2介导的类黄酮生物合成来调节棉花对Fov的抗性。在棉花中沉默了Fov感染后诱导表达的两个类黄酮生物合成相关基因(CotAD_59423和CotAD_ 69868),以进一步证实类黄酮的积累有助于Fov抗性(图S11a和d)。CotAD_59423和CotAD_ 69868分别编码查尔酮异构酶(CHI)和查尔酮合成酶(CHS),这两种已知参与类黄酮生物合成的关键酶。沉默棉花中的两个基因会降低黄酮类化合物含量(图S11c和f),并造成比对照棉花更严重的损害(图S12b和e)。因此,黄酮类化合物的积累有助于棉花对Fov的抗性。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 5
3.6 GhMKK2与GhNTF6相互作用
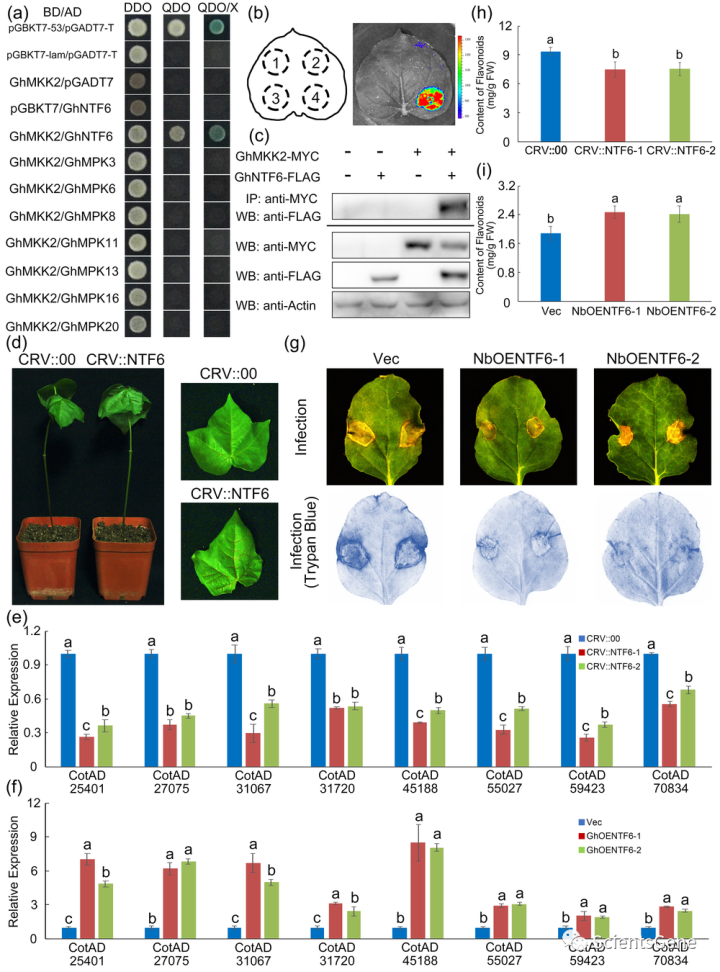
进行Y2H测定,以鉴定棉花MAPK中MKK2介导的MAPK级联的下游成分,包括GhMPK3(CotAD_09571)、GhMPK16(CotAD_14537)、Gh MPK8(CotAD_33928)、GhMPK11(CotAD _56362)、GgMPK13(Cot AD_01707)、GhMPK16(Cot ad_11508)、GmMPK20(CotAD _66205)和GhNTF6(Cot AD _09564)。
当GhMKK2与GhNTF6共转化但不与其他GhMAPK共转化时,Y2HGold菌株在DDO、QDO和QDO/X培养基上生长,表明GhNTF 6与GhMKK2相互作用(图6a)。进行LCI分析以进一步观察它们的相互作用,结果表明,当只有GhNTF6 NLuc和GhMKK2 CLuc共转化时,检测到LUC活性(图6b)。进行共免疫沉淀(Co-IP)测定(方法S3),结果还表明GhMKK2 MYC与GhNTF6 FLAG共免疫沉淀。总之,GhMKK2在体内和体外与GhNTF6相互作用。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 6
3.7 GhNTF6通过调节类黄酮生物合成正向调节棉花对Fov的抗性
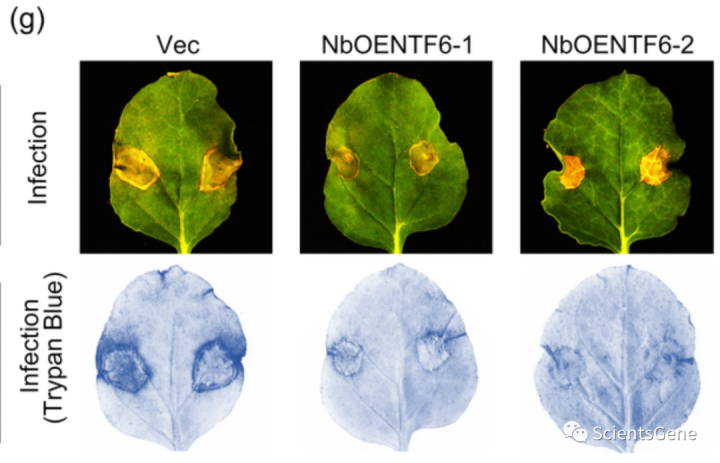
生成GhNTF6沉默的棉花和GhNTF 6过表达的烟草用于功能测定,以最终确定GhNTF6是否通过类黄酮生物合成的调节参与Fov抗性(图S12)。如图6d所示,与GhMKK2沉默棉花相似,GhNTF6沉默棉花在Fov感染后表现出更严重的损伤。然而,与对照植物相比,在Fov感染后五天,过表达GhNTF6的烟草植物的叶片显示出更小的损伤面积(图6g)。
此外,使用台盼蓝染色法,在Fov感染后,在过表达GhNTF6的烟草叶中观察到比在空载体叶中更低的蓝色染色水平(图6g)。更重要的是,如图6e和f所示,类黄酮生物合成相关基因的表达在Fovin感染的GhNTF6沉默的棉花中下调,但在GhNTF 6过表达的棉花原生质体中上调。
此外,Fov感染后,GhNTF6沉默棉花中的类黄酮含量显著降低,但在GhNTF 6过表达烟草中增加(图6h和i)。这些结果表明,与GhMKK2类似,GhNTF6通过积极调节类黄酮生物合成,作为棉花防御Fov的积极调节因子。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 6
3.8 GhNTF6通过GhMYC2介导的途径调节类黄酮生物合成
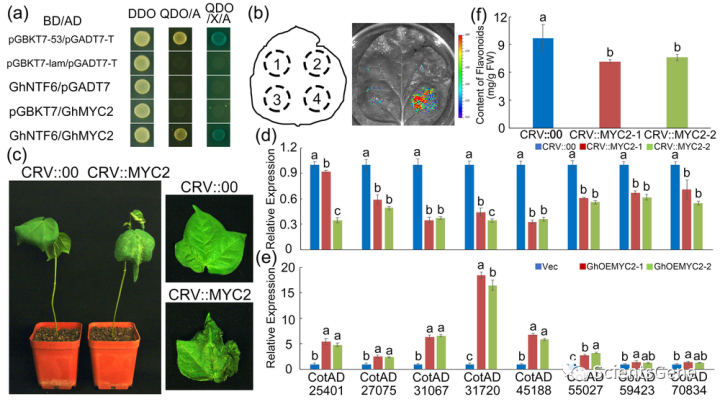
使用GhNTF6作为诱饵,通过Y2H筛选筛选棉花cDNA文库,以进一步阐明GhMKK2-GhNTF 6级联反应Fov的机制,随后通过测序确认了61个阳性克隆。除去空克隆和重复克隆后,有效克隆对应于16个候选蛋白。在拟南芥中,据报道,AtMYC2(AT1G32640.1)是类黄酮生物合成的正调控因子,但其分子机制尚不清楚。
根据序列比对和功能预测,CotAD_32778可能是AtMYC2的同源基因。CotAD_32778的ORF由1650 bp组成,编码549个氨基酸残基。数据库搜索和生物信息学分析表明,CotAD_32778与拟南芥中的AtMYC2具有高度序列相似性,并且使用序列分析在其氨基酸序列中鉴定了一个保守的bHLH结构域(图S13);Y2H测定的结果验证了GhNTF6和GhMYC2之间的相互作用(图7a)。还对烟叶进行LCI测定以进一步确认。在GhNTF6-NLuc和GhMYC2-Cluc共转化区观察到强烈的LUC活性(图7b)。
获得GhMYC2沉默棉花用于功能分析(图S14)。感染Fov七天后,GhMYC2沉默棉花表现出比CRV::00棉花更严重的损害(图7c)。然后,测定了GhMYC2沉默棉花中类黄酮生物合成相关基因的表达和类黄酮的积累。过表达GhMYC2的棉花原生质体也用于测定类黄酮生物合成相关基因的表达水平。如图7d和e所示,Fov感染后,GhMYC2沉默的棉花中类黄酮生物合成相关基因的表达显著降低,但在GhMYC2过表达的棉花原生质体中增加。此外,Fov感染的GhMYC2沉默棉花中的类黄酮含量显著降低(图7f)。这些结果表明,GhMYC2可能是Fov感染反应期间MAPK级联和类黄酮生物合成之间的“桥梁”。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 7
04
结论
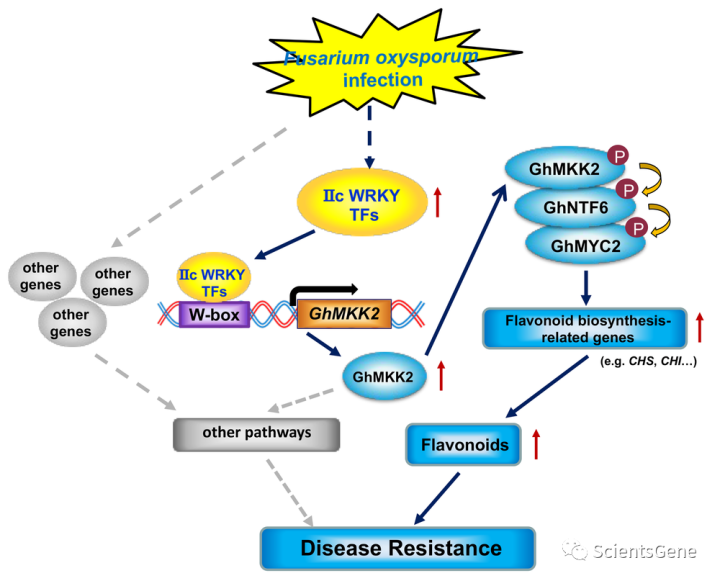
总之,我们的研究揭示了一种新的疾病防御机制,其中WRKY-MAPK途径促进GhMYC2介导的类黄酮生物合成,以防御病原体感染(图8)。这一途径提高了我们对WRKY TFs和MAPK级联在植物免疫中的相互作用以及植物类黄酮在病原体防御中的重要作用的理解。
编辑切换为居中
添加图片注释,不超过 140 字(可选)
Fig. 8

添加图片注释,不超过 140 字(可选)
05
获取原文
原文链接:
https://nph.onlinelibrary.wiley.com/doi/10.1111/nph.18329
PDF获取:
https://www.scientsgene.com/h-nd-118.html#_np=107_423
文末附件。
END
赛思基因科技www.scientsgene.com致力于开发转基因和基因编辑中的“硬核科技”,突破遗传转化中的基因型限制,辅助基因编辑育种。目前公司拥有国内数量最多的稳定遗传转化体系,包括但不限于油茶、花生、藜麦、大白菜、小白菜、辣椒、菜心、油菜、紫菜薹、樱桃萝卜、胡萝卜、甘蓝、抱子甘蓝、宝塔菜、紫/黄/绿花椰菜、青花菜、西瓜、南瓜、甜瓜、茄子、梨树、枣树、大豆、棉花等遗传转化体系。
可为广大科研和育种工作者提供稳定的,非嵌合的,多品种的过表达、基因沉默株系和基因编辑突变体。期待与您的深入合作,共同推动中国种业的进步。


![[附源码]计算机毕业设计springboot基于VUE的网上订餐系统](https://img-blog.csdnimg.cn/094d730cd08449afb27184fbf14e6abe.png)