一、引言
钴金属氧化物作为一类典型的储能材料,既可以用于锂离子电池负极材料,又可以用于超级电容器电极材料,因而备受关注 。在作为锂离子电池负极材料时,具有较高的理论比容量,但充放电体积变化较大、材料导电性较差;在作为超级电容器电极材料时,虽然理论比电容较高,但电阻偏大、成本较高,因而制约了其发展。
通过引入活泼且相对廉价的金属元素,如镍、锌、锰、铜、铁、镁等,与钴、氧组成新的双金属氧化物,是一个非常有价值的研究方向。在继承单一钴金属氧化物的高比容量、高比电容优点的同时,改性元素的引入又提高了材料的结构稳定性、导电性等,使其倍率性能、循环稳定性等得到同步提高。通过材料纳米化、特殊形貌构筑、复合化等手段,对该钴基双金属氧化物进行改性,研究其微观结构与电化学性能、反应机理之间的关系,能够有助于推动钴基双金属氧化物材料的实际应用。
二、钴基双金属氧化物的研究进展
钴基双金属氧化物是一类具备尖晶石结构的氧化物材料,是一类特殊的离子晶体,结构通式为ACo2O4,其中A为二价金属离子,如Mg2+,Zn2+,Fe2+,Ni2+,Mn2+,Co2+,Cd2+等。结构中 O2–作立方密堆积,其中 Co3+离子则填充在在八面体中心,A2+离子填充在四面体中心,即 Co3+离子则为 6 配位,而A2+离子为 4 配位。近年来,在锂离子电池和超级电容器领域内,具有尖晶石结构的钴基双金属氧化物引起了电极材料研究领域的广泛关注。下文就几种常见的钴基双金属氧化物材料(如图1所示),对其做一简单的论述。
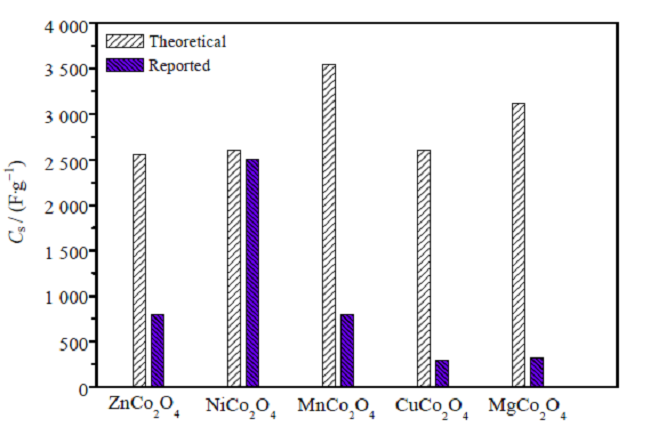
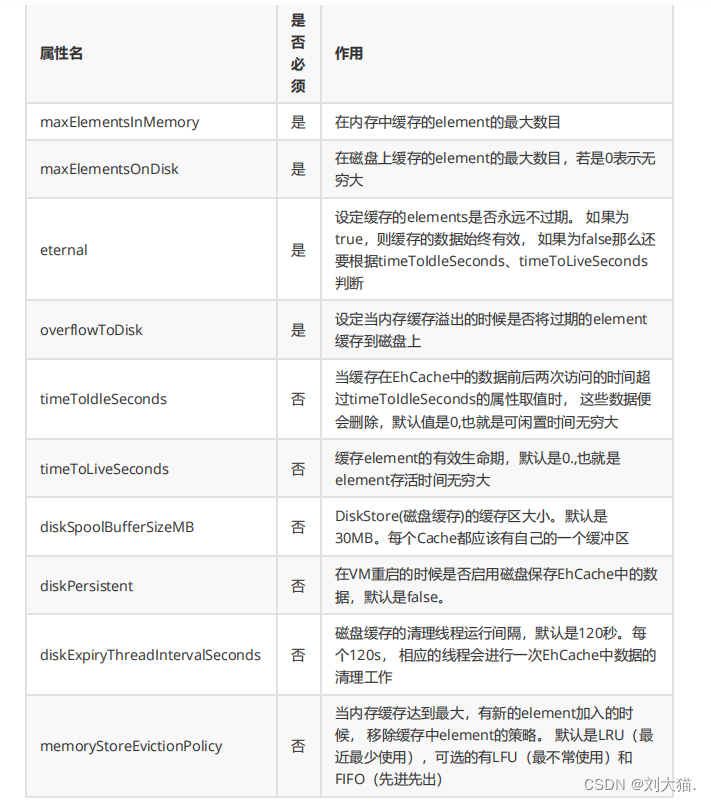
图1 各种钴基金属氧化物比电容值的比较
1. 钴酸镍(NiCo2O4)
镍与钴的性质相似,且都具有赝电容性质,故钴、镍双金属氧化物的制备相对较简单,易形成单一纯相。目前制备NiCo2O4常用方法是溶剂热法和水热法,其他方法包括溶胶凝胶法、液相沉淀法、模板法、静电纺丝法等。制备的NiCo2O4微观结构各异,包括纳米线、纳米棒、纳米片、海胆状、微球、三维花状、多孔网状、珊瑚状等。NiCo2O4不仅具有了Co3O4的高度稳定性能和高倍率性能,而且又拥有NiO的高比电容性,因而主要用作超级电容器电极材料,在锂离子电池领域研究相对较少。Lu等利用硬模板法合成得到了一种新型的NiCo2O4电极材料(具有高度有序介孔结构),经过低温煅烧等步骤控制材料的结晶度,在170℃下获得的电极材料在28.6 A·g-1的电流密度条件下,表现出高达612 F·g-1的比电容值。Yuan等把制备的超薄NiCo2O4纳米片(2~5 nm)固定到镍箔上。在20 A·g-1条件下,其比电容高达1450 F·g-1(如图2)。An等利用溶剂热法成功合成了三维的花状钴酸镍多级结构,这种花状多级结构是由外围众多的纳米片围绕一个中心聚集而得到,直径约为500 nm。该花状多级结构纳米材料具有多孔结构,而且它的比表面积高达212.6 m2·g–1,在电流密度分别为 1,10 A·g–1时各自具有1191.2,755.2 F·g–1的比电容,展现出了良好的倍率性能及稳定性能。
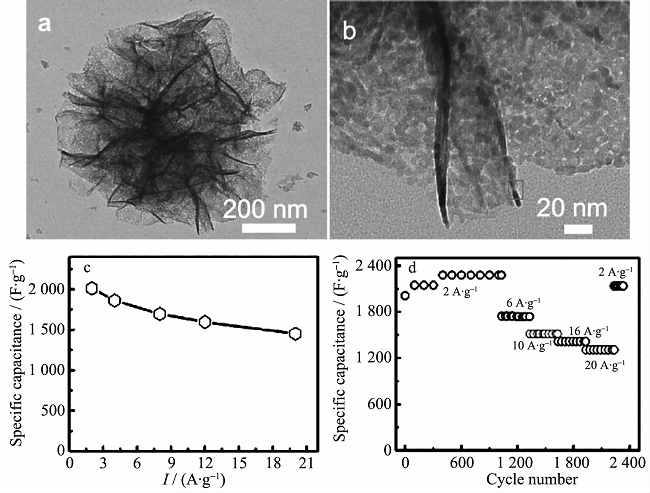
图2 (a, b) NiCo2O4的SEM图片; (c, d) NiCo2O4的电化学性能曲线。
同时,NiCo2O4也可用作锂离子电池负极材料。Li等通过溶剂热法合成了单分散NiCo2O4介孔微球(直径2~3 μm,平均孔径14.5 nm)。在0.2 A·g-1条件下,30次循环后,放电比容量仍高达1198 mAh·g-1;在大电流0.8 A·g-1条件下,500次循环后,可逆比容量仍维持在705 mAh·g-1。Chen 等通过模板法定向生长了NiCo2O4纳米线阵列 (长2.0 μm,直径50~80 nm)。在100 mA·g-1条件下,首次放电比容量为2025 mAh·g-1,但容量保持率一般。
2. 钴酸锌(ZnCo2O4)
钴酸锌结构稳定,物理性能丰富,是一种典型的三元尖晶石结构的氧化物。在锂离子电池材料方面,其表现出了优异的电化学性质:可逆能力、循环稳定性以及绿色清洁等,主要用作锂离子电池负极材料,在超级电容器中的研究较少。
目前,ZnCo2O4的常用制备方法仍然是水热法、溶剂热法及热分解法,其他方法包括模板法、静电纺丝法等。ZnCo2O4的微观结构主要为常规的棒状、片状、球状及阵列。ZnCo2O4的电化学性能 (特别是倍率性能) 要明显优于单一的Co3O4与CoO,但其比容量要略低于NiCo2O4。Liu等通过水热法合成ZnCo2O4纳米棒(直径 15~22 nm,长度 150~200 nm)。在0.2 mA·cm-2条件下,初始放电比容量为1509 mAh·g-1,50次循环后,容量为767 mAh·g-1;且EIS数据表明其具有较低的表层电阻(约为192 Ω)。Du等通过常温液相沉淀及热分解法制备了多孔棒状ZnCo2O4 (长几微米,直径100~300 nm),并发现煅烧温度影响其电化学性能。在100 mA·g-1条件下,500 ℃煅烧所得材料的电化学性能更好,其首次放电比容量高达1331.5 mAh·g-1,如图3所示。Zhu等采用微波法合成了二维超薄ZnCo2O4纳米层状物(比表面积高达181m2·g-1)。在200 mA·g-1条件下,200次循环后,可逆比容量仍保持约为960 mAh·g-1。
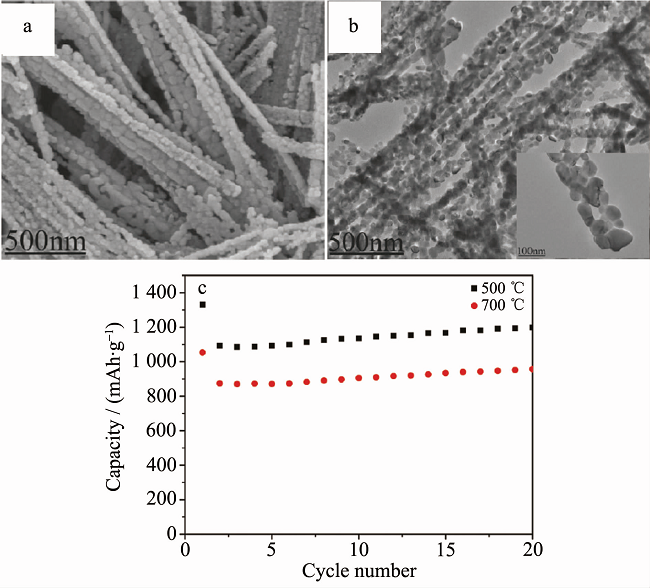
图3 (a, b) ZnCo2O4的SEM图与TEM图; (c) ZnCo2O4的电化学性能曲线。
ZnCo2O4在超级电容器领域应用如下:Huang等通过水热法制备了棒状ZnCo2O4颗粒(27 nm)。其在1 A·g-1条件下,比电容为604.5 F·g-1,3000次循环后,比电容保持率为95.6%。Bao等通过模板法在Ni箔上均匀生长了介孔ZnCo2O4纳米片阵列。其在30 A·g-1条件下,比电容为1850 F·g-1,1500次循环后,比电容保持率为96.3%。
3. 钴酸锰(MnCo2O4)
锰的价态较多,加入锰元素形成钴、锰二元氧化物,易产生原子空位、占位等结构,可促进锂离子的迁移,提升电化学性能,因而多用于锂离子电池电极材料。Huang等通过水热法合成了具有核壳结构与浓度梯度的MnCo2O4微米椭球(长轴2.5~4.5 μm,短轴1.5~2.5 μm;外壳层厚度,200~300 nm;外壳层钴含量要高于内核)。 在0.1和0.4 A·g-1条件下,首次放电比容量分别为1433.3和1248.4 mAh·g-1;60次循环后,可逆比容量分别维持在900和620 mAh·g-1。Liu等通过水热法制备了纳米尺寸的MnCo2O4 (10~20 nm),XPS表征结果显示Mn和Co的化合价分别是+4和+2。在0.2 mA·cm-2条件下,首次放电比容量达到1448 mAh·g-1。Li等通过热分解法制备了类似的中空结构MnCo2O4亚微米球(直径250 nm)。通过控制升温速率,分别得到了介孔球、中空球、蛋黄-壳球、双壳球、多层壳球等。在0.4 A·g-1条件下,首次放电比容量最高能达到1425 mAh·g-1;100 次循环后,可逆比容量最大为850 mAh·g-1(如图 4所示)。
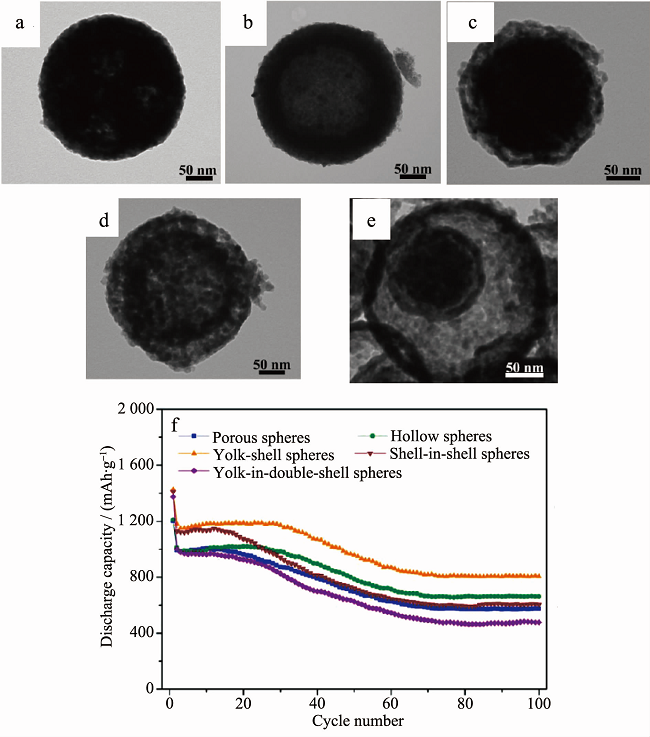
图4 (a-e) MnCo2O4的SEM图; (f) MnCo2O4的电化学性能曲线。
在超级电容器领域内,部分科研人员也对MnCo2O4作了一系列的研究。如Venkatach-alam等采用水热法合成MnCo2O4纳米线。在0.5 A·g-1条件下,其首次比电容为718.8 F·g-1;在2 A·g-1条件下,1000次循环后,比电容为500 F·g-1。Sahoo等采用模板法合成MnCo2O4纳米片阵列(厚度10~40 nm,长度1~2 μm)。在0.25 A·g-1 条件下,其首次比电容为250 F·g-1,1000次循环后,比电容无衰减。
相对于NiCo2O4与ZnCo2O4,MnCo2O4的研究较少,这可能是由于锰元素的价态较多,易产生Mn2O3、MnO2等杂质,纯相的MnCo2O4较难合成。其合成方法主要为水热法、溶剂热法与热分解法等;结构为常见的球形,其他特殊形貌较少;且主要应用在锂离子电池领域,超级电容器研究较少。从图1可知,MnCo2O4的理论比电容最大,但是实验报道最大比电容材料是NiCo2O4。可见材料的制备工艺以及其生长的结晶形态对比电容影响很大,如何能开发合理的制备工艺及方法也是开发高比电容电极材料的重要研究内容。
4. 其它钴基双金属氧化物(MCo2O4)
除了常见的Ni、Zn、Mn与Co形成双金属氧化物,还有Fe、Mg、Cu等金属也能与Co形成双金属氧化物。Sharma等通过尿素燃和草酸分解的方法合成了FeCo2O4和MgCo2O4。在60 mA·g-1条件下,FeCo2O4的首次比容量为 827 m Ah·g-1,MgCo2O4的首次比容量为 736 mAh·g-1;50次循环后,FeCo2O4的容量保持率约90%,而MgCo2O4的容量保持率较差;该结果表明Fe作为复合元素要比Mg的效果更好。Pendashteh等采用模板法合成了多孔CuCo2O4纳米线阵列。 在2 A·g-1 条件下,其首次比电容约为3000 F·g-1,接近理论值。Chen等采用模板法合成了类似的CuCo2O4纳米线阵列。在1.7 A·g-1条件下,其首次比电容约为611 F·g-1,8000次循环后,其比电容保持率为94.8%。
MCo2O4的研究要远远少用NiCo2O4、ZnCo2O4与MnCo2O4。其合成方法主要为热分解法与模板法等,微观结构的设计构筑较少,在电化学储能领域的应用才刚刚起步。
三、钴基双金属氧化物复合材料的研究进展
在钴基双金属氧化物的基础上,通过复合改性可进一步提高其电化学性能。He等通过水热法将 NiCo2O4纳米线负载在还原氧化石墨烯 (Reduced Graphene Oxide, RGO)上得到了NiCo2O4@RGO复合材料。在1 A·g-1的条件下,比电容高达737 F·g-1;在4 A·g-1的条件下,3000次循环后,比电容损失仅为6%。Zhou等通过类似模板法在镍箔上制备了三维结构NiCo2O4/石墨烯复合材料。在6和200 A·g-1的条件下,首次比电容分别为2173和954 F·g-1;在100A·g-1条件下,14000次循环后,比电容保持率为94% 。Zhai等采用水热法制备了NiCo2O4/MnCo2O4亚微米球(直径约1 μm)。在1 A· g-1条件下,600次循环后,可逆比容量为 1009 mAh·g-1;在5 A·g-1条件下,首次比电容为911.3 F·g-1,1000次循环后,比电容为800 F·g-1。
Chen等通过模板法在镍箔上生长形成了NiCo2O4/石墨烯纳米片阵列。在100 mA·g-1条件下,首次放电比容量为 1216 mAh·g-1,80次循环后,可逆比容量仍大于800 mAh·g-1(如图5所示)。Peng等通过模板法制备了NiCo2O4/C纳米阵列 (长2.5 μm,直径10~30nm)。 在 2 A·g-1条件下,首次放电比容量为664 mAh·g-1;在100 mA·g-1条件下,200次循环后,比容量保持率为97%。
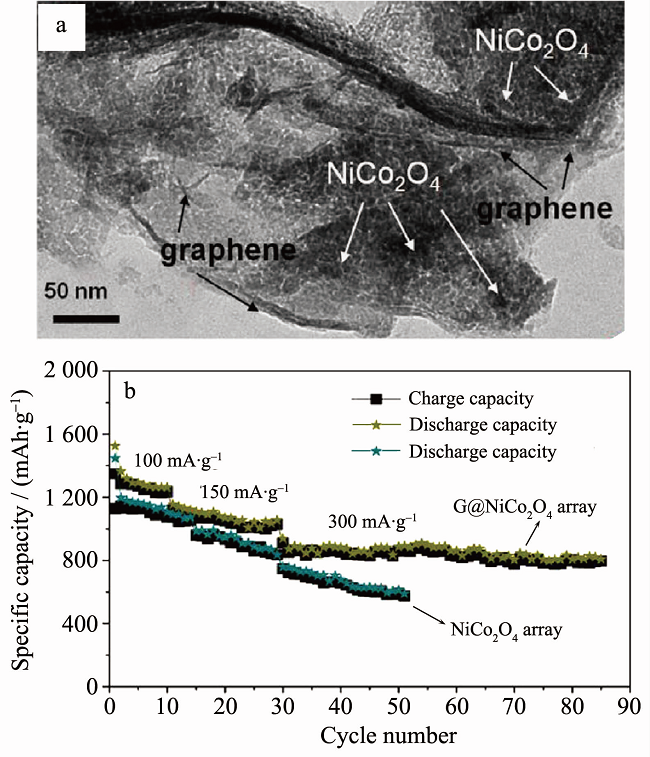
图5 (a) NiCo2O4/石墨烯的TEM图; (b) NiCo2O4/石墨烯的电化学性能曲线。
钴基双金属氧化物主要通过与石墨烯、碳纳米管、碳等炭素类材料复合。 碳素类材料不仅可以弥补金属氧化物性导电差的缺陷, 也可以缓冲双金属氧化物充放电过程中的体积变化,增大双金属氧化物材料的循环稳定性能和倍率性能;同时,碳素类材料自身可贡献一定的比电容或比容量。
四、总结与展望
当前的钴基双金属氧化物主要围绕着 “制备方法-微观结构控制-电化学性能-机理分析”这一路线展开。NiCo2O4、ZnCo2O4、MnCo2O4等钴基双金属氧化物的电化学性能 (尤其是倍率性能及循环寿命) 在一定程度上要优于单一钴金属氧化物(Co3O4、CoO等),起到了改性的作用;通过与碳素类、金属及其他金属氧化物复合,能进一步提高其电化学性能。鉴于钴基双金属氧化物的诸多优点,其在锂离子电池、超级电容器、新型钠离子电池等能源存储设备领域有较大的应用潜力和优势。为了充分发挥钴基金属氧化物作为电极材料的优异性能,还需要通过实验研究不断完善相关理论并研发出更合理的合成工艺。
相关文献:
[1] 黄国勇, 徐盛明, 杨越等. 钴基双金属氧化物的制备及其在电化学储能领域的应用[J]. 无机化学学报, 2016, 32(10): 1693-1703.
[2] 许家胜, 宋忠笑, 张杰等. 尖晶石结构的钴基金属氧化物超级电容器电极材料的研究进展[J]. 电子元件与材料, 2016, 35(3):1-6.
[3] Lu Q, Chen Y, Li W, et al. J. Mater. Chem. A, 2013, 6(1): 2331-2336.
[4]Yuan C Z, Li J Y, Hou L R, et al. Adv. Funct. Mater., 2012, 22:4592-4597.
[5] An C, Wang Y, Huang Y, et al. Crystengcomm., 2014, 16(3): 385-392.
[6]Li J F, Xiong S L, Liu Y R, et al. ACS Appl. Mater. Interfaces, 2013,5:981-988
[7]Chen G H, Yang J, Tang J J, et al. RSC Adv., 2015,5:23067-23072
[8]Liu H W, Liu J. Electrochim. Acta, 2013,92:371-375
[9]Du N, Xu Y F, Zhang H, et al. Inorg. Chem., 2011,50:3320-3324
[10]Zhu Y Q, Cao C B, Zhang J T, et al. J. Mater. Chem. A, 2015,3:9556-9564
[11]Huang T F, Zhao C H, Zheng R J, et al. Ionics, 2015,21: 3109-3115
[12]Bao F X, Wang X F, Zhao X D, et al. RSC Adv., 2014,4: 2393-2397
[13]Huang G Y, Xu S M, Xu Z H, et al. ACS Appl. Mater. Interfaces, 2014,6:21325-21334
[14]Liu H W, Wang J. J. Electron. Mater., 2012,41:3107-3110
[15]Li J F, Wang J Z, Liang X, et al. ACS Appl. Mater. Interfaces, 2014,6:24-30
[16]Venkatachalama V, Alsalme A, Alghamdi A, et al. J. Electroanal. Chem., 2015,756:94-100
[17]Sahoo S, Naik K K, Rout C S. Nanotechnology, 2015,26: 455401-455409
[18]Sharma Y, Sharma N, Rao S G V, et al. Solid State Ionics, 2008,179:587-597
[19]Pendashteh A, Moosavifard S E, Rahmanifar S M, et al. Chem. Mater., 2015,27:3919-3926
[20]Chen H Y, Chen X H, Zeng Y, et al. RSC Adv., 2015,5:70494-70497
[21]He G Y, Wang L, Chen H Q, et al. Mater. Lett., 2013,98:164-167
[22]Zhou J, Huang Y, Cao X H, et al. Nanoscale, 2015,7:7035-7039
[23]Zhai Y J, Mao H Z, Liu P, et al. J. Mater. Chem. A, 2015,3:16142-16149
[24]Chen Y J, Zhu J, Qu B H, et al. Nano Energy, 2014,3:88-94
[25]Peng L, Zhang H J, Bai Y J, et al. J. Mater. Chem. A, 2015, 3:22094-22101
科学指南针通过互联网技术建立更可靠的服务标准,全国26个办事处,12个城市拥有自营实验室,最好的设备、最专业的老师为您服务。
免责声明:部分文章整合自网络,因内容庞杂无法联系到全部作者,如有侵权,请联系删除,我们会在第一时间予以答复,万分感谢。
更多科研资讯干货,可点击下面链接获取哦~
电化学工作站