良好的觉醒与睡眠是幸福生活和高效工作的前提。然而,随着现代社会生活节奏的加快,觉醒睡眠障碍,特别是失眠,已成为不容忽视的健康问题。据中国睡眠研究会发布的《2022中国国民健康睡眠白皮书》显示,约3/4人群曾存在觉醒睡眠问题,其中失眠人群占23.5%。生活事件所引起的压力性应激是失眠发生的主要原因。作为重要的社会压力性事件,新冠疫情加重了公众的睡眠问题,失眠发生率从25.4%增加到32.2%。因此,解析失眠发生的神经机制,不仅有助于拓展对觉醒睡眠调控的认识,而且可以为失眠等觉醒睡眠障碍诊疗提供新的思路。
2022年12月14日,陆军军医大学任栓成/胡志安团队、高东团队以及重庆医科大学唐玲团队合作在Cell 子刊Cell Reports在线发表了题为 A paraventricular thalamus to central amygdala neural circuit modulates acute stress-induced heightened wakefulness 的研究论文,发现丘脑室旁核(PVT)→中央杏仁核(CeA)神经环路调控急性压力性应激所致的觉醒增加/失眠。

该课题组在前期的研究工作中发现PVT是丘脑内的重要觉醒核团,其活动受外侧下丘脑hypocretin神经元调控,并且通过投射至伏隔核发挥促进生理觉醒的作用【1】。此外,PVT还是大脑内感受压力性信号的关键结构,通过影响杏仁核神经元活动介导恐惧、逃避等压力适应性行为【2-4】。作为PVT的主要投射靶区,杏仁核也被证明调控觉醒/睡眠这一压力敏感性行为【5】。然而,目前尚不清楚PVT→CeA神经环路是否参与调控生理觉醒并介导急性压力性应激所致的失眠。
研究团队首先采用c-Fos染色和光纤钙活动记录观察应激刺激对CeA投射-PVT神经元活动的影响。换笼、急性束缚和捕食者气味等应激刺激能显著激活CeA投射-PVT神经元,表现为c-Fos表达增加和钙信号升高。光纤钙活动记录还表明,在正常的觉醒/睡眠周期中,CeA投射-PVT神经元活动在觉醒向睡眠转换过程中降低,而在睡眠向觉醒转换过程中升高,为觉醒活跃神经元。PVT→CeA神经环路是否参与生理条件下的觉醒调控呢?在小鼠进入稳定的睡眠后,光遗传激活PVT→CeA环路诱发睡眠向觉醒的转换、觉醒潜伏期缩短、觉醒概率增加。相反,采用化学遗传学方法抑制该环路可明显降低觉醒时间、增加睡眠时间。神经元活动记录和操控结果表明,PVT→CeA神经环路在生理条件下具有促进觉醒的作用。
研究者利用换笼、急性束缚和捕食者气味等诱发的急性压力性应激模型,发现小鼠表现出血浆皮质酮浓度升高、理毛时间增加等行为学改变。同时,急性应激可引起小鼠出现急性失眠的表现,如入睡潜伏期延长、觉醒时间增加等。为明确PVT→CeA神经环路在压力性失眠中的作用,研究团队在小鼠经历应激刺激的同时,采用化学遗传学方法抑制CeA投射-PVT神经元。虽然小鼠仍然处于应激环境中,但抑制PVT→CeA神经环路可明显缓解小鼠的行为学变化,降低应激引起的皮质酮浓度升高和理毛、直立时间增加。更为重要的是,抑制PVT→CeA神经环路显著改善应激导致的失眠样表现,明显降低急性应激诱发的觉醒增加,缩短小鼠入睡潜伏期。
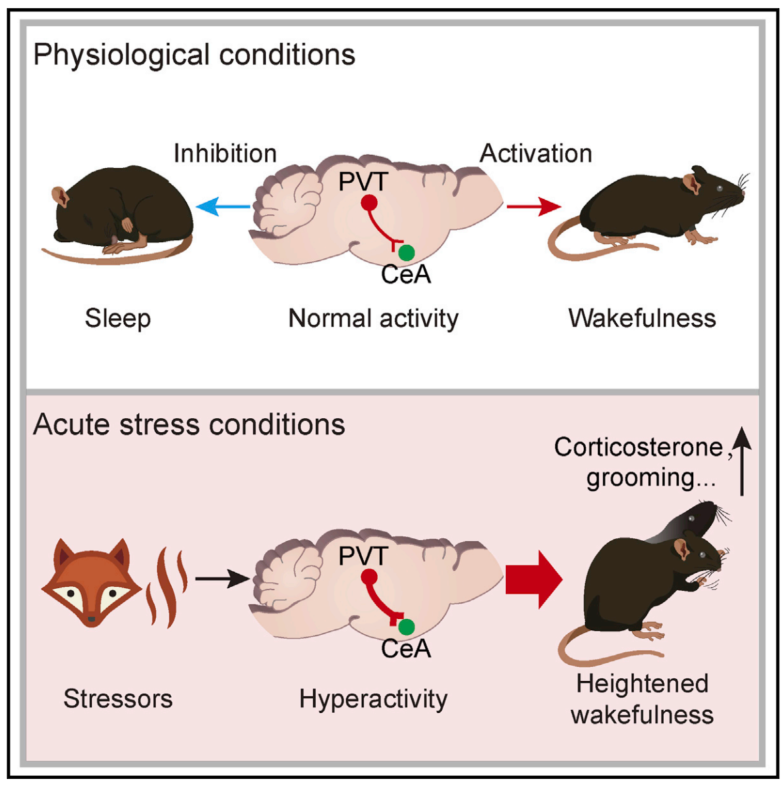
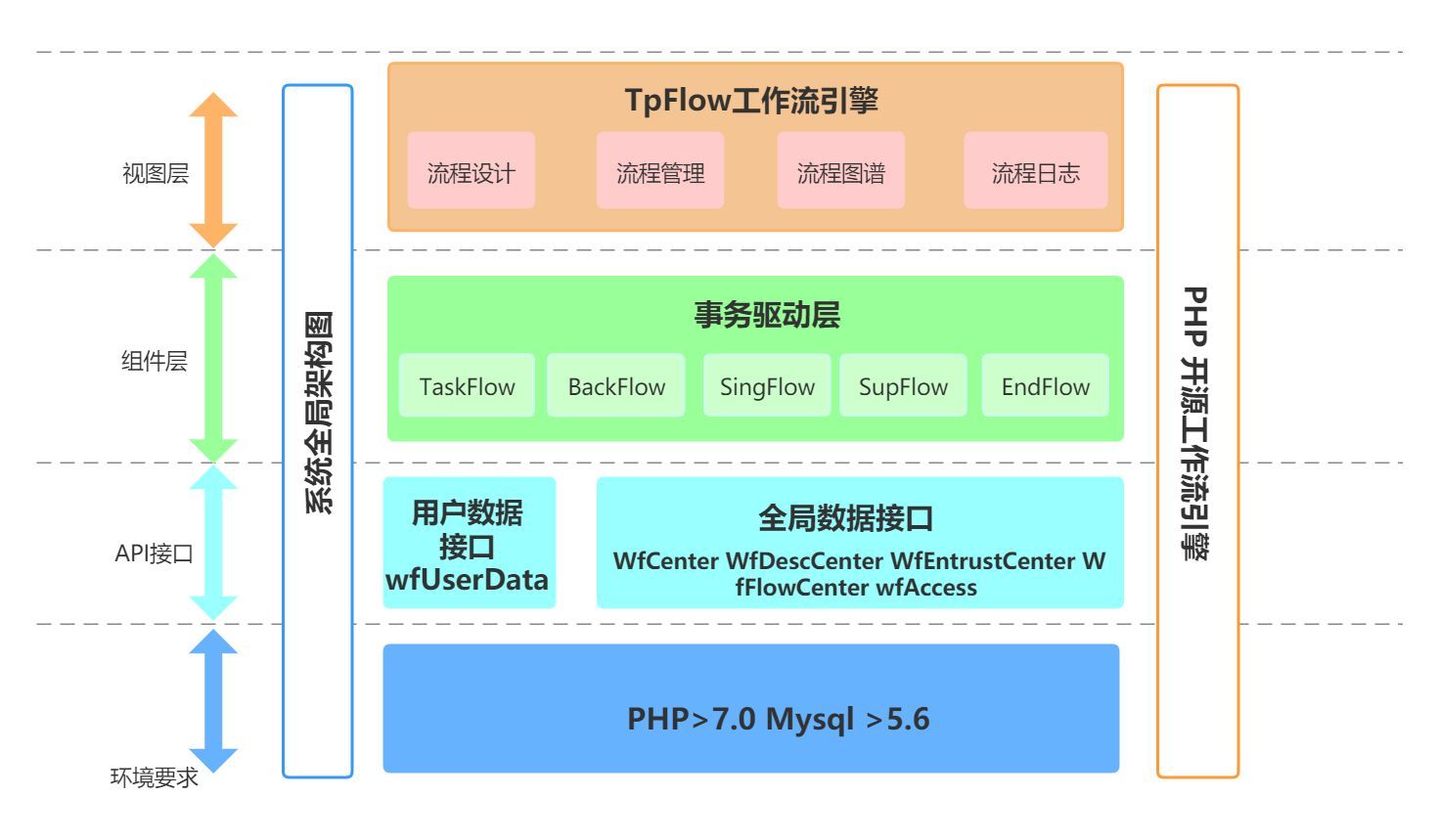
工作模式图
综上所述,该研究综合运用神经电生理记录、光纤钙活动记录、光遗传学、化学遗传学和行为学等多种技术手段,聚焦于觉醒睡眠调控的神经机制和急性失眠的发病机理,证明PVT→CeA神经环路不仅在生理条件下具有促进觉醒的功能,而且在急性应激情况下也被显著激活,从而介导急性应激导致的过度觉醒或失眠(见工作模式图)。这些发现拓展了觉醒睡眠控制的神经环路机制,并且为临床上阐明失眠等觉醒睡眠障碍的发病机理和开发新的干预策略奠定了理论基础。
重庆医科大学赵娟娟硕士和刘程煜硕士是论文的共同第一作者。
论文链接:
https://www.cell.com/cell-reports/fulltext/S2211-1247(22)01716-8
参考文献:
1. Ren, S.C., et al., The paraventricular thalamus is a critical thalamic area for wakefulness. Science, 2018. 362(6413): p. 429-+.
2. Do-Monte, F.H., K. Quinones-Laracuente, and G.J. Quirk, A temporal shift in the circuits mediating retrieval of fear memory. Nature, 2015. 519(7544): p. 460-+.
3. Penzo, M.A., et al., The paraventricular thalamus controls a central amygdala fear circuit. Nature, 2015. 519(7544): p. 455-+.
4. Beas, B.S., et al., The locus coeruleus drives disinhibition in the midline thalamus via a dopaminergic mechanism. Nature Neuroscience, 2018. 21(7): p. 963-+.
5. Ma, C.Y., et al., Sleep Regulation by Neurotensinergic Neurons in a Thalamo-Amygdala Circuit. Neuron, 2019. 103(2): p. 323-+.
来源:BioArtMED