景杰生物 | 报道
cGAS(环状鸟苷酸-腺苷酸合成酶)作为细胞质DNA感受器,是哺乳动物对抗微生物入侵的主要机制基础,且在抗肿瘤免疫方面也发挥作用。近日,被誉为诺贝尔奖“风向标”的生物医学领域重要奖项——拉斯克奖(The Lasker Awards),授予给发现“cGAS能够感知DNA,通过激活cGAS-STING信号通路刺激免疫和炎症反应”的科学家,展现了cGAS在对抗传染病和癌症方面的广阔应用前景。
蛋白质的翻译后修饰对cGAS的调控作用至关重要。例如,乙酰化可阻断cGAS活性并抑制自身DNA诱导的自身免疫[1];在有丝分裂过程中,磷酸化阻止了cGAS的激活[2];磷酸化对于cGAS定位在细胞质膜至关重要[3]。此外,乳酸化——由乳酸介导的一种翻译后修饰也参与了cGAS的调控过程,例如,cGAS的乳酸化可以诱导系统性红斑狼疮患者的干扰素(IFN)反应[4]。然而,cGAS如何受到乳酸化修饰的调控,其中的分子机制仍然知之甚少。
2024年9月25日,浙江大学张龙教授在国际顶级杂志Nature(IF=50.5)上在线发表了题为“AARS1 and AARS2 sense L-lactate to regulate cGAS as global lysine lactyltransferases”的最新研究成果[5]。研究发现丙氨酰-tRNA合成酶AARS1/2是哺乳动物细胞中的乳酸感知蛋白并发挥乳酸转移酶作用。AARS2可以乳酸化修饰cGAS进而抑制固有免疫系统,最终影响病毒感染和免疫逃逸。值得注意的是,本文是近一年来发表在CNS正刊上的第4篇关于乳酸化修饰的重磅研究成果,揭示了新型的乳酸化调控模式和乳酸化蛋白的重要生物学功能!

该研究发现L-乳酸可抑制cGAS介导的免疫反应,进一步运用CRISPR筛选和乳酸化修饰组学技术鉴定到AARS1/2是哺乳动物细胞中的L-乳酸感受器,并具备乳酸转移酶活性。与常规酰化修饰过程不同,AARS1/2能够以一种非乳酰辅酶A(Lactyl-CoA)依赖的方式,以ATP和L-乳酸为底物,将乳酸基团转移至赖氨酸侧链。研究进一步发现AARS2主要负责调控cGAS乳酸化修饰,导致cGAS失活,抑制了cGAMP的合成及固有免疫响应。在固有免疫细胞中阻断单羧酸转运蛋白1(MCT1)对L-乳酸的转运能够抑制cGAS的乳酸化进而恢复免疫反应。景杰生物为该研究提供了L-乳酸化修饰抗体、L-乳酸化泛抗体偶联树脂。
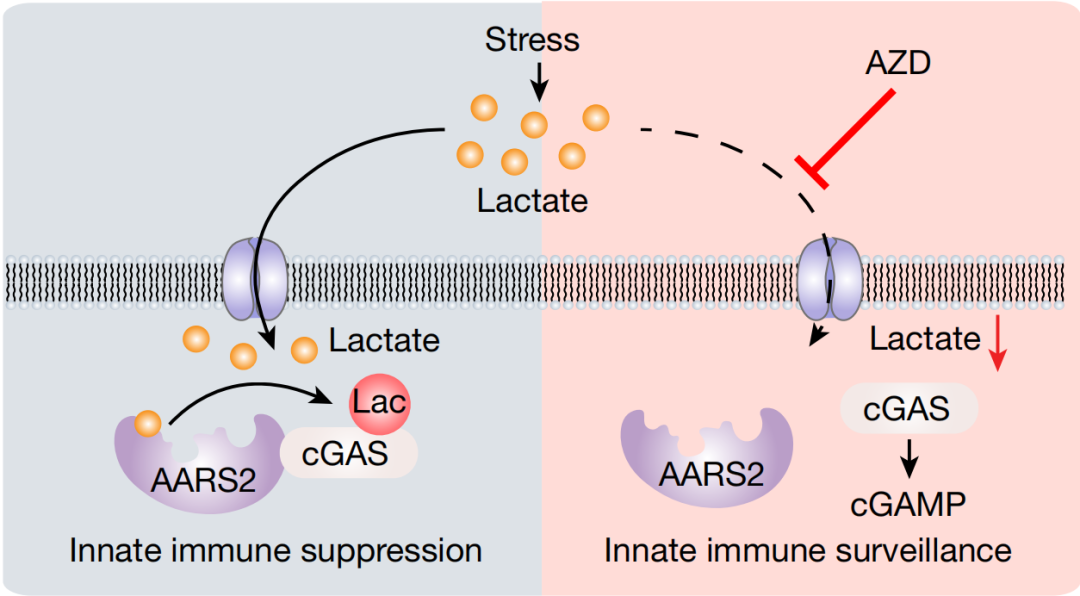
图1 AARS1/2介导cGAS乳酸化调控免疫抑制机制示意图
值得一提的是,近年来关于AARS1作为乳酸化修饰调控酶的研究取得了系列突破。2024年4月,苏州大学周芳芳团队通过CRISPRi筛选,发现并验证了AARS1是细胞内乳酸感应器和乳酸转移酶,AARS1直接与乳酸结合并催化乳酸-AMP的形成,将其转移到赖氨酸上调控整体赖氨酸乳酸化。由于细胞内的乳酸含量显著高于乳酰辅酶A(Lactyl-CoA),因此基于乳酸而非乳酰辅酶A的新型乳酸化调控模式进一步扩大了乳酸化的底物范围,包含一系列明星蛋白,如p53。这些研究共同携手开辟了崭新的领域。(点击链接详细阅读:Cell | 苏州大学周芳芳:AARS1介导p53乳酸化促进肿瘤发生新机制)[6]。
01
![]()
AARS1/2是L-乳酸感受器,调控细胞整体乳酸化修饰水平
研究首先发现L-乳酸水平与cGAS介导的免疫反应呈负相关。在人巨细胞病毒(HCMV)感染的患者中,血清中L-乳酸水平正常的患者,其血清中的cGAMP和IFNβ(干扰素β)浓度显著高于高乳酸血症(H-Lac)或乳酸酸中毒(LA)的患者。体外实验进一步表明,L-乳酸可能在cGAMP上游发挥作用。研究发现:细胞内的L-乳酸可以被感知并介导cGAS发生乳酸化,使cGAS失活。
为鉴定该过程的调控酶,研究通过全基因组CRISPR筛选聚焦到AARS1、AARS2和MCT1上。进一步运用乳酸化修饰组学分析发现敲低AARS1或AARS2可抑制L-乳酸诱导的乳酸化修饰水平,过表达AARS1或AARS2则结果相反。以上结果提示,AARS1/2是细胞内的L-乳酸传感器,可感知细胞内的L-乳酸并调控细胞的整体赖氨酸乳酸化修饰水平。

图2 AARS1/2是细胞内L-乳酸传感器并调控整体乳酸化水平
02
![]()
AARS1/2是ATP依赖性的乳酸转移酶
研究进一步揭示了AARS1/2介导发生乳酸化修饰的独有机制。AARS1/2是一种ATP依赖的乳酸转移酶,能够利用ATP作为能量源,通过两步反应催化发生乳酸化修饰:首先,L-乳酸与ATP反应生成乳酸腺苷酸中间体(乳酸-AMP),然后将乳酸基团转移至目标蛋白质的特定赖氨酸残基上。该机制在进化上是保守的,从细菌到哺乳动物都保持了类似的功能。
进一步质谱分析和过表达等实验证实:AARS2介导细胞内cGAS的乳酸化和失活(而不是AARS1)。在人和小鼠细胞中,缺失AARS2后,内源性cGAS的乳酸化被抑制,且AARS2缺失细胞中cGAMP、IFNβ信号的传导以及Ifnb1的表达不受L-乳酸或乳酸钠的抑制。
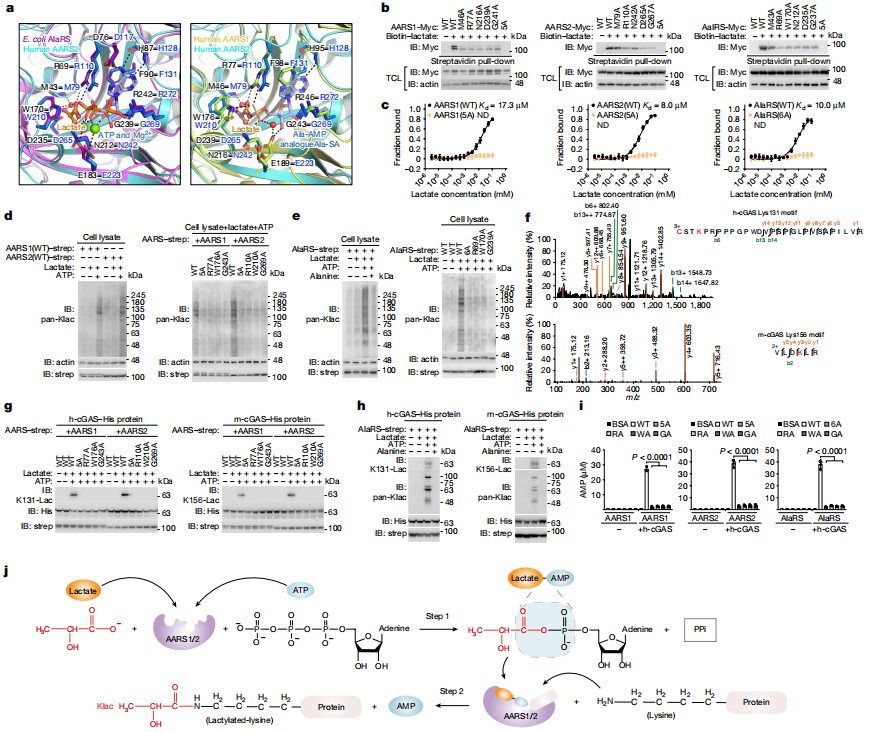
图3 AARS1/2通过两步反应催化L-乳酸转化为乳酸化修饰
03
![]()
cGAS乳酸化抑制固有免疫反应
研究进一步揭示了cGAS乳酸化的机制及功能。在高乳酸条件下,AARS2与cGAS相互作用,直接介导cGAS蛋白(人源cGAS-Lys131位点和鼠源cGAS-Lys156位点)发生乳酸化修饰。为了明确cGAS乳酸化的功能,研究者开发了一个遗传密码子扩展正交系统,模拟cGAS特定位点的乳酸化。进而发现,cGAS的乳酸化使其失去液液相分离(LLPS)的能力,并降低了其酶活。
为进一步探索cGAS乳酸化的功能,研究人员构建cGAS(K156Q)小鼠(cGASKQ/KQ,模拟发生乳酸化)和cGAS(K156R)小鼠(cGASKR/KR,模拟去乳酸化)模型。结果显示,感染单纯疱疹病毒(HSV-1)后,cGASKQ/KQ小鼠呈现更加严重的肺部损伤和更高的死亡率,提示cGAS的乳酸化在体内具有免疫抑制功能。
机制上,cGAS通过识别线粒体DNA(mtDNA)或染色体DNA片段而发挥免疫监视功能。在体外,cGAS(non-Lac)与mtDNA快速融合并发生相分离,而cGAS(Lac)则排斥mtDNA,提示乳酸化的cGAS无法正确地感知细胞中的DNA片段而影响免疫功能。体内结果也显示,cGASKQ/KQ小鼠的固有免疫反应和全身性炎症反应减少。
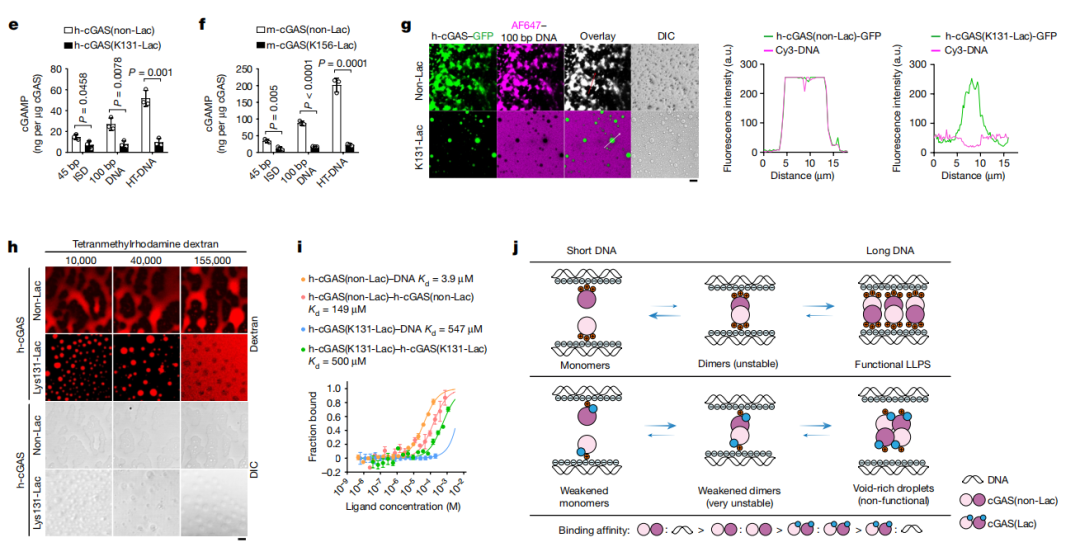
图4 AARS2介导cGAS的乳酸化,是L-乳酸诱导的固有免疫逃避所必需的
04
![]()
cGAS乳酸化与焦虑
作者发现,焦虑患者往往免疫力低下,其血清中L-乳酸水平显著升高,这表明L-乳酸介导的cGAS乳酸化可能与焦虑引起的免疫监视不良相关。研究者通过构建焦虑小鼠模型,发现焦虑小鼠血清中L-乳酸水平均显著升高,且对病毒的易感性增加。研究还将小鼠连续暴露于足电刺激下8天,作为焦虑的替代模型,获得了类似的结果。而使用MCT1抑制剂,可阻断L-乳酸转运进入固有免疫细胞,从而维持细胞质DNA感知和固有免疫监视。

图5 cGAS的乳酸化会使其丧失对DNA的识别能力,MCT1阻断可使其恢复
综上所述,研究揭示了AARS1和AARS2是细胞内L-乳酸传感器和乳酸转移酶,控制全局赖氨酸乳酸化。其中,细胞中的AARS2通过识别L-乳酸,介导cGAS发生乳酸化,从而使其失活并降低了机体固有免疫监视功能。研究成果拓宽了我们对L-乳酸和乳酸化的基本认识,为开发免疫治疗策略提供了重要的理论基础和实验参考。
![]()
原创性评述
![]()
![]()
![]()
乳酸化的发现与研究的深入为乳酸的功能研究打开了全新的方向。近一年来乳酸化相关研究4次发表在CNS正刊上,揭示了乳酸化修饰调控的重要研究价值和生物学意义!该研究在之前基础上,再次揭示了乳酸化修饰的新功能与调控机制。
由于乳酸和丙氨酸结构的相似性,先前研究报道了AARS1在其经典的丙氨酰tRNA合成酶功能之外,还可发挥又一新功能:作为一种乳酸转移酶介导乳酸化发生。该研究进一步发现:AARS1和AARS2共同参与调控全局乳酸化修饰,并在多种生物中进化保守,突出其在调控乳酸化中的关键角色。值得注意的是,研究证实AARS1/2催化乳酸化的过程无需乳酰辅酶A的参与,直接利用乳酸作为乳酸基团供体。该过程可将葡萄糖的代谢产物(乳酸+ATP)完全利用,通过共价加成到蛋白上,从而调控整体乳酸化。这一过程与我们熟知的ATP依赖性的磷酸化过程类似,因此从这个角度,乳酸化和磷酸化的调控具有异曲同工之妙。更重要的是,这一新型的调控模式,发现了一系列明星蛋白,如p53,cGAS等均可发生乳酸化修饰并改变它们的功能。同时这也将进一步扩大乳酸化的底物范围,让人们不禁猜想,是否还有更多的明星蛋白和关键药靶受到了细胞内乳酸的影响并通过乳酸化发挥功能。
此外,该研究为蛋白质新型酰化研究提供了一种全新的工具和方法。常规研究酰化修饰的方法通过在细胞内表达特定突变体进行,但这不能准确区分乳酸化和其他酰化修饰的功能。本研究开发的遗传密码扩展技术能够特异性地在目标蛋白上引入乳酸化修饰,为研究蛋白质乳酸化提供了新的工具,增进了对乳酸化修饰功能的理解。
需要补充的是,本文研究的乳酸更加精细化聚焦于L-乳酸,发现AARS1/2是L-乳酸传感器和转移酶的重要功能。自然界中存在乳酸的两种旋光异构体L-乳酸和D-乳酸,可分别介导蛋白发生L-乳酸化修饰、D-乳酸化修饰。分别针对L-、D-乳酸化的研究将更精细地揭示乳酸的生物学功能。景杰生物作为全球首家研发乳酸化修饰抗体的创新公司,现已全面提供L-、D-乳酸化修饰泛抗体和修饰组学分析,可特异性识别和分析L-乳酸化与D-乳酸化修饰,更加真实地揭示乳酸化修饰的相关功能与分子机制(点击链接详细阅读:全球首发 | D-乳酸化修饰解码生命奥秘,乳酸化修饰疆土再开拓)。
参考文献:
1. Dai, J. et al. 2019. Acetylation blocks cGAS activity and inhibits self-DNA-induced autoimmunity. Cell .
2. Li, T. et al. 2021.Phosphorylation and chromatin tethering prevent cGAS activation during mitosis. Science.
3. Barnett, K. C. et al. 2019. Phosphoinositide interactions position cGAS at the plasma membrane to ensure efficient distinction between self- and viral DNA. Cell.
4. Zhang J. et al. 2024. Mitochondrial DNA programs lactylation of cGAS to induce IFN responses in patients with Systemic Lupus Erythematosus. J Immunol.
5. Heyu Li. et al. 2024. AARS1 and AARS2 sense l-lactate to regulate cGAS as global lysine lactyltransferases. Nature.
6. Zong z. et al. 2024. Alanyl-tRNA synthetase, AARS1, is a lactate sensor and lactyltransferase that lactylates p53 and contributes to tumorigenesis. Cell.















![[遇到问题] Word中插入公式横线“-”变成了长连字符](https://i-blog.csdnimg.cn/direct/1162b1da32384435b83d866db0a6e64d.png)