小罗碎碎念
研究团队通过单细胞和空间转录组分析,揭示了与鼻咽癌进展和免疫治疗反应相关的三级淋巴结构。

| 作者角色 | 作者姓名 | 单位(中文) |
|---|---|---|
| 第一作者 | Yang Liu | / |
| 通讯作者 | Jin-Xin Bei | 国家癌症中心南方肿瘤学重点实验室,鼻咽癌诊断治疗广东省重点实验室,广东省临床癌症研究中心,中山大学肿瘤防治中心,广州 510060,中国 |
研究的主要发现
-
三级淋巴结构(TLS):在鼻咽癌中,TLS是与癌症结果相关的免疫细胞聚集体。研究分析了77个活检和血液样本中的343,829个细胞的单细胞转录组,以及15个肿瘤中的31,316个点的空间分辨转录组,以解码TLS的成分和与肿瘤细胞聚集体的相互作用。
-
关键细胞群:研究识别了TLS中的关键细胞群,包括CXCL13+癌症相关成纤维细胞、干性CXCL13+CD8+ T细胞,以及B细胞和T辅助细胞。
-
肿瘤进展和免疫治疗反应:研究显示,生发中心反应成熟的浆细胞与肿瘤细胞聚集体交错,促进EBV相关恶性细胞的凋亡,并增强免疫治疗反应。CXCL13+癌症相关成纤维细胞促进B细胞粘附和抗体产生,激活在肿瘤细胞聚集体中变得疲惫的CXCL13+CD8+ T细胞。
-
预后和PD-1阻断反应:TLS相关细胞特征与预后和PD-1阻断反应相关,为癌症治疗策略提供了见解。
-
肿瘤微环境(TME):研究还探讨了TME中肿瘤、免疫和基质细胞以及细胞外成分的组织,这对于有效的抗肿瘤免疫至关重要。
-
EBV感染:研究还观察到EBV感染与GC B细胞和TLS形成之间的联系,为EBV相关肿瘤的治疗提供了潜在的靶点。
-
免疫治疗:研究结果表明,抗体分泌的浆细胞通过抗体依赖性细胞介导的细胞毒性(ADCC)或抗体依赖性细胞吞噬作用(ADCP)促进恶性细胞凋亡,这可能解释了TLS在多种人类肿瘤中与肿瘤浸润性免疫细胞程度高、患者生存有利和对免疫检查点阻断(ICB)疗法反应更好的积极关联。
这项研究为理解TLS在肿瘤发展和免疫治疗反应中的作用提供了新的见解,并可能有助于开发新的癌症治疗策略。
一、引言
免疫细胞浸润是癌症中的常见病理现象,肿瘤细胞、免疫细胞、基质细胞以及细胞外成分共同构成了肿瘤微环境(TME)。
这些成分的组织结构对有效抗肿瘤免疫至关重要[1]。三级淋巴结构(TLS)是在炎症、感染或肿瘤组织中发展起来的、组织良好的免疫细胞异位室[2,3]。
最初,通过免疫组化(IHC)检测,TLS中的T细胞和B细胞区域被特征化[4]。随后,多项研究表明,TLS还包含作为调节器的抗原呈递细胞(APCs)和作为支持性基础设施的基质细胞[5],以及靠近B细胞的T滤泡辅助细胞(Tfh)和滤泡树突状细胞(FDC)[6]。
最近,单细胞RNA测序和空间转录组学研究表明,肿瘤中的TLS具有特定的细胞群体,如卵巢癌中的CXCL13+ T辅助细胞[7],头颈部鳞状细胞癌中的SEMA4A+ 生发中心(GC)B细胞[8],以及肾细胞癌中的CXCL12+ 成纤维细胞[9]。
这些发现表明,从不同技术角度看,肿瘤中的TLS具有复杂和异质性的组成,亟待通过更大样本量和更高分辨率的尖端技术进行进一步研究。
GC是肿瘤中成熟TLS的关键特征,是选择性激活和扩增B细胞克隆以及产生长寿浆细胞的重要室[6]。
尽管已在多种肿瘤中证实了GC B细胞和肿瘤浸润B细胞或浆细胞的共存[9–11],但关于GC反应的动态特征以及肿瘤内B细胞的发展轨迹,尤其是在TLS中的情况,尚不清楚。
最近的一项研究显示,GC B细胞表现出跨越暗-亮区轴的基因表达状态的连续性[12,13]。除了GC反应,包括淋巴组织诱导细胞(LTi)、成纤维网状细胞(FRC)和FDC[14,15]在内的多种细胞成分,以及LTβR信号[16]、粘附分子(VCAM1和ICAM1)[17]和淋巴趋化因子(CXCL13、CCL17和CCL21)[18–20]等分子过程,已被报道在自身免疫性疾病和慢性感染中驱动TLS形成。
此外,先前的研究还揭示了在鼠肿瘤模型中,成纤维细胞和内皮细胞协调TLS的形成[21,22]。然而,在人类肿瘤中驱动TLS形成的关键成分尚不清楚。
TLS能够处理局部肿瘤抗原,并与共定位的APCs生成效应记忆T细胞、记忆B细胞和浆细胞,这些细胞浸润到肿瘤中参与抗肿瘤反应[5]。其中,TLS中的T细胞或附近的T细胞会上调表达促生存和抗凋亡分子BCL-2,从而抑制黑色素瘤的生长[23]。
TLS相关的浆细胞可以分泌抗体,识别肿瘤相关抗原,通过抗体依赖性细胞毒性(ADCC)和抗体依赖性细胞吞噬(ADCP)促进恶性细胞凋亡[9]。这可能是TLS呈现程度较高与肿瘤浸润免疫细胞程度较高[24]、患者生存期良好以及多种人类肿瘤对免疫检查点阻断(ICB)疗法反应更好[23,25,26]之间的正相关性的解释。
尽管TLS相关的效应T细胞和B细胞表现出抗肿瘤表型[9,23],但它们如何与肿瘤细胞紧密空间接近并识别它们以执行抗肿瘤活动尚未被特征化。
在此,作者旨在利用单细胞和空间转录组学分辨率,以鼻咽癌(NPC)为模型,揭示TLS的细胞组成、形成和功能,以及它们在肿瘤进展和免疫治疗反应中的作用。NPC是中国南方常见的恶性肿瘤,具有密集的免疫细胞浸润[27]。作者还评估了关键TLS组分对多个NPC队列患者生存和免疫治疗反应的预后价值。
二、结果
2-1:NPC中TLS在单细胞和空间分辨率下的组成景观
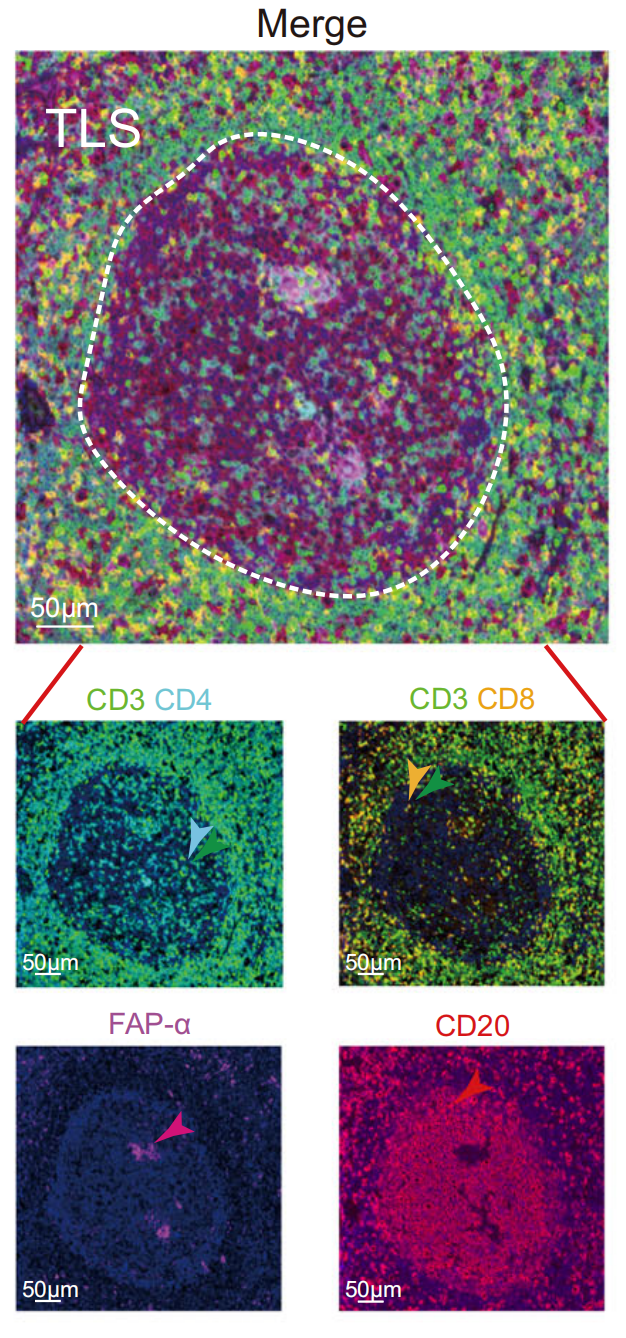
鉴于CD20+ B细胞与CD3+ T细胞聚集相邻是多种癌症中TLS的特征[4],作者进行了多重免疫组化(IHC)染色实验,并在NPC活检中揭示了显著的TLS,包含B细胞(以CD20为标志物)、CD4+ T细胞(CD3, CD4)、CD8+ T细胞(CD3, CD8)和成纤维细胞(FAP-α)(图1a和补充图1a)。
为了在单细胞分辨率下表征TLS,作者对包括56个肿瘤和来自56名NPC患者及11个鼻咽非癌性(NPN)组织的10个外周血单个核细胞(PBMC)在内的77个样本进行了单细胞RNA测序(scRNA-seq)分析,以获取转录组和免疫细胞受体图谱(见方法;补充图1b和数据1)。
经过严格的质量控制过滤(见方法),从所有样本中鉴定出343,829个细胞,包括肿瘤组织中的221,357个、非癌性组织中的48,995个和PBMC中的73,477个细胞(补充图1b)。
作者还使用Seurat包中实现的基于图的聚类方法,根据它们的表达谱鉴定了各种细胞簇,包括97,360个B细胞、88,009个CD4+ T细胞、95,686个CD8+ T细胞、20,051个NK细胞、21,088个髓系细胞、1,652个癌症相关成纤维细胞(CAFs)、1,550个内皮细胞和15,666个恶性细胞(图1b和补充图1d-h)。

特别是,作者根据典型的TLS标记物鉴定了TLS相关细胞簇,包括B细胞(CD19, MS4A1, CD79A, 和CD79B)、T滤泡辅助(Tfh)细胞(CD4_C8_CXCR5;CD4, CXCR5, CXCL13, 和BCL6)、CD8+ T细胞(CD8_C8_CXCL13;CD8A, CXCR5, CXCL13, 和BCL6)和CAFs(iCAF_C2_CXCL13;COL1A1, CXCL13, CCL19, 和CCL21;图1c和补充数据2)。
接下来,为了在原位以高分辨率探索TLS的空间细胞组成和分布,作者使用多种技术平台进行了空间转录组学(ST)分析,包括使用Stereo-seq(Stereo-seq队列)从三个新鲜冷冻NPC原发肿瘤中的9563个数据块(包含100×100=10,000个数据点;见方法)和使用Visium福尔马林固定石蜡包埋(FFPE)检测(Visium队列)从12个NPC原发肿瘤中的21,753个数据点(补充数据1)。
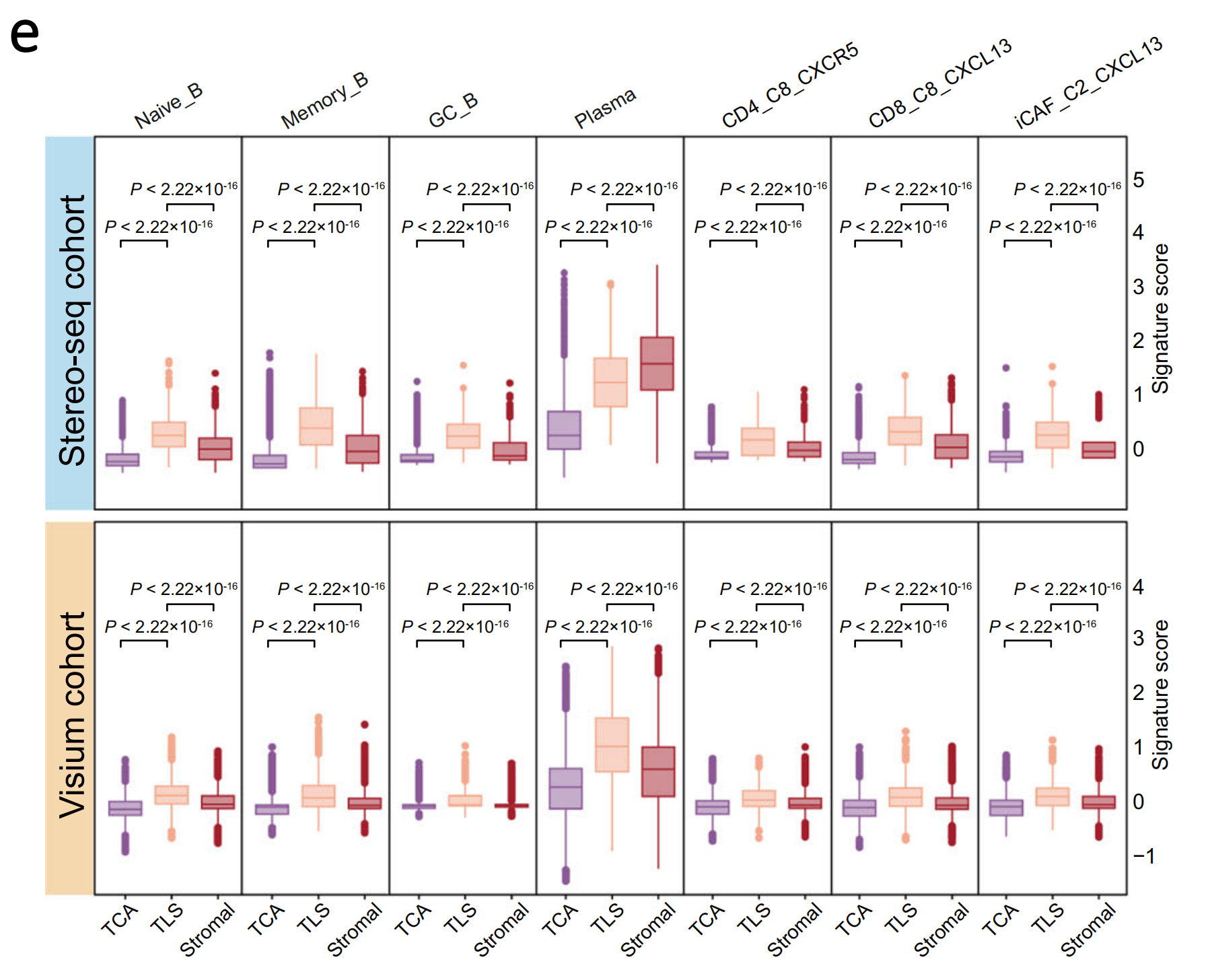
ST分析和苏木精-伊红(H&E)染色实验揭示了NPC肿瘤中Stereo-seq和Visium队列中TLS、肿瘤细胞聚集(TCA)和基质区域的不规则形状和多种位置(补充图2-4;见方法)。同时,ST分析在NPC肿瘤的TLS区域中确认了B系细胞(Naïve B, Memory B, GC B, 和浆细胞)、CD4_C8_CXCR5和CD8_C8_CXCL13 T细胞以及CXCL13+ CAFs(iCAF_C2_CXCL13)的显著聚集,这在Stereo-seq和Visium队列中均得到了证实(图1d, e)。
在这些细胞类型中,浆细胞在两个队列中的分布不同,Stereo-seq队列的基质区域中浆细胞的比例最高(图1e),这归因于所检查的三个样本中的一个样本中浆细胞的高浸润(补充图5a)。
此外,所有这些TLS相关细胞簇的位置在另一个独立的NPC样本集合中得到了证实,该样本集合通过来自多个微解剖肿瘤细胞聚集(TCA)、免疫细胞聚集(ICA)、异型上皮(DYS)、正常鼻咽上皮(NAT)和正常肿瘤相邻上皮(NOR)区域的RNA-Seq数据得出(微解剖队列,n=189;见方法),与其它区域相比,ICA区域中TLS相关细胞簇显著富集(补充图5b, c)。
综上所述,这些观察结果表明NPC中TLS具有共同的空间定位,其关键组成部分包括B系细胞(Naïve B, Memory B, GC B, 和浆细胞)、CD4_C8_CXCR5和CD8_C8_CXCL13 T细胞以及CXCL13+ CAFs。
2-2:NPC肿瘤进展中GC B细胞的发育轨迹和特征
免疫细胞受体分析在所有样本中揭示了19,405个具有BCR克隆型的B细胞,其中18,675个是独特的(补充数据3)。
与PBMC相比,来自NPC组织的B细胞中IGHA1、IGHG1和IGHG3的体细胞超突变(SHM)频率更高,反映了与抗原识别和激活相关的BCR亲和力更高[29,30],IGHA1和IGHG1同种型的克隆性和比例也更高(补充图6a)。差异表达基因(DEG)分析揭示了不同B细胞类型特征基因的独特表达(补充图6b)。
为了追踪B细胞的发育,作者使用扩散图进行了伪时间轨迹分析,揭示了B细胞从幼稚B细胞向记忆B细胞、GC B细胞和浆细胞的发展轨迹,伴随着IgH的SHM频率增加、克隆扩增和同种型转换(图2a)。
为了研究GC反应,作者对NPC GC B细胞进行了主成分分析(PCA)和圆形轨迹分析,揭示了跨越暗-亮区轴的基因表达状态的典型连续体[31]。
此外,暗区和亮区的B细胞分别表现出AICDA和CD83的表达增加,表明TLS中的GC反应具有先前报道的常见模式[12,13](补充图6c-e)。这些发现共同表明,浸润肿瘤的B细胞可能通过GC反应、亲和力成熟和抗体类别转换在NPC TME中经历有效的激活。
作者注意到,与早期阶段(I/II期;中值:3.3%)相比,晚期NPC肿瘤(III/IV期;中值:1.0%)中GC B细胞的比例显著降低(图2b和补充图6f),这一发现在一组scRNA-seq样本和另外两个独立的NPC队列(Bulk-RNA-seq队列,n=147和Microarray队列,n=150;补充图6g)中得到反映。
相比之下,不同阶段NPC样本中的浆细胞比例相似(图2b)。鉴于GC B细胞和浆细胞之间的联系,作者探讨了这一看似矛盾现象的机制。
首先,作者观察到在晚期NPC肿瘤中,与早期阶段相比,相同BCR克隆型在GC B细胞和浆细胞之间的转换显著减少(图2c),表明通过GC反应的新生浆细胞在晚期肿瘤中减少。其次,晚期NPC肿瘤中的泛免疫球蛋白(Ig)转录水平显著低于早期阶段,在所有三个队列中均观察到这一现象(图2d和补充图6h)。第三,IHC染色也显示晚期NPC肿瘤中的IgA和IgG表达低于早期阶段(n=27,图2e)。第四,GSEA揭示了晚期肿瘤浆细胞中多个途径的基因下调,包括BCR信号传导、肽生物合成过程和蛋白质运输(图2f),这表明浆细胞的抗体产生减少。
作者还注意到,与Visium(图2g)和Stereo-seq(补充图6i)ST队列中的TLS相比,TCA中的浆细胞与抗体生产和免疫反应相关的途径下调。最后,生存分析显示,GC B细胞比例和泛-Ig的转录水平与NPC患者的良好预后相关(GC B细胞:Bulk-RNA-seq队列,无进展生存期,PFS:P=0.019,风险比,HR=0.39;Microarray队列,PFS:P=0.00095,HR=0.33,OS:P=0.00012,HR=0.19;图2h和补充图6j)。
综上所述,这些观察结果强烈表明,GC B细胞的GC反应对于在肿瘤进展过程中维持抗体生产至关重要,尽管浆细胞的分化和功能降低。此外,转录组和去卷积分析显示,与EBV- GaC样本相比,EBV+ GaC样本中GC B细胞的比例更高(TCGA和内部数据;补充图6k),这表明EBV感染与肿瘤内GC反应之间存在联系。
2-3:抗体由浆细胞分泌,促进EBV相关上皮肿瘤中恶性细胞的凋亡
浆细胞产生的抗体通过免疫细胞如NK细胞或巨噬细胞的ADCC或ADCP介导抗肿瘤活性[9,32]。
空间转录组学(ST)分析和多重免疫组化(IHC)染色实验显示,在NPC活检切片中有大量浆细胞与NK细胞和巨噬细胞紧密接触(补充图7a, b)。此外,作者观察到在大多数NPC ST样本中,浆细胞比例与巨噬细胞或NK细胞的比例之间存在显著正相关(Stereo-seq队列:2/3;Visium队列:10/12;补充图7c),这表明在NPC肿瘤中浆细胞与NK细胞和巨噬细胞的广泛共定位。这些发现表明,NK细胞和巨噬细胞可能通过ADCC和ADCP在NPC中发挥抗肿瘤作用。
作者注意到,在具有高EBV载量的NPC患者中,肿瘤浆细胞的全Ig转录水平低于低EBV载量的患者,无论是肿瘤还是外周血样本,在Bulk-RNA-seq NPC队列中均观察到这一现象(补充图8a;见方法)。
作者进一步评估了两个ST队列中的EBV感染状态,使用来自scRNA-seq数据的EBV高和低肿瘤细胞之间的前100个差异表达基因作为Visium FFPE队列的EBV基因表达的替代标志,并直接使用EBV基因表达作为Stereo-seq队列的标志(见方法)。
作者识别了两类含有不同恶性细胞的TCA,具有高或低EBV特征(EBV高-或EBV低-TCA,分别),这进一步在NPC活检样本中的原位杂交检测EBV编码的EBERs仅在恶性细胞中得到证实(补充图8b–e)。其中,EBV高-TCA与两个ST队列中浆细胞的高比例呈负相关(Stereo-seq队列:2/3;Visium队列:12/12)(补充图8f)。
此外,作者还观察到浆细胞比例与单细胞水平的肿瘤凋亡标志相关(补充图8g)。使用ST数据,作者还观察到含有浆细胞的TCA(TCA-wP)与不含浆细胞的TCA(TCA-woP)相比,其凋亡标志(由外源性凋亡相关基因的转录水平定义)更高,尤其是在EBV高-TCA中含浆细胞(EBV高TCA-wP;图3a, b和补充图9a;见方法),尤其是表达FAS和CASP3(补充图9b)。
这些模式也在具有ST数据的EBV+胃癌(EBV+ GaC)队列和Microdissection NPC队列中观察到(补充图9c–f;见方法;补充图9g, h)。多重IHC染色实验显示,与EBV低-TCA相比,EBV高-TCA周围有更高含量的凋亡肿瘤细胞(CASP3+ PanCK+)、巨噬细胞(CD68)、NK细胞(CD56)和浆细胞(IgG)(图3c)。
此外,空间接近性分析显示,在EBV高-TCA中与浆细胞(IgG+;距离20 μm内)紧密接触的凋亡肿瘤细胞(CASP3+ PanCK+)数量显著高于EBV低-TCA(图3d, e和补充图10a, b)。
综上所述,这些观察结果暗示了一种可能的机制,即浆细胞产生抗体诱导凋亡,从而减少EBV相关上皮肿瘤中的恶性细胞负担。
细胞-细胞相互作用分析显示,EBV+(LMP1)NPC恶性细胞通过CCL2-CCR2与浆细胞相互作用(补充图10c)。此外,转录相关性分析显示,浆细胞标志与Bulk RNA-seq队列中CCL2-CCR2配体/受体对平均表达之间存在正相关(补充图10d)。
这些数据表明,EBV+ NPC恶性细胞可能通过CCL2-CCR2轴吸引浆细胞,导致EBV+ TCA中形成富含浆细胞的微环境。
2-4:浆细胞在NPC中的免疫治疗响应中的作用
为了探索浆细胞产生的抗体在免疫治疗中的潜在作用,作者比较了12名NPC患者(Visium队列)中响应者和非响应者上述抗体和浆细胞的特征,这些患者额外接受了抗PD1免疫检查点阻断(ICB)治疗(toripalimab加化疗;补充数据1)。
作者观察到响应者具有更高的肿瘤全Ig表达水平和更多的浆细胞浸润肿瘤点,而非响应者(图4a和补充图10e)。此外,作者还观察到响应者具有更高的TCA-wP比例,特别是EBVhigh-TCA-wP(图4b),并且EBVhigh-TCA-wP的凋亡标志显著高于非响应者(图4c)。
这些观察结果表明,促进EBVhigh恶性细胞凋亡的浆细胞也促进了NPC的ICB治疗响应。值得注意的是,作者在非响应者中观察到与恶性细胞相关的免疫抑制标志物高于响应者,以及EBVhigh恶性细胞或TCA的免疫抑制标志物高于EBVlow对应物(NPC和EBV+ GaC;图4d),这表明ICB治疗响应可能通过ICB逆转EBVhigh恶性细胞的免疫抑制能力来实现。
2-5:CXCL13+ TLS相关的CAFs促进NPC中B细胞的附着和抗体产生
尽管FDCs(滤泡树突状细胞)已被证明是TLS形成的关键基质成分[24],但在NPC样本中,其典型标记物(CR2)的表达极为罕见(补充图11a)。相反,作者识别了一种与TLS相关的CXCL13+ CAFs(iCAF_C2_CXCL13),其具有特定的TLS典型标记物表达,包括CXCL13、CCL19和CCL21(图5a和补充数据2)。
差异表达基因(DEG)分析显示,CXCL13+ CAFs表达了簇标记(PTGDS、TNFSF13B、CYP1B1和PDPN)、补体成分相关基因(C2和C3)和细胞粘附分子(VCAM1和ICAM1;图5a和补充数据2),这些基因与B淋巴细胞的激活和附着有关[33,34]。
基因集富集分析(GSVA)揭示了CXCL13+ CAFs特有的富集途径,包括“B细胞趋化”、“生发中心形成”和“C3和C5激活”途径(图5b),这些途径与GC的形成以及B细胞的迁移和激活有关[35,36]。相关性分析显示,CXCL13+ CAFs的比例与B系簇和多个IgH基因的转录水平在Bulk-RNA-seq和Microarray NPC队列中显著相关(补充图11b)。
作者还观察到,从早期到晚期,NPC样本中CXCL13+ CAFs的比例呈下降趋势,这与GC B细胞和抗体水平的变化趋势相似(图2b–d)。此外,多重IHC染色实验显示,CXCL13+ CAFs存在于B细胞聚集物(TLS的B细胞区;图5d)。
空间分析还表明,CXCL13+ CAFs位于TLS内,而CXCL13- CAFs主要位于基质区域(图1e和补充图11c)。综上所述,这些观察结果表明CXCL13+ CAFs可能与NPC TLS中B细胞的GC形成和抗体产生有关。
细胞-细胞相互作用分析显示,CXCL13+ CAFs通过CXCL13-CXCR5、VCAM1-整合素、ICAM1-整合素和TNFSF13B相关配体-受体对与B细胞相互作用(图5e),这些都是B细胞趋化、附着和激活的已知介导者[37,38]。
支持性证据来自ST和多重IHC分析,这些分析显示CXCL13+ CAFs嵌入在具有强表达全Ig的浆细胞聚集物中;并且,在NPC活检中,CXCL13+ CAFs与浆细胞的比例之间存在强烈相关性(补充图11d-f)。SpaGene分析显示TLS区域内的斑点内和斑点间CXCL13+ CAFs与B细胞的潜在相互作用(图5f和补充图12a)。为了验证CXCL13+ CAFs对B细胞的作用,作者进行了NPC组织中的CXCL13+ CAFs(VCAM1+ CAFs
和健康供者外周B细胞的体外共培养实验(补充图12b-d)。CCK8实验结果显示,与VCAM1- CAFs相比,VCAM1+ CAFs上附着的B细胞数量显著增加,且这种增加的附着能力在使用VCAM1中和抗体后减弱(图6a)。这些数据表明VCAM1+ CAFs具有比VCAM1- CAFs更强的B细胞附着能力。
此外,共培养实验还显示,CXCL13过表达显著增强了B细胞的迁移能力,而添加CXCL13中和抗体则显著抑制了这种增强(图6b),强烈暗示CXCL13+纤维细胞通过CXCL13-CXCR5轴招募B细胞聚集物的重要性。
有趣的是,共培养实验还显示,与VCAM1- CAFs共培养的B细胞产生的IgG显著高于其他(VCAM1-)CAFs(图6c),这表明VCAM1+ CAFs可能诱导B细胞的分化和成熟。
值得注意的是,细胞-细胞相互作用分析显示,CXCL13+ CAFs与浆细胞之间通过高表达的细胞因子和细胞因子受体(包括TNFSF13B-TNFRSF13B,这是一种已知的B细胞成熟因子)表现出密集的相互作用(补充图12e)。
为了确定CXCL13+ TLS相关的CAFs是否通过TNFSF13B信号增强B细胞的抗体产生,作者进行了类似的共培养实验,并在成纤维细胞中额外过表达或阻断TNFSF13B。共培养实验显示,与过表达TNFSF13B的成纤维细胞共培养的B细胞产生的IgG显著增加,而TNFSF13B中和抗体显著消除了由于TNFSF13B过表达引起的IgG增加(图6d)。
这些发现证实了CXCL13+ TLS相关的CAFs通过TNFSF13B信号促进抗体产生。此外,生存分析显示,具有更高IgG表达的CXCL13+ CAFs的比例与NPC患者的更好预后相关(补充图12e)。这些观察结果强烈暗示CXCL13+ CAFs与B细胞相互作用,并通过介导其抗体产生,从而促进NPC患者的更好生存。
2-6:CXCL13+ CD8+ T细胞在TLS中的发展潜力与TCA中的耗竭CD8+ T细胞
作者识别了一个与TLS相关的CD8+ T细胞簇,CD8_C8_CXCL13,其强烈表达一些典型的激活T细胞标记物(CD27、CD28、ICOS、TNFRSF4和TNFRSF14)、干细胞样标记物(TCF7、BCL6和PLAGL1)、趋化因子(CXCL13、CXCR5、CCR4和CXCR3)以及Toll样受体(TLR4-6、TLR8和TLR9;图7a和补充数据2)。
作者注意到CD8_C8_CXCL13细胞表达PDCD1,但不表达其他在耗竭CD8+ T细胞中高度表达的耗竭分子(HAVCR2、LAYN、CTLA4和ENTPD1;图7a和补充数据2)。多重IHC染色实验还显示,CXCL13+ CD8+ PD1+ HAVCR2- T细胞(CD8_C8_CXCL13)围绕NPC中的B细胞(图7b)。
此外,作者观察到PDCD1表达与CD8_C8_CXCL13细胞中的激活基因相关,但与CD8_C11_HAVCR2细胞中的耗竭基因相关(补充图13a)。这些观察结果表明PDCD1可能防止CD8_C8_CXCL13细胞的过度激活,而不是耗竭,这与小鼠模型中的先前发现一致[40,41]。
此外,基因集富集分析(GSVA)显示,与耗竭的CD8_C11_HAVCR2细胞相比,CD8_C8_CXCL13细胞中与表观遗传修饰和代谢相关的信号通路被相反地富集(补充图13b)。由于DNA去甲基化和糖基生物合成诱导T细胞耗竭[42–44],数据暗示CD8_C11_HAVCR2细胞具有耗竭特征,而不是CD8_C8_CXCL13细胞。
为了进一步探索NPC中CD8+ T细胞的发展,作者首先进行了伪时间轨迹分析,并揭示了从初始或中期状态的CD8_C1_LEF1、CD8_C7_ZNF683、CD8_C8_CXCL13和CD8_C10_STMN1细胞到终末状态的CD8_C11_HAVCR2细胞的四个发展路径(图7c和补充图13c)。
沿着从CD8_C8_CXCL13到CD8_C11_HAVCR2细胞的发展路径,作者观察到耗竭分数的增加趋势和干细胞样分数的减少趋势(图7d、补充图13c和补充数据4)。TCR共享分析显示,CD8_C11_HAVCR2细胞与CD8_C8_CXCL13细胞相比,具有最多的前10个相同的TCR克隆型(图7c和e,以及补充数据5)。
此外,与CD8_C8_CXCL13细胞相比,CD8_C11_HAVCR2细胞的TCR多样性降低(补充图13d)。ST分析显示,CD8_C8_CXCL13 T细胞聚集在TLS中,而CD8_C11_HAVCR2 T细胞分散在TCA中(图7f)。这些观察结果暗示了从TLS中的CD8_C8_CXCL13细胞到广泛分布在TCA中的耗竭CD8_C11_HAVCR2细胞的发展轨迹,伴随着干细胞样特征和TCR多样性的减少。
为了探索CD8+ T细胞的抗肿瘤机制,作者使用CSOmap软件重建了CD8+ T细胞与恶性NPC细胞之间的潜在联系(补充图13e)。
作者观察到CD8_C8_CXCL13细胞与恶性NPC细胞之间的联系最强,这表明CD8_C8_CXCL13细胞具有最大的识别和攻击恶性NPC细胞的能力(补充图13f)。此外,作者还注意到CD8_C8_CXCL13细胞与恶性NPC细胞之间的趋化因子(CXCR3-CCL20、CXCR3-CXCL10和CXCR3-CCL19)和共刺激(CD27-CD70)联系比
CD8_C11_HAVCR2细胞更多(图7g)。作者还对NPC活检进行了多重IHC染色,确认了表达CD70的恶性细胞(CD70+ PanCK+)和表达CD27的CXCL13+ CD8+ T细胞(CD8+ CXCL13+ CD27+;补充图13g)之间的物理接触。尽管CD8_C8_CXCL13细胞在NPC肿瘤中的普遍性相对较低(scRNA-seq队列:0-9.89%;多重IHC队列:0.5-11%;补充图13h),但其在早期NPC肿瘤中的比例显著高于晚期NPC肿瘤(补充图13i)。
这些观察结果表明,CD8_C8_CXCL13细胞可能更积极地招募到TLS中,并且在NPC的TCA中的耗竭CD8+ T细胞中具有更大的抗肿瘤潜力,尤其是在早期阶段。
2-7:TLS相关的细胞簇促进免疫激活微环境,与NPC的预后相关
细胞-细胞相互作用分析揭示了B细胞与CD8_C8_CXCL13 T细胞之间的相互作用,通过MHC-CD8、ICOSLG-ICOS、CD86-CD28和IL7-IL7R配体-受体对,其中B细胞作为抗原呈递细胞激活CD8+ T细胞在肿瘤中[45,46](补充图14a, b)。
分析还揭示了B细胞与CD4_C8_CXCR5(Tfh)细胞之间的密集相互作用,通过CXCR5-CXCL13、CD40-CD40LG和TNFRSF14-TNFSF14配体-受体对,这些相互作用是激活和成熟B细胞的已知关键介体[37,47]。这与先前的发现一致,即Tfh细胞在介导生发中心内B细胞的筛选和分化中起着关键作用[48]。鉴于B系细胞、CD4_C8_CXCR5和CD8_C8_CXCL13 T细胞以及CXCL13+ CAFs是NPC中TLS的关键组成部分,作者还在三个NPC队列中观察到这些集群之间的强烈成对相关性(补充图14e)。
综合这些数据揭示了一个由与免疫激活相关的密集配体-受体对介导的TLS相关细胞簇之间的细胞间网络,强烈暗示这些细胞间的交叉对话可能促进了NPC TME的免疫激活微环境。
基于scRNA-seq数据中TLS相关细胞的转录特征,作者估计了Microdissection、Bulk-RNA-seq和Microarray NPC队列中各种TLS相关细胞类型的比例(补充图15a;见方法)。
这些样本是可比的,因为它们的临床特征没有差异(补充图15b)。基于这些,生存分析显示,NPC患者的预后与七种TLS相关细胞类型的比例之间存在强烈关联,包括B系细胞(Naïve B、Memory B、GC B和浆细胞)、CD4_C8_CXCR5和CD8_C8_CXCL13 T细胞以及CXCL13+ CAFs,细胞比例越高,生存期越好(图8a)。
此外,作者根据TLS相关细胞簇的标志性基因的转录水平,在三个队列中确定了高TLS细胞签名(TLS-CS)和低TLS细胞签名(TLS-CS)的两组NPC患者(图8b)。生存分析显示,与低TLS-CS相比,高TLS-CS的NPC患者具有更好的预后(Bulk-RNA-seq队列,PFS:P = 0.0018,HR = 0.29;Microarray队列,PFS:P = 0.00033,HR = 0.32,OS:P = 0.00002,HR = 0.19;图8c)。
作者还进行了多变量Cox回归分析,发现TLS签名独立地作为NPC生存的预后指标(补充数据6)。在TLS-CS高和低组之间没有发现临床特征的显著差异(补充图15c–e)。这一发现得到了使用多重IHC染色进行TLS的独立队列的进一步证实,该队列显示具有TLS的患者预后优于无TLS的患者(补充图16a)。
这种多重IHC染色还揭示了与无TLS的患者相比,具有TLS的NPC患者中免疫细胞浸润更多(补充图16b, c)。生存分析显示,免疫细胞浸润程度高的NPC患者预后更好(补充图16d)。
此外,作者观察到在ICB响应者中七种TLS相关细胞簇的水平显著高于非响应者(图8d)。综合这些观察结果,这些关键细胞簇形成的TLS对NPC患者的预后和免疫治疗响应具有重要贡献。
三、讨论
本研究通过整合多组学数据,包括来自多个独立样本队列的样本,确定了TLS、TCA和基质区域的空间位置,以及这些肿瘤细胞之间的细胞相互作用,这是迄今为止样本量最大的研究(补充图17a, b)。
值得注意的是,作者在其他癌症中常见的免疫细胞中识别出独特的细胞群体,包括CXCL13+ CAFs和CXCL13+ CD8+ T细胞,这表明可以使用NPC作为模型来研究肿瘤中的异质性TLS。
此外,作者的研究揭示了GC反应在抗体分泌浆细胞从TLS到TCA的发育轨迹中的作用。作者的研究还揭示了四种与浆细胞产生抗体、负责EBVhigh恶性细胞凋亡的TCA的共存模式。作者的研究还发现CXCL13+ CAFs促进B细胞附着和抗体产生,而B细胞可能激活TLS中的CXCL13+ CD8+ T细胞。
GC作为TLS成熟的标志,对于限制肿瘤生长和转移的体液免疫反应至关重要[10,49]。
在作者的研究中,作者观察到NPC从早期到晚期阶段GC B细胞的比例减少了70%。尽管GC细胞在各种癌症类型中的总体丰度通常较低[10,49],但它们表现出强大的增殖能力,能够产生大量记忆B细胞和浆细胞[50]。这些细胞通过产生抗体、细胞因子和其他因素在调节肿瘤微环境中发挥关键作用[51]。然而,它们之间的关系尚不清楚。
作者的研究通过多种ST分析证实了NPC中GC的存在,此外还报告了先前的scRNA-seq和多重IHC染色[52]。值得注意的是,作者的研究揭示了B细胞从幼稚B细胞到通过GC反应产生抗体的浆细胞的发育轨迹。考虑到高克隆性和广泛的IgH同种型转换和体细胞超突变,浆细胞更有可能在肿瘤内生成并经历肿瘤抗原识别[53]。
此外,作者观察到TLS中的浆细胞比TCA中的浆细胞具有更强的抗体产生能力,并且早期阶段的抗体水平高于晚期阶段。这些在空间和发育维度上的观察结果表明恶性细胞对浆细胞抗体产生的抑制作用,这与恶性细胞随着与免疫细胞的空间接近性增加而增加的免疫抑制能力以及肿瘤进展[54,55,56]是一致的。与GC B细胞和抗体与NPC更好的生存期相关联,这些数据表明GC反应是一个动态且必要的过程,产生新生浆细胞和抗体在TLS中进行有效的免疫反应,从而导致良好的癌症生存率。
此外,作者观察到GaC中EBV与GC B细胞之间的联系,这可能意味着病毒触发了EBV相关癌症中的GC反应和TLS形成。
尽管以前的研究已经表明,浆细胞分泌的抗体可以识别肿瘤相关抗原,通过ADCC或ADCP促进恶性细胞的凋亡[9,11],但对抗体在肿瘤内的分布和抗体特异性需要更深入的理解。
作者的研究显示NPC中抗体水平与NK细胞和巨噬细胞之间存在强烈相关性,这与其他癌症中的观察结果一致[9,32],这表明肿瘤抗体在介导ADCC和ADCP中具有典型作用。
值得注意的是,通过结合scRNA-seq和ST分析,作者发现两种不同的浆细胞分布模式(有或无)参与EBVhigh或EBVlow恶性细胞,导致NPC中具有不同转录特征和空间异质性的四种TCA。
EBV感染与EBV相关恶性肿瘤的发展密切相关,EBV已经进化出多种逃避先天性和适应性免疫反应的策略[27,57,58]。
在NPC患者中已经证实了针对EBV分子的抗体,以及高危NPC个体的抗体[59]。鉴于EBVhigh-TCA-wP在所有TCA中具有最高的凋亡特征,浆细胞可能分泌识别EBV或肿瘤的特定抗原的抗体,并通过ADCC或ADCP促进EBV感染的恶性细胞的凋亡,这与HPV+ HNSCC中存在HPV特异性浆细胞[11]是一致的。
此外,作者观察到EBVhigh-TCA-woP的凋亡特征高于EBVlow-TCA-wP,这可能被解释为EBV感染显著促进了NPC恶性细胞的凋亡,正如以前报道的[27]。此外,作者发现EBVhigh-TCA-wP在ICB响应者中的比例和更强的凋亡特征高于非响应者,这表明浆细胞与EBVhigh恶性细胞的空间接近性和抗原特异性对于NPC患者免疫治疗的疗效至关重要。
考虑到EBVhigh恶性细胞具有更高的免疫抑制能力,并且在ICB非响应者中富集,因此浆细胞分泌的抗体可能会逆转由EBVhigh恶性细胞形成的免疫抑制微环境,从而导致NPC患者对免疫治疗的响应。因此,作者推测结合EBV特异性抗体和ICB可能是治疗EBV相关肿瘤的一种潜在有效策略。
作者的发现揭示了一个与TLS相关的CAF簇,CXCL13+ CAFs,与NPC的TLS中B细胞聚集物共定位,与在TLS形成最早阶段出现的免疫成纤维细胞具有共同特征,并支持TLS的形成[60,61]。这些细胞高表达多种趋化因子(CXCL13、CCL19和CCL21)和粘附分子(VCAM1和ICAM1)。
鉴于CXCL13、CCL19和CCL21特别参与CXCR5+ B细胞、CCR7+ T细胞和CCR7+ DC在淋巴滤泡内的招募和定位[18-20],CXCL13+ CAFs可能通过招募免疫细胞来启动TLS的形成。支持性证据显示,共培养实验和高水平抗体可以解释CXCL13+ CAFs在聚集B细胞以形成TLS和产生抗体中的作用。
此外,共培养实验还显示,CXCL13过表达显著增强了B细胞迁移,这被CXCL13中和抗体显著抑制,强烈暗示CXCL13+成纤维细胞通过CXCL13-CXCR5轴招募B细胞聚集物的重要性。
值得注意的是,作者的研究还发现TLS相关的CD8_C8_CXCL13细胞簇是具有高干细胞基因表达的干细胞样CD8+ T细胞,包括在NPC中表达的TCF7,这是在其他肿瘤中报告的干细胞样CD8+ T细胞的标志[63]。这种干细胞样CD8+ T细胞存在于肿瘤中,并且在响应ICB时促进肿瘤控制[63,65]。
值得注意的是,作者发现TLS中的CD8_C8_CXCL13细胞在TCA中分化为CD8_C11_HAVCR2细胞。这两个细胞簇共享大量的TCR克隆型,表明TLS中具有更高TCR多样性的CD8_C8_CXCL13 T细胞可能是持续补充效应T细胞库的自更新能力的前体耗竭T细胞。
细胞-细胞相互作用分析显示,B细胞可能与CD8_C8_CXCL13细胞相互作用,并在NPC的TLS中调节它们的活化和细胞毒性,这与其他癌症中的发现一致[45,46],表明CD8_C8_CXCL13 T细胞可能是响应TLS中B细胞呈现的肿瘤抗原的肿瘤反应性T细胞。
支持性证据显示,CD8_C8_CXCL13细胞的高比例是NPC患者更好生存和ICB响应的积极指标,正如在其他癌症中报告的那样[66-68]。这些发现表明TLS中的CD8_C8_CXCL13 T细胞是多种癌症中抗肿瘤反应效应T细胞的重要来源。
NPC肿瘤中CD8_C8_CXCL13 T细胞的比例相对较低(0%至11%),这可能限制了它们的抗肿瘤活性。
因此,作者假设通过富集CD8_C8_CXCL13 T细胞和从CD8_C8_CXCL13和CD8_C11_HAVCR2 T细胞中工程TCR的策略可以增强癌症治疗中 adoptive T细胞疗法的疗效。
总的来说,作者的研究揭示了TLS和TCA与肿瘤进展和免疫治疗响应相关的关键细胞组成和动态相互作用,在单细胞和空间分辨率下提供了见解,以理解TLS和TCA之间的交叉对话和免疫机制,并为癌症的治疗策略开发提供了依据。
此外,作者的研究确定了TLS相关的细胞类型(B系细胞、CD4_C8_CXCR5和CD8_C8_CXCL13 T细胞、CXCL13+ CAFs)和TCA签名(EBVhigh-TCA-wP)作为NPC预后和免疫治疗响应的生物标志物,证实了TLS对肿瘤发展的贡献。
鉴于EBV是一种DNA病毒,作者的发现也提供了关于由B细胞和病原体感染协调的TLS形成和功能在其他DNA病毒相关癌症中的见解,例如HPV+头颈癌、HPV+宫颈鳞状细胞癌、HBV+肝癌等,在这些癌症中TLS已被证明存在。
作者承认研究存在一些局限性。
首先,需要进一步阐明特定细胞参与TLS形成的分子机制,并且需要在大规模的独立队列中进行额外的验证,以应用于临床。其次,用于评估NPC免疫治疗响应的ST队列较小,未来的研究需要更大的队列来确认它们在临床上的意义。
在技术方面,用于FFPE样本的10x Visium平台依赖于RNA分子的探针捕获,不包括EBV基因的探针。虽然作者使用了交叉验证方法使用立体序列平台和EBER染色来验证EBV感染状态,但仅使用前100个差异表达基因签名准确定义EBV感染状态存在固有的局限性。
对于基于微流体的单RNA测序技术,处理多种细胞类型时可能存在偏差,例如大小、可追踪性和脆弱性,导致与免疫细胞和基质细胞相比,肿瘤细胞数量较少。






![[Redis][Set]详细讲解](https://i-blog.csdnimg.cn/direct/ce17d3baffe74718a5fc30b8504bf0b4.png)