小罗碎碎念
Science文献精析
今天精析的这一篇综述,于2022-01-07发表于Science,主要讨论了癌症中的三级淋巴结构(Tertiary Lymphoid Structures, TLS)及其在肿瘤免疫反应中的作用。

| 作者类型 | 作者姓名 | 单位名称(中文) | 通讯作者介绍 |
|---|---|---|---|
| 第一作者 | Ton N. Schumacher | 荷兰癌症研究所 | 通讯作者之一 |
| 通讯作者 | Daniela S. Thommen | 荷兰癌症研究所 | 通讯作者之一 |
通讯作者介绍:
- Ton N. Schumacher:Ton Schumacher是荷兰癌症研究所(Netherlands Cancer Institute)的研究员,他在癌症免疫学和免疫疗法领域有着深入的研究。Schumacher博士致力于理解肿瘤微环境中的免疫细胞如何影响癌症的发展和治疗反应,特别是在三级淋巴结构(TLS)方面的研究。
- Daniela S. Thommen:Daniela Thommen同样也是荷兰癌症研究所的研究员,她的研究重点在于肿瘤微环境中的免疫细胞,特别是T细胞和B细胞在癌症发展和免疫治疗中的作用。Thommen博士的研究有助于揭示如何通过调节肿瘤内的免疫反应来提高治疗效果。
文献速览
这篇文章探讨了癌症中的三级淋巴结构(TLSs)及其在肿瘤免疫治疗中的作用。
-
背景介绍:
- TLSs的定义与形成环境:TLSs是非淋巴组织中出生后形成的免疫细胞聚集,通常在慢性炎症(如自身免疫病、慢性感染和癌症)中形成。
- TLSs与肿瘤预后关系:大多数研究表明,TLSs的存在与肿瘤患者更好的预后和免疫治疗反应相关。
- TLSs的分子定义与特征:TLSs的结构和功能类似于次级淋巴器官(SLOs),但其形成的具体分子机制尚不完全清楚。
-
TLSs的形成驱动因素:
- 抗原识别与TLS形成:TLSs的形成与抗原识别有关,特别是在肿瘤微环境中。
- 免疫细胞与TLS形成:多种免疫细胞类型,包括T细胞、B细胞和树突状细胞,参与TLSs的形成。
- 局部微环境与TLS形成:肿瘤微环境中的细胞因子和趋化因子对TLS的形成有重要影响。
-
TLSs在肿瘤免疫中的作用:
- TLSs与适应性免疫反应:TLSs可能模拟SLOs的功能,促进抗原特异性免疫反应。
- TLSs对肿瘤细胞的影响:TLSs可能通过产生抗体或激活免疫细胞来抑制肿瘤生长。
- TLSs与免疫检查点阻断:TLSs的存在与免疫检查点阻断治疗的反应相关,可能作为治疗靶点。
-
TLSs的预后与预测价值:
- TLSs密度与生存率:TLSs的数量和密度与多种肿瘤类型的更好生存率相关。
- 基因表达谱与TLS预后:多个基因表达谱与TLSs的存在相关,显示出良好的预后价值。
- TLSs的异质性与临床意义:TLSs的异质性可能影响其预后价值,需要进一步研究。
-
TLSs作为治疗靶点的潜力:
- TLS诱导疗法的研究:通过局部表达TLS相关细胞因子和趋化因子,可以在动物模型中成功诱导TLSs。
- TLS功能增强的潜在策略:免疫检查点阻断可能增强TLSs的功能,促进肿瘤控制。
- TLS诱导疗法的风险与收益评估:需要仔细评估TLS诱导疗法可能带来的自身免疫毒性风险。
总的来说,文章强调了TLSs在肿瘤免疫中的重要性,并提出了未来研究的方向,以更好地理解和利用这些结构作为治疗癌症的潜在靶点。
一、绪论
多年的研究工作已证实,特定免疫细胞浸润在肿瘤病灶中的存在与多种癌症类型的预后改善相关(1-3)。
近年来,通过输注体外扩增的肿瘤内T淋巴细胞(TILs)(4)或通过阻断T细胞上的免疫检查点分子(5-7),增加了肿瘤特异性T细胞反应性,为T细胞免疫作为癌症生长修饰因子的角色提供了因果证据。
进一步地,观察到活跃的免疫细胞浸润与免疫检查点阻断(ICB)的反应相关(8-11),将这两条研究线路统一起来。尽管上述数据支持在癌症病灶中常规评估免疫细胞浸润,但有越来越多的证据表明,不仅免疫细胞的存在,其定位和相互作用的分析也能提供额外的信息。
首先,一个相对直接的精细化方法是依据T细胞在肿瘤边缘或肿瘤实质中的位置进行分类(9)。如预期的那样,肿瘤实质中T细胞的存在与改善的临床结果相关,但这究竟反映了那些具有持续肿瘤特异性T细胞反应的肿瘤对T细胞的吸引力增加,还是其他癌症中T细胞的主动排斥,仍然是一个重要的未解之谜。
除了肿瘤内免疫细胞的位置,肿瘤内免疫细胞浸润的聚集性似乎也具有相关性。
以乳腺癌为例,一项分析发现具有相似免疫细胞浸润的肿瘤显示出不同的空间分布,被称为混合性和分隔性组织(12)。重要的是,分隔性组织,即免疫细胞群和癌细胞群物理分离,与增加的生存率相关,独立于TIL密度。
尽管在这项研究中,预后潜力并未正式与三级淋巴结构(TLSs)的存在相关联,但其他近期研究已报告在多种人类恶性肿瘤中,TLSs在癌症病灶中的存在与改善预后(13,14)以及ICB的反应(15-17)相关。
总的来说,这些观察结果提示,肿瘤中免疫细胞浸润的存在以及肿瘤浸润免疫细胞在TLSs中的组织可能都至关重要。
未来几年需要进一步解决的问题主要涉及导致癌症中TLS形成的分子过程、存在的癌症相关TLS的类型,以及它们的存在对肿瘤特异性免疫的生成或维持的影响。
二、癌症中免疫细胞浸润的组成与组织结构
三级淋巴结构(TLSs),有时也被称为三级淋巴器官或异位淋巴结构,是在非淋巴组织中出生后形成的免疫细胞的有组织聚集体。
TLSs在生理条件下不存在,但在慢性炎症环境中形成,例如在自身免疫性疾病(18)、异体移植排斥(19)、慢性炎症(20)和癌症(14, 21)中。
TLSs已在多种癌症类型中被报道,如非小细胞肺癌(NSCLC)、结直肠癌(CRC)、卵巢癌和黑色素瘤(22–26)。TLSs的发生可能在癌症类型之间有所不同,但使用现有数据集,其中使用了多种不同的标记物来识别TLSs,因此直接的比较尚未可能。
TLSs的特征是CD20+ B细胞组成的内区,周围环绕着CD3+ T细胞,类似于次级淋巴器官(SLOs)中的淋巴滤泡(14, 27)。尽管TLSs的具体组成可能有所不同,但在T细胞区室中,CD4+ T滤泡辅助(TFH)细胞通常是主导的细胞亚群(28),但也可以存在CD8+细胞毒性T细胞、CD4+ T辅助1(TH1)细胞和调节性T细胞(Tregs)(24, 29, 30)。
虽然B细胞和T细胞群体构成了TLS相关免疫细胞的大部分,TLSs还包含不同的树突细胞(DC)群体,例如,CD21+滤泡树突细胞(FDCs),它们起源于间质细胞,在SLOs的生发中心(GC)反应中选择记忆B细胞起着关键作用(25, 31),或者主要位于T细胞区的CD83+成熟DCs [在某些研究中也描述为树突细胞-溶酶体相关膜蛋白(DC-LAMP)+ (24)]。
滤泡中还可以包含散布的CD68+巨噬细胞,以清除凋亡细胞,类似于它们在SLOs中的作用(33)。类似于由滤泡网状细胞(FRCs)在SLOs中形成的致密基质网络,将TLSs锚定在慢性炎症组织位点(34)。最后,外围淋巴结地址素(PNAd)阳性高内皮静脉(HEVs)提供了与TLSs相关的特殊血管,据认为介导淋巴细胞的招募(31)。
最近,描述了癌症中另一种有结构的免疫细胞浸润(35)。
具体而言,肾细胞癌中的肿瘤内免疫或抗原呈递细胞(APC)生态位被定义为小型、APC密集区域,每10,000 mm2超过五个MHC II+细胞,这些区域含有对肿瘤反应的干细胞样CD8+ T细胞,这些细胞在小鼠模型中是持久免疫治疗反应的关键介质(36–38)。
值得注意的是,APC生态位的缺失与肿瘤进展相关,这与这些结构可能在维持肿瘤控制中发挥关键作用的可能相一致。尽管APC生态位与TLSs不同,后者由更大、组织良好的聚集体组成,密集填充着B细胞和T淋巴细胞,但目前尚不清楚APC生态位是否可能反映TLS形成的非常早期阶段。
三、三级淋巴结构(TLSs)形成的驱动因素
次级淋巴器官(SLOs,包括淋巴结、脾脏、扁桃体、派尔斑和黏膜相关淋巴组织)遍布全身,以允许从不同组织中提取抗原,从而促进适应性免疫反应的诱导。
在持续的慢性炎症环境中,淋巴结外淋巴组织的播种发生,导致器官位点形成TLSs。
为了理解这种TLSs的发展,将其与胚胎发育期间SLOs的形成进行对比可能是有用的。SLOs的播种和组织,特别是淋巴结和派尔斑,是由一系列高度有序的事件构成的,这些事件涉及造血细胞和非淋巴基质细胞之间的相互作用,其中细胞因子、趋化因子、粘附分子和生存因子作为分子成分起着关键作用(39, 40)。
SLO的形成在胚胎早期由造血淋巴细胞诱导细胞(LTi细胞)在淋巴结原基的定植启动,这些CD4+ CD3− CD45+的天然淋巴细胞从胎儿肝前体细胞分化而来,并以表达RORgt和Id2转录因子为特征(41)。LTi细胞的聚集以肿瘤坏死因子(TNF)家族成员依赖的方式驱动SLO形成的初始步骤,其中淋巴毒素α1β2(LTa1β2)和一定程度上的TNF起着中心作用,如果没有LTi细胞或LTa1β2,淋巴结和派尔斑的形成都将受到阻碍(41)。
LTa1β2和TNF分别与其受体LTbR和TNFR1结合,从而促进粘附分子如血管细胞粘附分子1(VCAM1)、细胞间粘附分子1(ICAM1)、粘膜地址素细胞粘附分子1(MAdCAM1)和PNAd的表达,以及一系列被称为淋巴或稳态趋化因子的化学因子的产生,包括CC-趋化因子配体19(CCL19)、CCL21和CXC-趋化因子配体13(CXCL13)(39, 42)。
这些分子共同调节随后免疫细胞向淋巴组织的招募(42–44)和由HEVs(45–48)介导的血管化。最后,通过在CCL19+和/或CCL21+的FRCs和CXCL13+的FDCs的表达分隔,实现了新生淋巴滤泡的区室化,从而允许T细胞和B细胞区的形成(42, 49–51)。
值得注意的是,淋巴趋化因子的分泌也诱导了一个重要的正反馈回路,对维持淋巴生态位至关重要,因为通过CXCR5的信号传导,CXCR5在B细胞和LTi细胞上表达,被发现能诱导LTa1β2的表达(45)。TLSs在解剖上与SLOs相似,但在大多数组织中缺少周围囊(52)。这种缺乏封装可能允许其细胞成分直接接触周围组织,但这也使得TLS中的免疫细胞暴露于炎症微环境中的大分子。
尽管最初认为TLSs和SLOs的形成是由相同的分子因素诱导的,包括LTa1β2-LTbR信号传导和局部表达的粘附分子和淋巴趋化因子,但涉及的细胞成分至少部分是不同的,并且驱动TLS生成的触发事件仍然只有部分被理解。
此外,还描述了独立于淋巴毒素信号传导的TLSs的分子诱导剂(14, 27, 53;见下文)。重要的是,我们对驱动TLS形成的细胞和分子过程的大部分理解来自自身免疫疾病和慢性感染模型,因此在癌症组织中的TLS形成方面,这些疾病模型中的发现应被视为假设生成的。
关于TLSs的上游启动,目前尚不清楚是否需要真正的LTi细胞来启动局部间质,或者局部积聚的免疫细胞可以替代LTi细胞。
支持后一种假设的证据包括TH17细胞(54, 55)和天然淋巴细胞-3 [ILC3 (56)],它们与经典LTi细胞共享RORgt转录因子,以及效应器CD8+ T细胞和自然杀伤细胞(57, 58)、B细胞(59)和M1极化巨噬细胞(60),它们在异体移植排斥(54)、自身免疫(55)、慢性炎症(59, 60)或癌症(56, 57)的小鼠和人类设置中均被报道为潜在的LTi细胞替代者。
与SLO形成不同,TLS的诱导可能并不总是依赖于淋巴毒素,因为例如,T细胞产生的白细胞介素-17(IL-17)可以在微生物刺激下在小鼠基质细胞中诱导CXCL13和CCL19的表达,从而促进诱导的支气管相关淋巴组织(iBALT)的形成,这是一种在肺组织中形成的TLS类型(61)。
同样,LTa−/−小鼠中确实发展出淋巴聚集物,但这些结构没有显示出T和B细胞区的分离并且缺乏HEVs(62),因此可能不被认为是真正的TLSs。类似于假定LTi细胞在TLS生成中的作用,某些局部基质和免疫细胞群体可能充当替代的LTo细胞。
具体来说,正如在类风湿性关节炎患者的滑膜成纤维细胞中所显示的那样,淋巴毒素和TNF信号可以诱导组织驻留成纤维细胞产生淋巴趋化因子如CXCL13、CCL19和CCL21,以及生存因子包括BAFF、IL-7和APRIL(34)。在B16-OVA黑色素瘤模型中,一种内皮肿瘤相关成纤维细胞群体同样可以作为LTo细胞来诱导TLS形成(58)。类似地,脂肪细胞和血管平滑肌细胞的趋化因子分泌已被证明可以解释克罗恩病患者肠系膜脂肪组织和动脉粥样硬化动脉中的TLS形成(63, 64)。
关于不同SLO相关趋化因子在TLS形成中的作用,局部TLS形成在小鼠模型中可以被组织特异性表达的趋化因子如CXCL13(51)、CCL21、CCL19和CXCL12诱导(50),这表明这些下游趋化因子在SLOs和TLSs之间的重要性是共享的。值得注意的是,尽管每个趋化因子都能独立诱导TLSs,但它们各自的表达会产生具有稍有不同特征的结构(见下文)。如果位于炎症肿瘤组织中的细胞能够以淋巴毒素和TNF独立的方式产生这些趋化因子,那么可以预测TLS的形成不需要LTi细胞。
值得注意的是,多种肿瘤内T细胞亚群,包括乳腺癌中的TFH细胞(28)和NSCLC中的PD-1高表达CD8+ T细胞(65),以及卵巢癌中的巨噬细胞和B细胞(66)以及三阴性乳腺癌中的成纤维细胞(67),都表达CXCL13,这表明免疫和基质细胞可能能够作为LTo细胞并贡献于TLS的形成和/或维持。
除了LTi和LTo细胞之外,HEVs在TLS形成中发挥作用,因为它们可以通过表达血管地址素,调节淋巴细胞的进入并控制招募到淋巴组织的淋巴细胞的类型(68)。支持局部组织背景在决定TLS组成中作用的证据表明,在小鼠模型中,通过在不同组织中特异性表达不同的细胞因子和趋化因子,可以诱导具有不同特征的TLSs。
例如,组织特异性表达CXCL13诱导了缺乏FDC网络的B细胞聚集(51),而TNF和CXCL12表达则诱导了主要由B细胞组成的小淋巴细胞浸润,其中T细胞和,在后一种情况下,DCs很少(50, 69)。此外,尽管CCR7配体CCL19和CCL21都能诱导相似组成的聚集物,但CCL21表达诱导的结构更大、更组织化(50)。
不同人类癌症类型中检测到的TLS成分的差异也被报道过(21, 27, 70),例如,DC-LAMP+ DCs在NSCLC的TLSs中描述较多,而在其他癌症类型中较少(22, 24)。
此外,TFH细胞主要在乳腺癌的TLSs(28, 71)和最近在肉瘤(17)中被记录。
然而,重要的是要注意,目前可用的数据大多来自使用不一致的标记描述TLS成分的研究,目前缺乏使用相同参数的大型分析,因此无法对癌症中的TLS异质性进行严格的评估。
关于TLSs存在的特定类型的异质性,目前有相当多的证据表明TLSs成熟的不同程度。
基于它们与SLOs的结构相似性,NSCLC、肝细胞癌(HCC)和结直肠癌(CRC)中已定义了淋巴结构的三种成熟阶段。
最不组织的阶段由没有FDC的密集淋巴细胞聚集组成,缺乏真正的TLSs特有的分隔T和B细胞区。原发性滤泡样TLSs确实含有FDCs,但缺乏生发中心反应。相反,完全成熟的、二级滤泡样TLSs也显示出生发中心活动,可能反映了它们的全部功能能力。
除了支持不同类型TLSs存在的证据外,最主要的区别在于,尽管一些肿瘤对TLS形成具有许可性,而另一些则不具有。
了解肿瘤在何种条件下支持或不支持TLS形成是重要的。
TLSs在慢性炎症位点形成,并且有多个观察结果表明,它们的形成与这些位点上B和T细胞对抗原的识别有关。
例如,SLOs的生发中心形成对于生成高亲和力、寿命长的浆细胞和记忆B细胞至关重要(75),并且TLSs中的生发中心形成表明在这些结构中发生了类似的抗原识别过程。
在人类黑色素瘤和卵巢癌转移灶,以及原发性乳腺和胃食管癌中,已观察到微解剖TLSs中B细胞的克隆扩增、免疫球蛋白的体细胞突变和类转换,进一步证实了局部抗原驱动的B细胞反应的概念(76–81)。
TLSs的形成也与抗原特异性T细胞反应的存在相关。
具体来说,在NSCLC中,TLSs的数量与CD8+和CD4+ T细胞的克隆优势相关(82)。此外,在人类肺癌中,肿瘤反应性在一组寡克隆功能障碍的PD-1高表达CD8+ T细胞中富集,这些PD-1高表达T细胞主要在TLSs中观察到(65),这与TLSs中存在肿瘤反应性T细胞反应的假设一致。
值得注意的是,与TLSs相关的T细胞反应可能与TLSs的形成和维持有关,因为TLSs的数量在感染流感病毒的肺小鼠清除病原体后迅速下降(20, 85–87),或者在清除胃幽门螺杆菌感染的患者中下降(88)。
抗原识别与TLS形成之间的联系使得解释TLS存在与免疫检查点阻断(ICB)临床反应之间的关联变得复杂。
TLSs存在的肿瘤中的免疫浸润往往偏向TH1或细胞毒性效应器状态(89),表达与化学引诱(CXCL9、CXCL10、CXCL11)和细胞毒性(GZMB、GZMH、GNLY)相关的基因,并表达一系列免疫检查点分子(PDCD1、CTLA4、LAG3、HAVCR、TIGIT)(26, 90, 91)。
许多这些分子的表达是由(慢性)T细胞激活诱导的,这与抗原接触形成TLSs的假设一致。然而,TLSs的存在也可能促进这种TH1或细胞毒性效应器样反应,或者这两个过程都可能由共同的上游事件刺激。值得注意的是,Tregs被认为通过阻止HEV诱导和免疫浸润来阻碍TLS形成,这在小鼠纤维肉瘤模型中得到证明(84, 92)。
除了新兴证据表明肿瘤内T细胞反应的性质可能影响TLS形成外,确定肿瘤细胞固有特性如何影响TLS形成也将是有用的。Cabrita等人的工作没有观察到TLSs与肿瘤突变负担或特定驱动突变之间的关联(16),但进一步探索这种关系以及TLSs的存在与这些肿瘤细胞固有属性之间的关系,以及TLSs的成熟状态,将是非常重要的。
在乳腺癌中,已经获得了肿瘤细胞表达FOXP1作为其表达淋巴趋化因子的决定因素的证据(93)。尽管上述工作确定了影响肿瘤微环境中TLS形成的多个因素,但我们对于创造一个有利于或不利于TLS形成的局部微环境的具体分子决定因素的理解可能远未完成。
作为一个框架,我们将“限制性组织环境”与“不足的组织环境”区分开来,以区分TLS形成不会发生的情况。限制性组织环境是指TLS形成被主动抑制的环境,而不足的组织环境是指缺乏TLS形成所需的关键驱动因素,如抗原。
四、三级淋巴结构(TLSs)在调节肿瘤特异性免疫反应中的作用
由于TLSs在解剖上与次级淋巴器官(SLOs)相似,因此有观点认为TLSs在炎症组织位点上重现了SLOs的功能。
SLOs,特别是淋巴结,通过提供一种专门的环境,最大化细胞间接触,促进来自组织和血液中的抗原负载的抗原呈递细胞(APCs)与原始淋巴细胞的相遇,从而产生适应性免疫反应(45, 94)。
越来越多的证据表明,适应性免疫反应也可以在TLSs中产生或增强。与TLSs中的B细胞相关的主要效应功能是产生与疾病相关的抗体,这些抗体可以标记表达抗原的细胞进行调理、补体介导的溶解或抗体依赖性细胞毒性(95)。TLSs中的生发中心形成与几种自身免疫疾病的血清自身抗体浓度、疾病严重程度和器官功能降低相关,包括干燥综合征(Sjögren’s syndrome)、重症肌无力(myasthenia gravis)和桥本甲状腺炎(Hashimoto’s thyroiditis),这表明TLSs可能对疾病进展有潜在的贡献。
此外,TLSs中激活诱导的胞苷脱氨酶(AID)的检测,该酶驱动体细胞突变和类转换,以及BCL6的检测,该转录因子有助于生发中心的进入和晚期B细胞成熟,提供了TLSs中活跃的克隆增殖、等位基因转换和B细胞效应分化的证据(77, 99)。同样,与黑色素瘤中的其他肿瘤驻留T细胞相比,TLSs中的T细胞显示出激活标记的表达增加(15)。
一个重要未解决的问题是,TLSs主要是否用于重新激活或重新教育效应T细胞,或者它们是否主要支持原始T细胞的启动。
效应T细胞的招募在TLSs形成的最早阶段已被报道,尽管这可能也反映了这些效应T细胞在TLSs生成中的作用。此外,TLS相关的TH17细胞在实验性自身免疫性脑脊髓炎模型中可以获得TFH细胞的表型特征(55),这表明效应细胞群体的重新教育可能在TLSs中发生。
另一方面,非肥胖糖尿病小鼠的胰腺胰岛中,也描述了TLSs对原始T细胞的招募。值得注意的是,这些原始T细胞在原位发生增殖,与局部启动一致(100)。同样,在炎症性中枢神经系统中,TLSs被发现参与对内源性髓鞘肽的自反应性T细胞反应的局部启动(101)。
此外,使用缺乏淋巴结的LTa缺陷小鼠获得的证据表明,TLSs可以在没有SLOs的情况下诱导B和T细胞反应。这些小鼠在流感A感染清除时诱导了iBALT(102, 103)。此外,在这些小鼠中,对病毒抗原的T和B细胞反应在质量上与在淋巴结中启动的反应相似,但引起的免疫病理学较少(102, 104)。在修改过的安卡拉牛痘病毒模型中,阻断淋巴细胞从SLOs逸出后观察到对特异性抗原的T细胞反应的启动(87)。
此外,在小鼠黑色素瘤模型中,由TLSs驱动的肿瘤特异性T细胞反应在缺乏SLOs的情况下被识别,并导致免疫细胞浸润和肿瘤消退(105, 106)。综上所述,这些数据提供了令人信服的证据,表明TLSs可以在局部复制SLO的功能。
由于SLOs已经进化为高效产生抗原特异性适应性免疫反应的场所,人们可能会想知道在慢性炎症条件下,在感染或癌症的炎症组织位点复制淋巴样再生的过程有什么价值。
图1展示了TLS(三级淋巴结构)在促进抗肿瘤免疫反应中的潜在作用。

TLS在癌症组织中的存在可以通过以下几种方式支持抗肿瘤免疫反应:
-
速度(Speed):
- TLS可以在组织现场促进T细胞和B细胞的初始活化(priming),这可能缩短产生免疫反应的时间。
- 因为TLS的存在绕过了树突细胞和淋巴细胞在SLOs(二级淋巴器官)间的常规迁移,从而加快了免疫反应的启动。
-
效率(Efficiency):
- 形成局部的淋巴龛可能增加免疫反应的强度或广度,因为淋巴细胞在局部遇到相应抗原的可能性增加。
- 这种局部化的免疫反应可能更有效地针对肿瘤特异性抗原,从而增强免疫反应。
-
控制(Control):
- TLS相关的免疫细胞直接暴露于炎症组织环境中,这可能使得免疫反应能够针对特定的输出信号进行微调。
- 周围肿瘤组织产生的细胞因子和/或代谢因子可能通过影响TLS内的免疫细胞,进而影响免疫反应的性质。
-
存活(Survival):
- TLS的存在可能通过TLS相关细胞群体分泌的存活因子或效应T细胞反复遇到抗原呈递细胞(APC)来促进淋巴细胞的稳态和存活。
- 这种机制可能有助于在肿瘤微环境中维持有效的、长期的免疫反应,对抗肿瘤细胞。
总结来说,TLS在癌症组织中的形成和存在可能通过加快免疫反应的启动、提高免疫反应的效率和控制能力以及维持免疫细胞的存活,来增强机体对肿瘤的免疫反应。这些特性使得TLS成为癌症治疗中潜在的重要靶点,尤其是在免疫治疗策略的开发中。
五、三级淋巴结构(TLSs)的预后和预测潜力
TLSs与多种癌症类型的良好预后相关(27),并且TLSs的预后价值通常独立于TNM分期,例如在肺癌(110)、结直肠癌(74)和胰腺癌(111)中均有记录。
TLS密度及其组成部分,如TFH细胞、滤泡B细胞、DC-LAMP+成熟DCs和HEVs,已被证明与许多不同肿瘤类型的更好生存率相关(22, 111–113)。
此外,与TLSs相关的多种基因表达特征显示出积极的预后价值,包括卵巢癌中的浆细胞特征(29)、头颈部鳞状细胞癌中的TFH特征(114),以及与淋巴样趋化因子相关的各种基因特征,包括CCL5、CXCL9、CXCL10和CXCL13,在结直肠癌(26)、黑色素瘤(115)和乳腺癌(28, 116)中。
此外,TLSs在肿瘤中的存在通常伴随着免疫浸润的总体增加,例如在人类NSCLC和三阴性乳腺癌中已有报道(24, 117, 118)。最后,TLSs与活跃的肿瘤内CD8+ T细胞浸润的组合与仅CD8+ T细胞浸润的预后相比,与更好的预后相关(29, 119),这一观察结果被用作TLSs中产生的免疫反应质量优越性的论据。
尽管TLSs与许多癌症类型的良好预后相关,但它们的存在也与某些癌症类型的发展或进展相关(123–125)。
一些潜在的免疫抑制机制被提出来解释这一观察结果。首先,在TLSs中主要存在的Tregs的耗竭,在一种小鼠肺癌腺癌模型中改善了肿瘤控制,这表明TLS相关的Tregs可能抑制内源性抗肿瘤T细胞反应(124)。
其次,除了可能作为肿瘤特异性抗体的产生者外,TLS内的B细胞也可能抑制肿瘤特异性免疫,例如通过IL-10的分泌(126, 127)。此外,根据产生的抗体亚型和免疫细胞类型,肿瘤特异性抗体也可能通过抑制性Fc受体信号来抑制肿瘤特异性免疫反应(126)。
最后,TLSs被提出作为微环境,可能促进恶性细胞的转化和生长,基于观察到HCC祖细胞首先出现在TLSs中,然后逸出并形成肝脏肿瘤(125)。同样,在人类乳腺癌中,检测到肿瘤特异性抗体可能通过抑制性Fc受体信号来抑制肿瘤特异性免疫反应(126)。
尽管上述观察提供了TLS组成异质性影响其预后价值的证据,但直接证明“抑制性”TLSs促进肿瘤进展的证据仍然有限。现场特异性改变TLS特性的方法可以提供强大的方法来解决这种因果关系的问题。
一些最近的研究也提供了TLSs在免疫检查点阻断(ICB)治疗响应中的预测价值的证据。
具体来说,在黑色素瘤、肾细胞癌、软组织肉瘤和尿路上皮癌的预治疗活检中,TLSs和活跃的B细胞浸润与对PD-1或联合PD-1加细胞毒性T淋巴细胞相关蛋白4(CTLA-4)阻断的响应相关(15–17, 129)。同样,在黑色素瘤中,ICB响应者的预治疗活检中TLS成分,包括记忆样B细胞和浆母细胞样细胞,得到了富集(130)。
此外,主要在TLSs内定位的PD-1高表达功能失调CD8+ T细胞的存在与晚期NSCLC对PD-1阻断的响应相关(65)。有趣的是,TLSs的丰度与免疫细胞上的程序性细胞死亡配体-1(PD-L1)表达相关,但与肿瘤细胞上的表达无关(16)。在小鼠中,诱导TLSs的联合治疗也使对检查点阻断耐药的肿瘤对ICB敏感,并产生了效应和记忆T细胞(133),这表明TLSs要么直接贡献于ICB响应,要么报告了一个对ICB有利的肿瘤微环境。
有趣的是,对治疗中的肿瘤活检的分析还显示,ICB治疗也可以促进TLSs的形成。在高风险的黑色素瘤和尿路上皮癌中进行新辅助ICB后,响应患者的肿瘤中与TLS相关的B细胞数量相对于匹配的预治疗样本更高(15)。在探索新辅助PD-1阻断在NSCLC和PD1加CTLA-4阻断在尿路上皮癌的多个研究中,观察到在消退病变中TLSs的数量增加(134, 135)。
同样,ICB治疗增加了小鼠黑色素瘤模型中TLSs的数量和大小,这与优越的肿瘤控制相关(58)。考虑到TLSs促进抗原特异性T和B细胞反应的作用,可以推测ICB不仅增强了TLSs的形成,也增强了TLSs的功能。尽管与ICB影响TLSs功能一致的观察结果(15, 136, 137)存在,但证据仍然是间接的。对治疗后非常早期时间点(数小时到数天)的肿瘤空间分析,或者对ICB处理的体外人肿瘤培养的分析(138),应该有助于进一步了解这个问题。
综上所述,TLSs在癌症免疫监测和治疗中起着重要作用。它们的存在与多种癌症类型的预后改善相关,与ICB治疗的响应有关,并与T细胞和免疫检查点分子的表达有关。然而,我们对TLSs的形成机制和功能的理解仍然有限,需要进一步的研究来阐明TLSs在癌症免疫监测和治疗中的作用。
六、治疗诱导三级淋巴结构(TLSs)
鉴于TLSs与疾病结果的关联报道,诱导TLSs可能成为一种吸引人的治疗策略。
在小鼠模型中,通过组织特异性表达与TLSs相关的细胞因子和趋化因子,包括淋巴毒素(139)、TNFa(140, 141)、LIGHT(100)、CXCL13(51)、CCL21、CCL19和CXCL12(50),已证实了局部TLS诱导的可行性。
此外,在乳腺癌和神经内分泌胰腺癌的小鼠模型中,PD-L1阻断与抗血管生成治疗的结合导致肿瘤血管转化为HEVs,随后形成TLSs,增加CD8+ T细胞刺激,并破坏肿瘤(133, 142)。
独立于免疫检查点阻断(ICB)的TLS诱导已在人类癌症中观察到(图2),例如,在高危宫颈上皮内瘤变(CIN2/3)患者中,在抗人类乳头瘤病毒癌蛋白疫苗后,TLS形成和TLS克隆扩增可以在消退病变中观察到(143)。
图2探讨了癌症治疗策略对TLS(三级淋巴结构)形成的潜在影响。
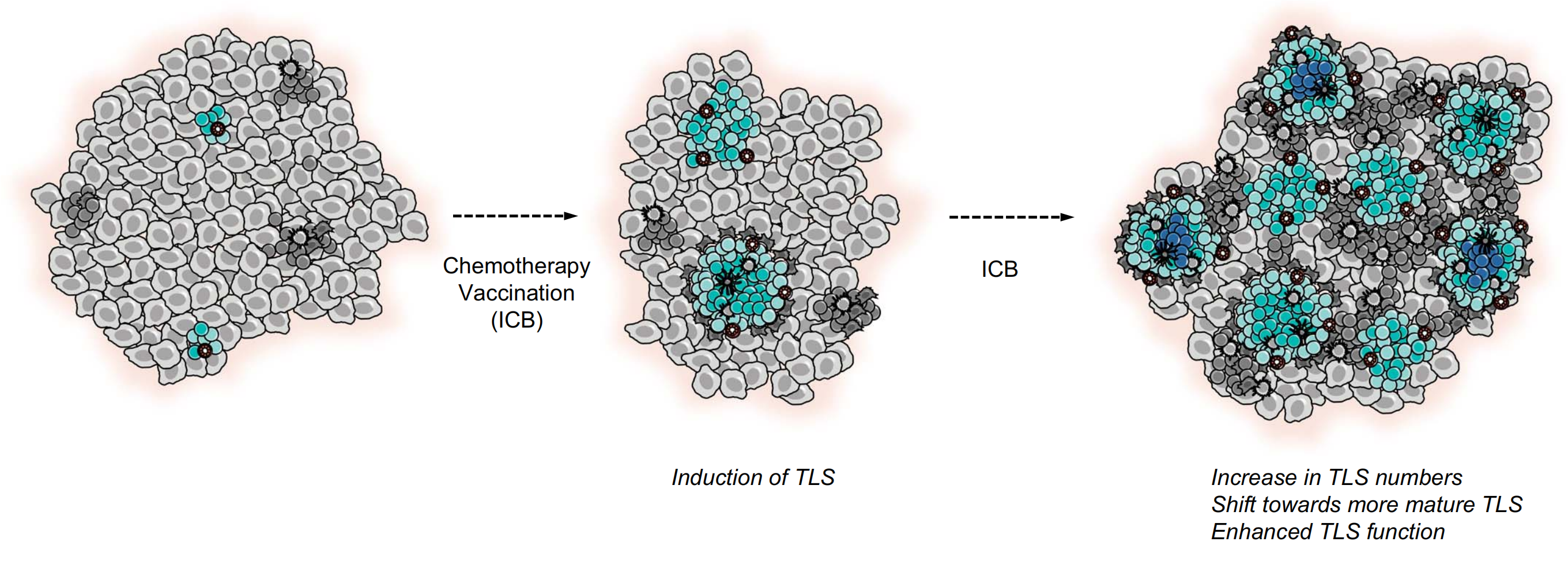
不同的治疗策略被发现可以诱导或增强癌症中的TLS形成:
-
新辅助化疗(Neoadjuvant Chemotherapy):
- 在非小细胞肺癌(NSCLC)和肝母细胞瘤(hepatoblastoma)中,新辅助化疗被证明可以促进TLS的新形成(de novo TLS development)。
-
癌症疫苗(Cancer Vaccines):
- 癌症疫苗被证明可以在胰腺癌和宫颈上皮内瘤变2/3级(CIN2/3)病变中促进TLS的形成。
-
免疫检查点阻断(Immune Checkpoint Blockade, ICB):
- 在多种癌症类型中,ICB被发现可以增加TLS的数量。
- 尽管ICB显示出增加TLS数量的能力,目前尚不清楚它是否也能诱导TLS的新形成。
- ICB还被认为可以通过促进效应T细胞和记忆T细胞的生成、T辅助滤泡细胞(TFH细胞)的激活,以及B细胞类别转换来增强TLS的功能。
-
TLS成熟(TLS Maturation):
- 基于上述观察,人们可以推测ICB也可能诱导TLS的成熟,尽管目前缺乏直接证据。
总结来说,图2强调了癌症治疗策略,特别是化疗和免疫治疗,对肿瘤微环境中TLS形成和功能的潜在调节作用。这些治疗策略可能通过增强TLS的形成和功能来改善抗肿瘤免疫反应,从而提高治疗效果。然而,需要更多的研究来直接证明这些治疗策略对TLS成熟的影响,以及它们是如何影响肿瘤免疫微环境和最终治疗效果的。
同样,用辐射的、异基因的粒细胞-巨噬细胞集落刺激因子分泌的胰腺肿瘤疫苗(GVAX)进行治疗性疫苗接种,结合环磷酰胺,在大多数胰腺癌患者中导致TLS形成(144)。值得注意的是,这些不同类型的疫苗接种后观察到的TLS诱导提供了强有力的证据,表明抗原特异性免疫反应的强度是决定人类疾病中TLS形成的决定因素。
关于常规疗法对TLS形成的效应,在新辅助化疗后观察到TLSs的形成,如非小细胞肺癌(NSCLC)(145)和与APC突变相关的肝母细胞瘤(146)。值得注意的是,在鳞状细胞肺癌中,新辅助化疗治疗导致TLS成熟受损和生发中心丧失(72)。
此外,在肺部和尿路上皮癌中,通常与化疗同时使用的类固醇治疗也观察到类似的结果(72, 135)。目前尚不清楚对TLS组织的负面影响是否取决于所使用的化疗类型或与类固醇的联合治疗。
一个重要因素是,尽管诱导或增强TLS功能可能改善肿瘤控制,但这种干预可能同时增强其他组织部位的自身反应性T和B细胞反应。
免疫检查点阻断后主要观察到的毒性是自身免疫反应,这些所谓的免疫相关不良事件类似于经常在自身免疫疾病中发现的炎症过程,包括关节炎、肌炎、甲状腺炎、血管炎和结肠炎(147)。考虑到TLSs在许多自身免疫疾病中支持局部炎症过程,可以推测增加TLS数量或TLS功能的方法也可能增加ICB诱导的自身免疫毒性。
尽管目前关于TLSs在免疫相关不良事件中的作用的数据很少,但已报告了TLS形成与PD-1阻断后自身免疫性肌炎的关联。具体来说,在接受抗PD-1治疗后出现肌痛和肌无力的患者的活检中,发现CD8+ T细胞驱动的肌肉组织破坏与表达PNAd和CCL21的TLS样结构形成相关(148)。
因此,诱导或增强TLS功能可能促进不仅抗肿瘤反应,而且自身反应性T和B细胞的扩张,因此,这些方法的风险-收益比需要仔细评估。
七、结论
最近的研究描述了TLSs在癌症中的预后和预测价值,激发了人们对这些结构作为潜在的抗肿瘤免疫调节剂的兴趣。根据现有证据,TLSs可能有助于增强肿瘤特异性免疫反应。然而,这是否主要涉及SLOs中产生的T细胞反应的增强,还是新T和B细胞反应性的发展,仍是一个关键未解决的问题。
同样,TLSs在肿瘤位点的存在为通过局部组织因子的作用产生质量上不同的免疫反应提供了明确的可能。然而,目前缺乏直接证据表明在TLSs中形成或增强的免疫反应具有独特的性质。尽管TLSs已在多种癌症类型中描述,并且其预后价值不容置疑,但使用一致的标记来定义和表征TLSs应成为未来关注的重点,以最大化这些结构作为潜在生物标志物的价值。
与此相关,对TLSs的更全面表征可能有助于根据细胞组成、位置、成熟度和功能等方面(图3)为“TLS状态”的定义提供一个范围。
图3讨论了如何通过一系列综合的分子参数来定义TLS(三级淋巴结构)的不同状态,以提高它们作为预后和预测生物标志物的价值。

以下是定义TLS状态时需要考虑的关键方面:
-
细胞组成(Cellular Composition):
- TLS由多种类型的细胞组成,包括不同的T细胞(如初始T细胞、细胞毒性T细胞、调节性T细胞、滤泡辅助T细胞)、B细胞(如初始B细胞、成熟B细胞、记忆B细胞、浆细胞)以及树突细胞等。
- 这些细胞的类型和状态可以反映TLS的功能和成熟度。
-
位置(Location):
- TLS可以在肿瘤的不同位置形成,如肿瘤内部(intratumoral)、肿瘤周围(peritumoral)或远离肿瘤的区域。
- TLS的位置可能影响它们与肿瘤细胞的相互作用以及它们对免疫反应的调控。
-
成熟度(Maturation):
- TLS的成熟度可以根据它们与二级淋巴器官(SLOs)的相似性来评估,包括是否有生发中心(germinal centers)、滤泡结构、以及是否存在特定的细胞如滤泡树突细胞(FDCs)和滤泡网状细胞(FRCs)。
- 成熟度不同的TLS可能在支持免疫反应方面有不同的效能。
-
细胞因子和趋化因子特征(Cytokines and Chemokines):
- TLS中的细胞因子和趋化因子环境对TLS的形成、维持和功能至关重要。
- 这些分子可以影响免疫细胞的招募、活化和分化,从而调节TLS内的免疫反应。
-
B细胞受体(BCR)和T细胞受体(TCR)库(Repertoires):
- TLS中B细胞和T细胞的受体库多样性反映了它们对肿瘤抗原的反应性和特异性。
- 通过分析BCR和TCR的克隆性、体细胞超突变(somatic hypermutation)和类别转换(class switching)等情况,可以了解TLS在抗肿瘤免疫中的作用。
-
激活诱导的胞嘧啶脱氨酶(AID):
- AID在B细胞的体细胞超突变和类别转换中起关键作用,是评估B细胞在TLS中活化和功能的一个重要指标。
-
细胞毒性T淋巴细胞(CTL):
- CTL在识别和杀死肿瘤细胞中发挥重要作用,它们的存在和活性可以反映TLS的抗肿瘤效能。
-
免疫球蛋白(Ig):
- 肿瘤特异性抗体的产生是B细胞的一个重要功能,分析TLS中的Ig可以提供关于B细胞反应和可能的免疫监视的线索。
综合这些参数可以更全面地理解TLS的状态,从而更好地利用它们作为生物标志物来预测癌症治疗的效果和患者的预后。
正如T细胞状态的定义帮助该领域更好地理解它们在癌症控制中的作用一样,TLS状态的分子定义可能会提高它们作为预后和预测标记的价值。最后,对TLS功能和它们潜在在自身免疫毒性中的作用的更详细理解,将有助于欣赏它们作为治疗靶点的价值。

















![2024Mysql And Redis基础与进阶操作系列(1)作者——LJS[含MySQL的下载、安装、配置详解步骤及报错对应解决方法]](https://i-blog.csdnimg.cn/direct/46749a9ae2bf431688491b937adcbbb2.png)