今天给同学们分享一篇生信文章“Identification of aging-related biomarkers and immune infiltration characteristics in osteoarthritis based on bioinformatics analysis and machine learning”,这篇文章发表在Front Immunol期刊上,影响因子为7.3。

结果解读:
数据处理
作者整合了三个滑膜数据集,包括GSE55235、GSE55457和GSE12021,共计29个正常滑膜样本和30个OA滑膜样本。作者对每个样本在消除批次效应前后的基因表达水平和主成分分析(PCA)进行了分析。
ARDEGs的鉴定和PPI分析
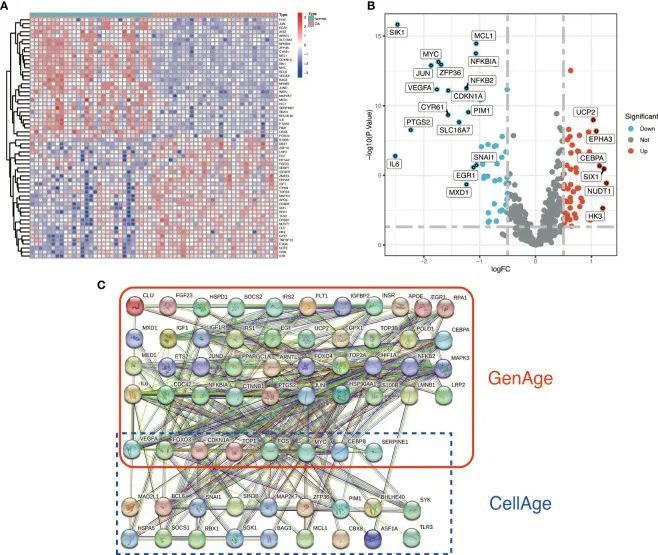
作者使用R包limma和筛选标准|logFC|>0.5和FDR<0.05,鉴定出了87个与衰老相关的差异表达基因(ARDEGs),其中32个基因在OA中上调,55个基因在OA中下调。附录材料的表S2中包含了差异表达的衰老相关基因的详细列表。热图和火山图被用来描述差异(图2A、B)。PPI蛋白质网络相互作用分析显示ARDEGs在蛋白质水平上密切相互作用(图2C)。
ARDEGs的功能富集分析
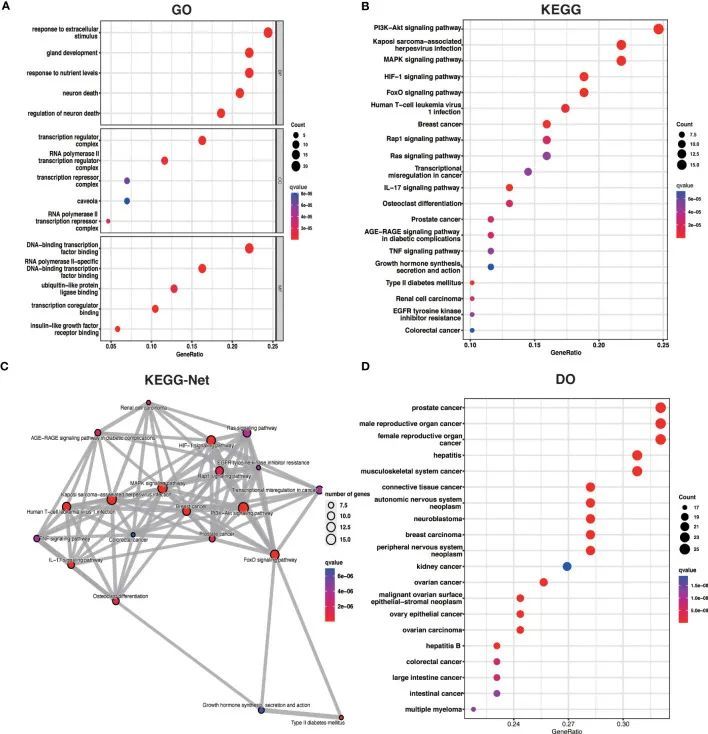
为了更好地理解OA中ARDEGs的潜在机制,作者使用R包clusterProfiler对ARDEGs进行了GO、KEGG和DO富集分析。GO富集分析显示,前五个ARDEG富集主要涉及对细胞外刺激的响应、神经元死亡、腺体发育、对营养水平的响应以及神经元死亡的调节。细胞组分(CC)和分子功能(MF)中的前5个富集项如图3A所示。此外,KEGG通路分析显示这些ARDEGs富集在HIF-1信号通路、FoxO信号通路、Kaposi肉瘤相关疱疹病毒感染、PI3K-Akt信号通路和MAPK信号通路中,并且这些通路之间存在密切的相互作用(图3B、C)。DO富集分析显示了与OA中ARDEGs具有相似致病机制的疾病类型,如前列腺癌、男性生殖器官癌、乙型肝炎、女性生殖器官癌和丙型肝炎(图3D)。表S4-S6显示了ARDEGs的GO、KEGG和DO富集的详细结果。
GSVA富集分析
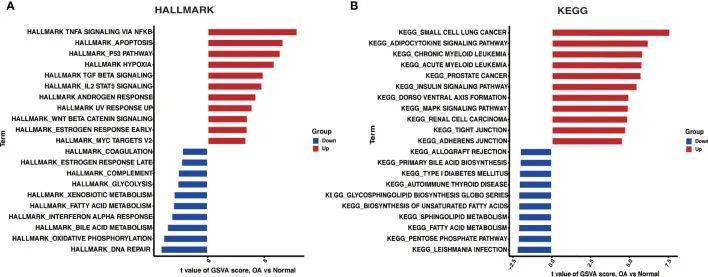
作者通过GSVA方法对OA中的HALLMARKS和KEGG通路富集进行了调查。根据HALLMARKS通路富集结果,与对照组相比,TNFA信号通过NFKB通路、细胞凋亡和P53通路在OA中显著上调。与此同时,DNA修复、氧化磷酸化和胆汁酸代谢都显著降低(图4A)。根据KEGG通路富集结果显示,前三个通路在OA中显著上调,分别是小细胞肺癌、脂肪细胞因子信号通路和慢性髓性白血病。相反,利什曼病感染、戊糖磷酸途径和脂肪酸代谢都显著下调(图4B)。
WGCNA
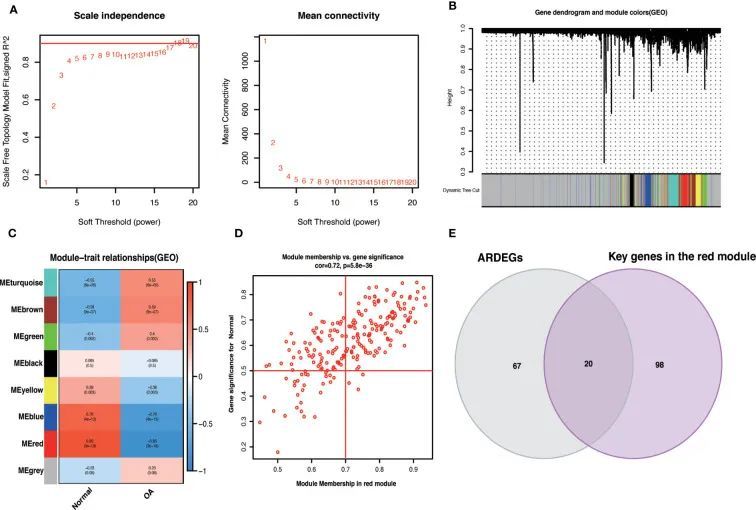
作者使用了R包WGCNA,将基因表达方差的前50%作为筛选条件,排除了不太稳定的基因,并使用6538个基因构建了共表达网络。选择了值为18的最佳软阈值(R 2 = 0.9),建立了一个无标度网络(图5A)。随后,使用聚类分析来识别高度相似的模块,最小模块大小设置为60。通过动态混合剪切,得到了八个基因模块,其中一个红色模块(217个基因)与OA具有最高的相关性(cor = 0.86; P = 3e-18)(图5C)。此外,红色模块内GS和MM之间存在很强的相关性(cor = 0.72; P=5.8e-36)(图5D)。选择红色模块中cor.MM>0.7和cor.GS>0.5的基因作为关键基因,并与ARDEGs相交,得到了20个具有OA-ARDEGs的基因(图5E)。数据集的共表达模块结果可以在补充材料中找到:表格S7。
OA-ARDEGs的相关性和富集分析
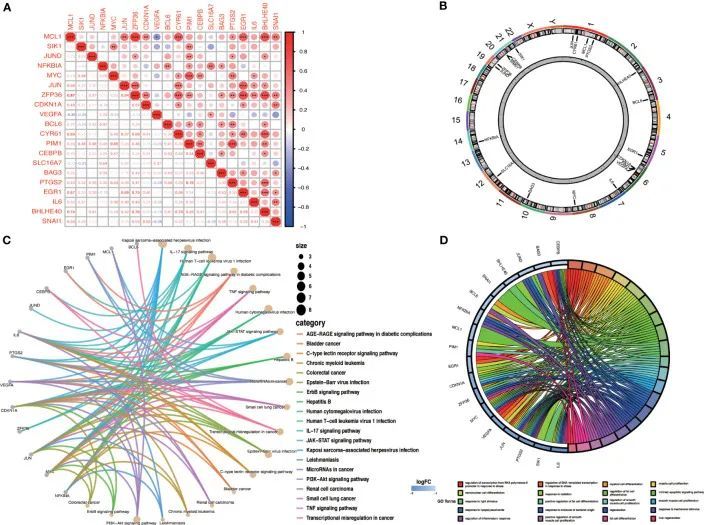
作者通过皮尔逊相关系数评估了OA-ARDEGs之间的相关性。发现MCL1与ZFP36(cor=0.87)和BHLHE40(cor=0.74)高度相关(图6A)。图6B显示了OA-ARDEGs的染色体位置。KEGG通路富集分析显示,OA-ARDEGs富集的前五个通路主要涉及Kaposi肉瘤相关疱疹病毒感染、IL-17信号通路、人T细胞白血病病毒1感染、AGER-AGE信号通路在糖尿病并发症中的作用以及TNF信号通路(图6C)。GO富集分析显示,OA-ARDEGs在生物过程中富集了对应于应激下的转录调控、应激下的DNA模板转录调控、髓系细胞(图6D)。
Hub OA-ARDEGs的识别和验证
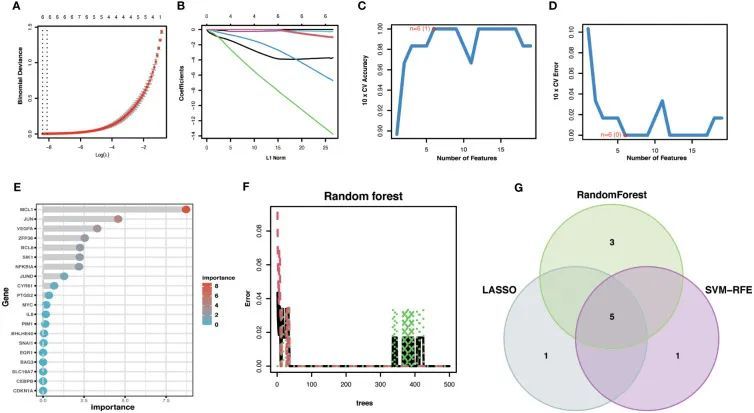
为了提高Hub OA-ARDEGs诊断OA的准确性,作者使用了三种机器学习算法,LASSO(图7A,B),SVM-RFE(图7C,D)和随机森林(图7E,F),来筛选OA-ARDEGs。在结合三种算法的结果后,共获得了五个Hub OA-ARDEGs,分别是MCL1,SIK1,JUND,NFKBIA和JUN(图7G)。
构建Hub OA-ARDEGs风险预测模型
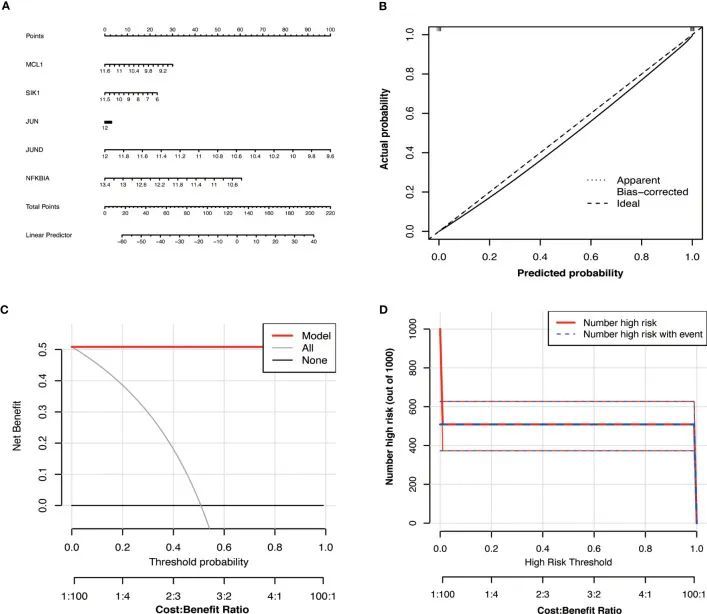
作者根据Hub OA-ARDEGs的表达开发了一个OA诊断图谱,以获得更具临床应用价值的OA诊断模型。通过构建临床校准曲线(图8B)、临床决策曲线(图8C)和临床影响曲线(图8D)来评估该模型,可以明确该模型对OA具有很高的预测能力。图谱中每个基因的得分准确预测了OA疾病的风险(图8A)。
Hub OA-ARDEGs表达和诊断价值
根据训练集和验证集中Hub OA-ARDEGs的表达水平,作者发现在所有OA滑膜样本中,Hub OA-ARDEGs明显下调(图9A-C)。ROC曲线分析显示,训练集中的5个Hub OA-ARDEGs和诊断图具有较高的OA诊断价值。MCL1和诊断图具有最高的诊断价值(AUC=1.000),其他基因的诊断价值如下:JUN(AUC=0.960),SIK1(AUC=0.955),NFKBIA(AUC=0.976)和JUND(AUC=0.968)(图9D)。图9E、F显示了外部验证集GSE1919和GSE89408的ROC分析结果。验证集中所有五个Hub OA-ARDEGs和诊断图的AUC均大于0.5。因此,这五个Hub OA-ARDEGs可以作为可靠的OA诊断生物标志物,并具有较高的诊断价值。
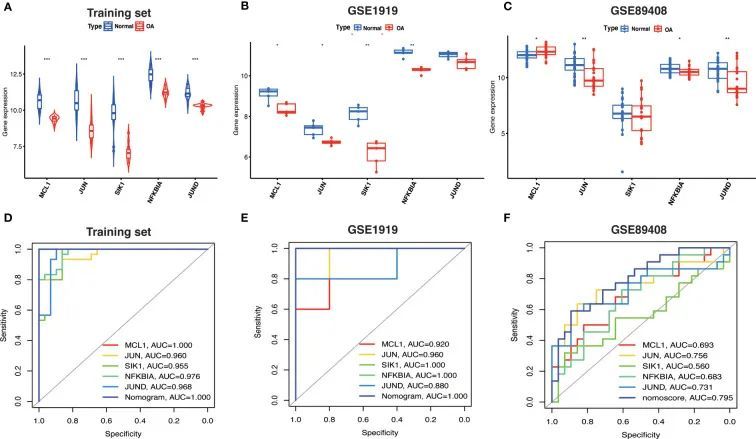
qRT-PCR
作者对六名半月板损伤患者和六名OA患者的滑膜总mRNA进行了qRT-PCR,以进一步验证Hub OA-ARDEGs的mRNA表达水平。结果显示,所有五个Hub OA-ARDEGs在OA滑膜样本中均显著下调(p值小于0.05),与训练集中的表达一致(图10A-E)。
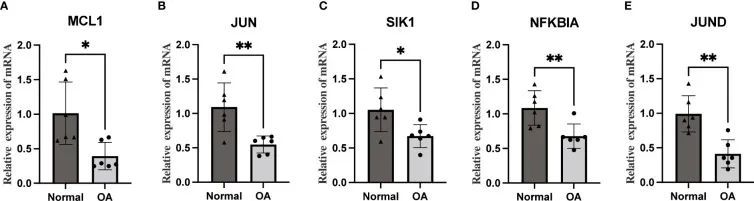
构建miRNA-TF-mRNA调控网络
通过预测Hub OA-ARDEGs上的miRNA和TF,作者使用Cytoscape(3.7.1)来可视化调控网络,其中包含80个miRNA,12个转录因子和5个基因,并获得了总共196个miRNA-TF-mRNA调控关系(图11)。
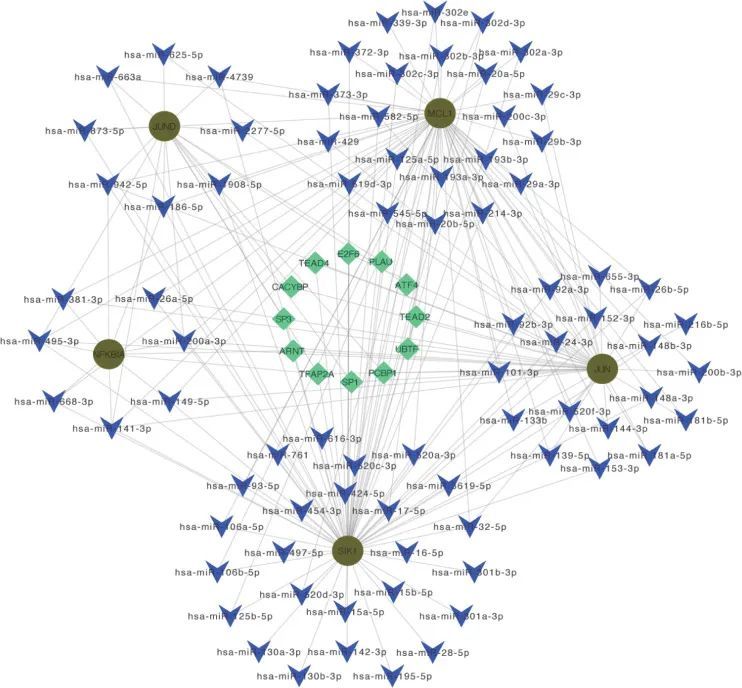
免疫浸润分析
作者使用ssGSEA算法发现,在OA样本中,激活的B细胞、未成熟树突状细胞、巨噬细胞、调节性T细胞、中央记忆CD4 T细胞、记忆B细胞和效应记忆CD4 T细胞的浸润水平显著增加。相反,嗜酸性粒细胞、第2型辅助T细胞和中央记忆CD8 T细胞在OA样本中的浸润显著减少(图12A、C)。作者应用Spearman相关分析免疫细胞之间的相互作用。结果显示大多数免疫细胞之间存在显著相关性,例如巨噬细胞和MDSC之间存在显著正相关(r = 0.89)(图12B)。OA样本中的检查点、HLA、副炎症、T细胞共抑制、T细胞共刺激、Type I IFN反应和其他免疫功能显著激活(图12D)。OA样本中HLA基因表达水平较高,包括HLA-DMA和HLA-DRA(图12E),这表明免疫反应在OA的发展中起着重要作用。JUND、JUN、MCL1、NFKNIA和SIK1与多种免疫细胞和免疫功能相关良好(图12F、G)。例如,JUN与激活的CD4 T细胞、2型T辅助细胞和aDCs呈正相关,与巨噬细胞、肥大细胞、记忆B细胞和检查点呈负相关。JUND与γδ T细胞和APC共抑制呈负相关。MCL1与自然杀伤T细胞、激活的CD4 T细胞呈正相关,与CD56明亮的自然杀伤细胞和APC共抑制呈负相关。NFKBIA与激活的B细胞、激活的CD8 T细胞等呈负相关。SIK1与中央记忆CD4 T细胞、中央记忆CD8 T细胞和细胞溶解活性呈正相关,与中性粒细胞、调节性T细胞、自然杀伤细胞、巨噬细胞、APC共抑制、II型干扰素反应和HLA呈负相关。
总结
总之,本研究初步探讨了OA滑膜组织中与衰老相关基因的潜在机制,揭示了滑膜衰老可能与免疫炎症密切相关。此外,五个中心节点OA-ARDEGs在OA的诊断能力方面表现出色,可能成为OA诊断和治疗的新靶点。然而,需要进一步的实验研究来支持作者的发现。