今天给同学们分享一篇生信文章“Polydopamine Nanoparticles Targeting Ferroptosis Mitigate Intervertebral Disc Degeneration Via Reactive Oxygen Species Depletion, Iron Ions Chelation, and GPX4 Ubiquitination Suppression”,这篇文章发表在Adv Sci (Weinh)期刊上,影响因子为15.1。

结果解读:
铁死亡在人类IVDD进展中起作用
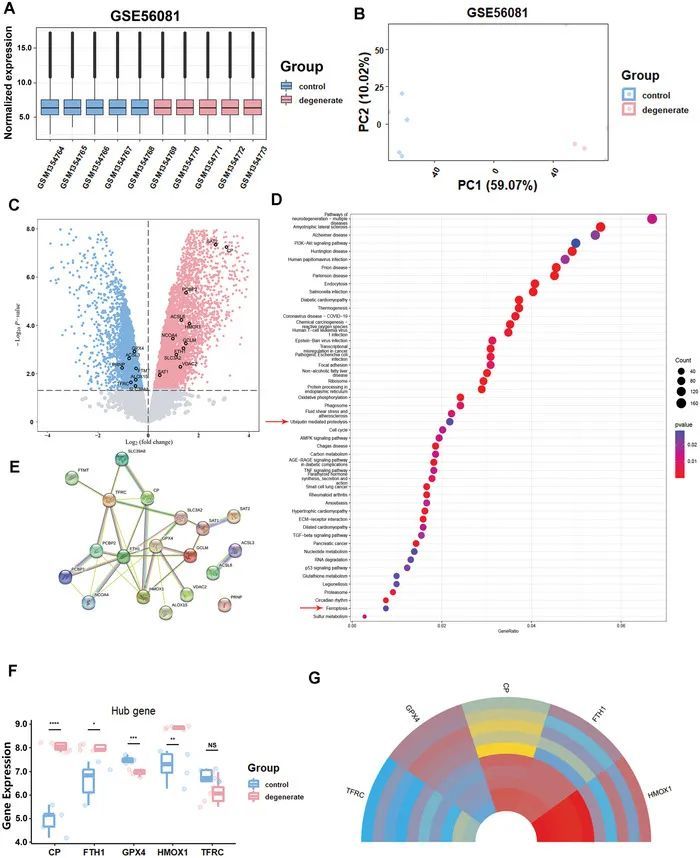
GSE56081表达矩阵已经被标准化,箱线图的分布趋势是直线(图1A)。主成分分析(PCA)分析显示了良好的重复性(图1B)。在P值<0.05的阈值筛选下,鉴定出GSE56081数据集中的7859个差异表达基因(DEGs)(4364个上调和3495个下调)。DEGs的火山图如图1C所示。通过进行基因组学百科全书(KEGG)分析,作者确定了参与IVDD的潜在通路(图1D)。功能分析表明,在多个炎症和炎症相关通路(肿瘤坏死因子(TNF)、腺苷5'-单磷酸(AMP)激活蛋白激酶(AMPK)和转化生长因子-β(TGF-β)信号通路)中,泛素介导的蛋白质降解和铁死亡在IVDD进展中起到了作用。因此,作者鉴定出了与铁死亡相关的DEGs。进一步的分析揭示了五个关键基因,包括铜蓝蛋白(CP),铁蛋白重多肽1(FTH1),GPX4,血红素氧合酶1(HOMX1)和TFRC(图1E,F),这五个基因的表达水平在一个环形图中可视化(图1G)。然后,这些基因的交互功能图在支持信息中的图中展示。为了进一步验证铁死亡在IVDD中的参与,还包括了GSE27494,并且KEGG通路富集的结果与GSE56081数据集的分析结果一致。此外,免疫组化(IHC)显示GPX4的蛋白表达水平降低,泛素显著增加在人类IVDD样本中。
PDA纳米颗粒的表征
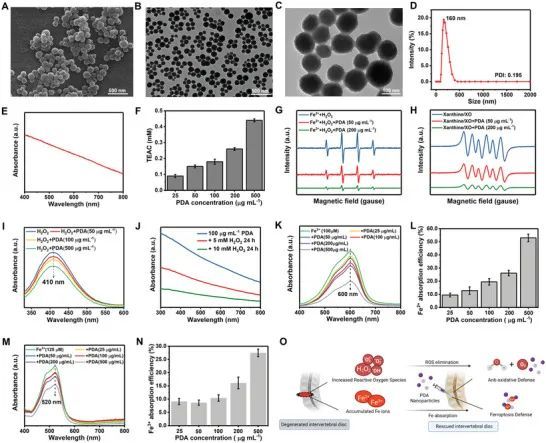
通过经典的Stöber方法进行了一些修改,制备了PDA纳米颗粒。制备的PDA纳米颗粒是均匀的球形颗粒,具有良好的分散性,这可以从扫描电子显微镜(SEM)和透射电子显微镜(TEM)图像(图2A-C)中看出。PDA纳米颗粒的平均流体动力学粒径约为160纳米,尺寸分布较窄,进一步表明纳米颗粒在水中具有良好的分散性(图2D)。PDA纳米颗粒的紫外-可见(UV-vis)吸收光谱显示在400-800纳米范围内有吸收峰(图2E)。通过使用已建立的2,2'-联氨基二(3-乙基苯并噻唑啉-6-磺酸)(ABTS)方法,初步研究了PDA纳米颗粒的抗氧化能力。ABTS可以被ROS氧化为绿色的ABTS+,而在存在抗氧化剂的情况下可以被抑制。评估ABTS+水平代表了样品的Trolox等效抗氧化能力(TEAC),结果显示TEAC值与PDA纳米颗粒的浓度呈正相关(图2F),表明PDA纳米颗粒具有抗氧化活性。抗氧化能力通过使用DMPO(5,5-二甲基-1-吡咯烷-氮氧化物)作为自旋探针,通过电子自旋共振(ESR)进一步验证了PDA NPs的ROS(•OH和O 2 •− )耗尽能力。如图2G所示,PDA NPs处理后,特征的DMPO/•OH信号呈浓度依赖性下降,说明PDA NPs的•OH清除能力。同样,DMPO/O 2 •− 的特征信号强度在PDA NPs添加后明显下降,而NPs浓度的增加可以进一步降低信号强度(图2H)。这个结果证明了PDA NPs的出色的O 2 •− 清除活性。然后,使用硫酸钛法评估了PDA NPs的H 2 O 2 清除能力。硫酸钛可以与H 2 O 2 反应,光谱法产生过氧化物-钛络合物,存在抗氧化剂时可以抑制其生成。如图2I所示,过氧化物-钛在410 nm处的特征峰随着PDA NPs的加入呈剂量依赖性减少,表明PDA NPs的浓度依赖性H 2 O 2 消耗。随着H 2 O 2 的消耗,与H 2 O 2 共孵育24小时后,PDA的浓度也下降,表明在ROS存在下PDA NPs具有可生物降解性(图2J)。
PDA纳米颗粒清除ROS并螯合Fe,以减轻体外NP细胞的铁死亡作用。
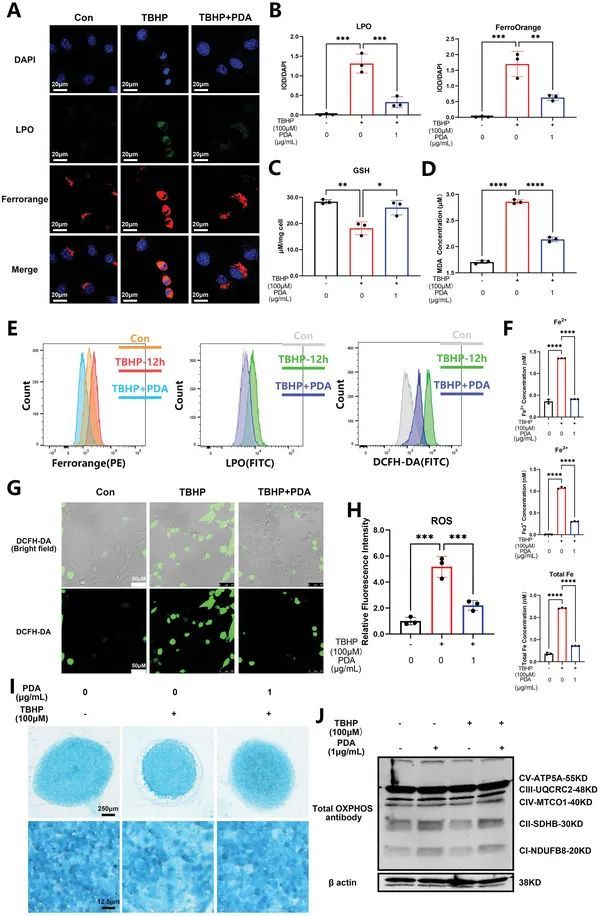
CCK8和细胞毒性测试显示,PDA纳米颗粒的安全浓度在0至1 µg/mL之间,在24至72小时内(IC 50 为3.748 µg/mL)。使用过去描述的t-叔丁基过氧化氢(TBHP)触发NP细胞的铁死亡,作者证实了PDA纳米颗粒(1 µg/mL)通过死/活细胞染色有效且显著地抑制细胞死亡,与TBHP组相比,TBHP+PDA纳米颗粒组的丙碘胺(PI)/卡尔西因比率较低,同时降低了脂质过氧化物(LPO)的产生和铁 2+ 的积累(图3A、B),基于LPO和FerroOrange测定。这随后抑制了TBHP诱导的丙二醛(MDA)产生(图3D)。LPO和FerroOrange的流式细胞术显示了类似的结果(图3E)。基于流式细胞术(图3E)和二氯二氢荧光素乙酸酯(DCFH-DA)探针(图3G、H),底层机制可能涉及PDA纳米颗粒对氧化应激的清除作用。PDA纳米颗粒可以螯合Fe 2+ ,从而抑制TBHP诱导的Fe 2+ ,Fe 3+ 和总Fe的上调(图3F)。最后,PDA纳米颗粒的给药还可以恢复谷胱甘肽(GSH)的产生(图3C),这可能是通过谷胱甘肽过氧化物酶(GPXs)酶调节的。为了抑制纳米颗粒细胞的铁死亡,作者观察到TBHP引起的分解状态在PDA纳米颗粒给药后显著减少(图3I)。考虑到线粒体失调是铁死亡最重要的现象之一,作者通过免疫印迹法监测了氧化呼吸链,并发现PDA纳米颗粒的给药增强了氧化磷酸化(OXPHOS)抗体的功能,并恢复了TBHP诱导的OXPHOS降低(图3J)。
PDA纳米颗粒抑制GPX4的泛素化作用以抑制体外NP细胞的铁死亡
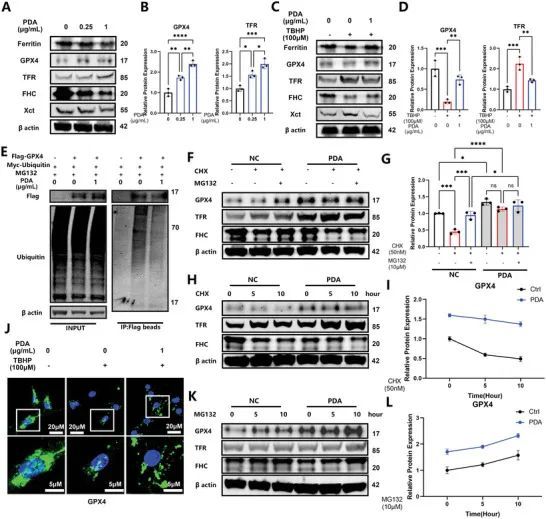
KEGG分析表明,泛素介导的蛋白质降解参与了IVDD(图1D)。因此,作者进一步研究了PDA NPs抑制铁死亡的分子机制,使用不同浓度的PDA NPs(0.25和1 µg mL −1 )。结果显示,铁蛋白、重链铁蛋白(FHC)和Xct的表达被下调(可能是铁螯合剂的结果),但GPX4和TFR的产量显著上调(图4A、B)。使用TBHP作为铁死亡触发剂,作者观察到PDA NPs通过下调TFR和Xct的蛋白水平,恢复GPX4、铁蛋白和FHC的蛋白水平,从而拯救了铁死亡(图4C、D),与Fth1、Tfrc和Slc7a11的mRNA水平一致。然而,作者没有观察到对GPX4的mRNA和蛋白水平产生类似的影响,这表明GPX4表达可能存在翻译后修饰的可能性。免疫荧光显示,PDA纳米颗粒有效恢复了TBHP下调的GPX4的表达(图4J)。GPX4通过泛素介导的蛋白酶体途径降解;因此,作者构建了Flag标记的GPX4和Myc标记的泛素用于后续的降解实验。使用293T细胞进行转染,作者发现GPX4被多泛素化,而PDA纳米颗粒的给药有效抑制了这种泛素化(图4E)。类似地,PDA纳米颗粒抑制了NP细胞中GPX4的泛素化。为了进一步确认这一发现,作者使用环己酰胺(一种蛋白质合成抑制剂,CHX,50 nm)和MG132(一种蛋白酶体抑制剂,10 µm)来探索GPX4的降解。在CHX组中使用CHX抑制GPX4的合成,在CHX+MG132组中使用MG132抑制泛素介导的蛋白质降解,作者发现GPX4的蛋白水平得到恢复,类似于CHX + PDA纳米颗粒组中的表达水平,表明PDA纳米颗粒能够有效对抗GPX4的降解(图4F,G)。相比之下,在这个过程中,TFR的表达没有改变,而且使用PDA NPs也无法拯救FHC(图4F,G)。使用CHX处理0、4和8小时后,GPX4被降解,但PDA NPs抑制了降解过程(图4H,I)。GPX4的蛋白水平增加,尤其是在MG132处理后的PDA NPs组(图4K,L)。有趣的是,作者发现PDA NPs不仅可以增加Tfrc的mRNA转录,还可以同时抑制TFR的泛素化。
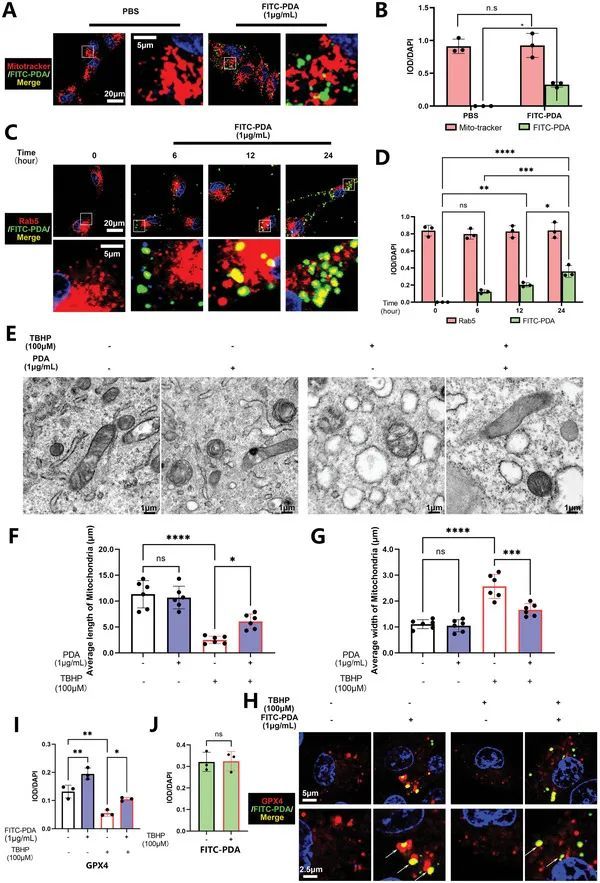
PDA纳米颗粒通过内吞作用被吸收,并在体外与线粒体和GPX4共定位于纳米颗粒细胞中。
接下来,作者构建了荧光异硫氰酸酯(FITC)标记的聚二氨基苯胺(PDA)纳米颗粒,以研究PDA纳米颗粒进入细胞质的机制,并追踪其在纳米颗粒细胞中的分布。通过免疫荧光技术,作者发现FITC-PDA纳米颗粒在细胞质周围分布,并主要与线粒体在纳米颗粒细胞中共定位(图5A、B)。随着FITC-PDA纳米颗粒处理时间从0到24小时的增加,作者发现FITC-PDA纳米颗粒的强度增加,并且与内吞作用标记物Rab5共定位(图5C、D)。此外,通过药物抑制内吞作用,如Pistop2和Hydroxy Dynasore,FITC-PDA纳米颗粒的强度减弱,表明FITC-PDA纳米颗粒通过内吞作用被细胞吸收。在被细胞吸收后,FITC-PDA纳米颗粒聚集在线粒体周围发挥保护功能。使用透射电子显微镜(TEM),作者发现TBHP刺激导致NP细胞线粒体扩张,并模糊了线粒体嵴,这是铁死亡线粒体的典型标志,长度减少,宽度增加 [ 31 ] (图5E)。相反,PDA纳米颗粒对线粒体具有保护作用(图5E),线粒体的平均长度增加,平均宽度减少(图5F,G)。此外,作者使用海马马鞭草测试分析NP细胞的氧耗率(OCR,线粒体呼吸)和细胞外酸化率(ECAR,糖酵解功能)。作者观察到PDA纳米颗粒对TBHP的有害影响产生拮抗作用,并恢复了基础和最大呼吸,但在OCR测试中没有保留呼吸能力。对于ECAR测试,PDA纳米颗粒减轻了增加的糖酵解能力、糖酵解和糖酵解储备。此外,作者观察到FITC-PDA纳米颗粒与GPX4共定位,并抑制其泛素介导的降解,导致其蛋白表达上调(图5H,I)。FITC‐PDA NPs在TBHP处理后的强度保持稳定(图5H,J)。
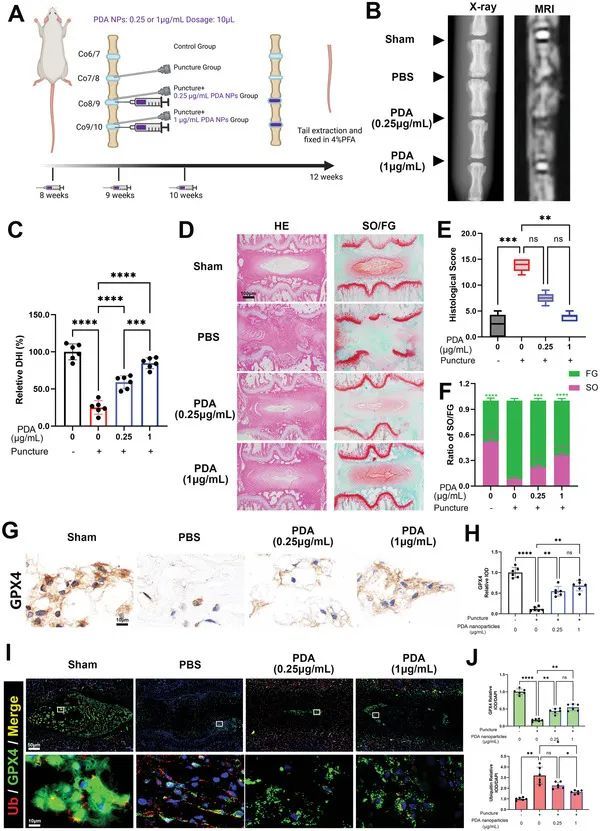
PDA纳米颗粒减少铁死亡,缓解大鼠IVDD,并在体内靶向GPX4泛素化。
为了进一步验证PDA纳米颗粒的功效,作者按照先前的描述,在大鼠中构建了一个经典的穿刺诱导退化模型。作者根据先前的研究,每周注射一次(图6A),观察到PDA纳米颗粒在48小时后降解了一半,在7至14天之间降解了近90%。此外,两种浓度的PDA纳米颗粒(0.25和1 µg mL −1 )能够有效减轻椎间盘的退化。主要表现为恢复失去的椎间盘高度和强度(图6B)。作者观察到,穿刺引起的相对椎间盘高度指数(DHI)的降低在PDA纳米颗粒治疗后显著增加(图6C)。通过组织学切片进一步评估组织学变化,作者发现Co7/8的椎间盘受到穿刺的严重退化,表现为髓核组织的丧失、椎间盘纤维化,甚至对生长板的软骨破坏(图6D)。PDA纳米颗粒的给药降低了组织学评分(用于评估退化程度;评分越高,退化越严重)(图6D、E)。此外,Safranin O-Fast Green(SO/FG)染色试验显示,PDA纳米颗粒抑制了纤维化形成(FG染色)和核心脱水物组织的丧失(SO染色),表现为IVD区域SO/FG染色比例的恢复(图6D、F)。免疫组织化学显示,穿刺后GPX4的表达减少,但PDA纳米颗粒的给药恢复了其表达,并且相对集成光密度(IOD)水平显著增加(图6G、H)。此外,使用免疫荧光双标记GPX4和泛素在盘片中,作者发现泛素的强度增加,GPX4的表达减少在穿刺诱导的退化组中(图6I、J),进一步导致铁死亡和盘片退化。然而,PDA纳米颗粒减少了泛素的表达,并恢复了盘片区域GPX4的强度(图6I、J),从而抑制了铁死亡并减轻了IVD的退化。为了进一步确认这个结果,作者从大鼠尾椎间盘中分离出蛋白质,并通过共免疫沉淀评估了GPX4的泛素化情况。作者观察到,在穿刺组中,GPX4水平下降,而泛素增加,但在经过PDA纳米颗粒处理的组(0.25和1 µg mL −1 )中,GPX4水平恢复,泛素略有下降。因此,PDA纳米颗粒在作者的体内泛素化实验中抑制了GPX4的泛素化。
总结
在这项工作中,PDA NPs给药提出了一种新的治疗椎间盘退变的靶向脱铁症的策略。体外研究表明,PDA-NP通过协同ROS耗竭、Fe2+积累减少,以及更重要的GPX4的泛素化抑制,协助细胞稳态维持,并拮抗氧化应激诱导的NP细胞脱铁性贫血。作者的研究表明,PDA-NP与GPX4相互作用进行翻译后修饰,探索这一机制为蛋白质-材料相互作用提供了新的见解,这将与进一步的研究相关。此外,它提供了一个新的脱铁症靶点,可以减轻椎间盘退变,有可能在未来为临床IVDD治疗做出贡献。