今天给同学们分享一篇生信文章“Comprehensive characterization of tumor microenvironment and m6A RNA methylation regulators and its effects on PD-L1 and immune infiltrates in cervical cancer”,这篇文章发表在Front Immunol期刊上,影响因子为7.3。

结果解读:
m6A甲基化调节因子在子宫颈癌症中表达不同
初步总结了21种m6A调节因子拷贝数变异和体细胞突变在宫颈癌症中的发生情况。289个样本中有46个样本发现了m6A调节因子的突变,突变频率为15.92%(图2A)。突变频率最高的是ZC3H13,其次是YTHDC2。此外,与13个正常组织和304个恶性组织相比,WTAP、KIAA1429、EIF3、IGF2BP1、IGF2BP2、IGF2BP3、RBM15、RBM15B、YTHDF1、YTHDF2、YTHDF3、HNRNPC、HNRNPA2B1和ALKBH5在宫颈癌症肿瘤组织中具有高表达。METTL3、METTL14、METTL16、YTHDC1、YTHDC2和ZC3H13在肿瘤组织中的表达水平显著更高(p<0.05,图2B、C)。研究结果表明,m6A调节因子可能在癌症的生物学发展中发挥作用。

m6A RNA甲基化调控因子的相关性及功能富集
使用STRING数据库创建了PPI网络,以更好地了解21个m6A甲基化调节因子之间的相互作用。作者发现,在消除了所有没有连接的分离元素后,PPI网络包括21个节点和111条边(图3A)。发现相互作用网络中的关键基因为KIAA1429、METTL14和METTL3(图3B)。这些基因在mRNA代谢过程调节、mRNA稳定性调节、RNA稳定性调节、mRNA分解代谢过程调节和RNA修饰中高度富集(图3C)。此外,作者发现大多数m6A RNA甲基化调节因子与METTL14呈正相关,METTL14与EIF3A的联系最强(图3D)(r=0.74)。

m6A甲基化调节因子的一致亚型与癌症患者的临床特征显著相关
基于m6A调节因子的表达水平和模糊聚类测度的比例的相似性,确定k=2在k=2~9之间具有最佳的聚类稳定性。根据m6A调节因子的表达水平,将304名癌症宫颈癌患者分为第1组和第2组(N1=152,N2=152)(图4A)。结果显示,m6A甲基化调节因子在亚型1中的表达水平高于亚型2(图4B)。此外,对亚型1和亚型2的临床前景进行了比较。WHO分期和分级在两组之间有显著差异(p<0.05,图4B)。

PD-L1和m6A甲基化调节因子之间的校正
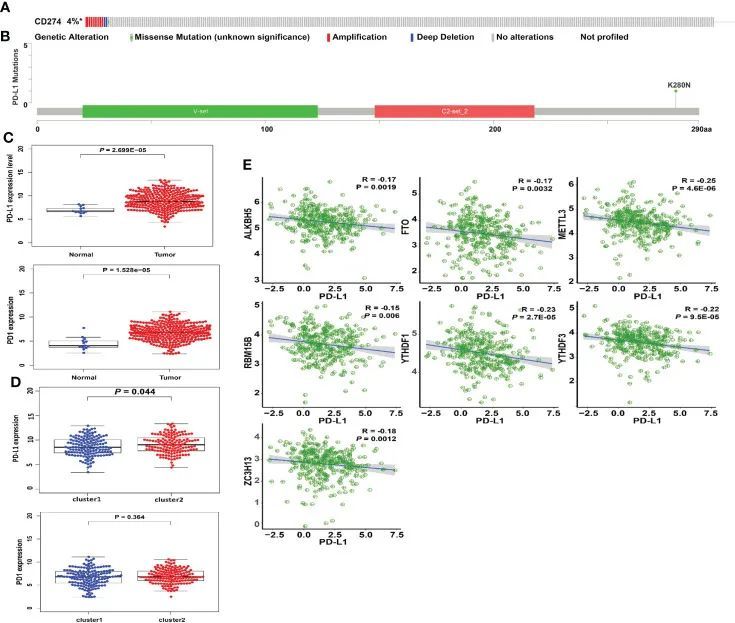
使用cBioPortal平台研究宫颈癌症中PD-L1突变的类型和频率。PD-L1在4%的宫颈癌症患者中发生突变,包括错义突变、扩增和深度缺失(图5A)。扩增在子宫颈癌症中占PD-L1变化的绝大多数。使用棒棒糖图对宫颈癌症患者的PD-L1突变位点进行可视化(图5B)。作者评估了肿瘤样本和对照组、亚型1和亚型2以及高风险组和低风险组之间PD-L1表达的差异,以确定PD-L1和m6A调节因子之间的联系。在子宫颈癌症样本中,PD-L1的表达远高于正常周围组织(图5C,p<0.001)。PD-L1在亚型1和亚型2中的表达差异具有统计学意义(图5D)。此外,ALKBH5、FTO、METTL3、RBM15B、YTHDF1、YTHDF3和ZC3H13均与PD-L1呈负相关(p<0.01,图5E)。
不同免疫细胞浸润与m6A甲基化调节因子的相关性
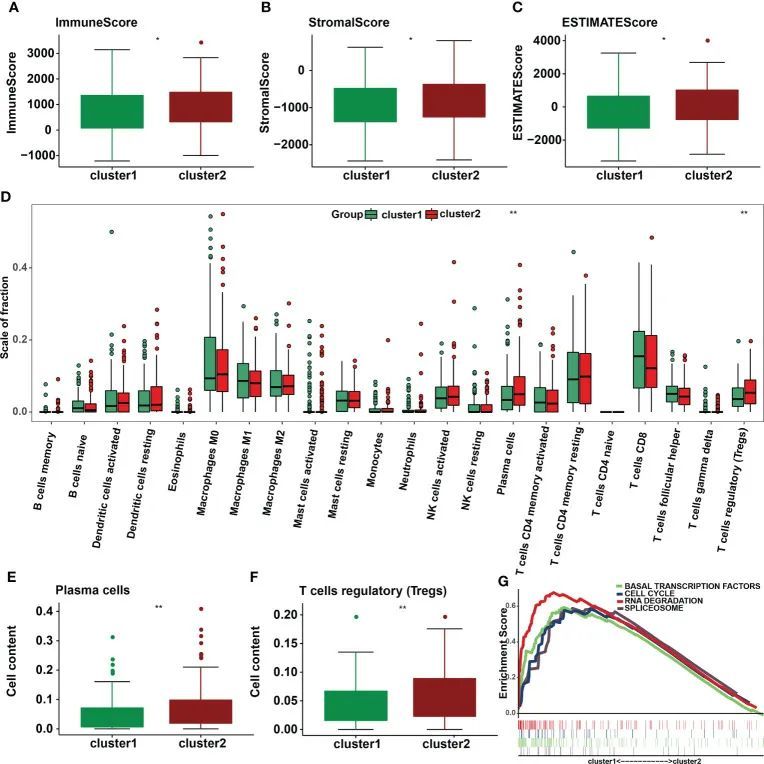
免疫细胞和基质细胞是TIME的两个重要的非肿瘤成分。为了研究宫颈癌症中m6A调节因子与时间之间的关系,作者对每个样本中的免疫细胞(图6A)和基质细胞(图6B)进行了评分,并将这两个评分相加,得出总的估计得分(图6C)。肿瘤纯度越低,总分越高。根据作者的研究结果,第2组的免疫评分、stromalscores和估计评分均较高(p<0.05)。然后比较第1组和第2组22种免疫细胞亚型的浸润水平(图6D)。亚型2具有更大量的浆细胞(p=0.0028)和Treg(p=0.0051)浸润(图6E,F)。利用GSEA来确定导致亚型1和亚型2之间时间差异的潜在调节机制。最后,研究结果表明,亚型1与基础转录因子、细胞周期、RNA降解和剪接体有关(图6G)。
m6A甲基化调节因子信号的准确预后预测
接下来使用单变量Cox回归分析研究这21种m6A甲基化调节因子对癌症宫颈癌的预测功效。然后,识别出三种m6A调节因子:METTL16、YTHDF1和ZC3H13。LASSO技术用于计算每个预后基因的系数(图7A、B)。选择三种m6A调节因子(METTL16、YTHDF1和ZC3H13)作为构建预测特征的最低标准,并确定每个癌症宫颈患者的风险评分。然后根据患者的中位风险评分将其分为高风险组和低风险组。此外,Kaplan–Meier曲线分析显示,高危组的预后比低危组差(图7C)。随后,建立了一条与时间相关的ROC曲线,以评估与m6A甲基化调节因子相关的预后信号的特异性和敏感性。3年、5年和10年时,三个风险特征的AUC分别为0.666、0.712和0.784(图7D)。三种风险特征显示了对癌症宫颈癌预后的良好预测能力。此外,作者使用TCGA-CESC队列进行单变量和多变量Cox回归分析,以确定基于预后标志物的风险评分是否是宫颈癌症患者的独立预后指标。单因素分析显示,风险评分(p=0.002,HR=5.03)、肿瘤分期(p=0.001,HR=1.515)、T分期(p=0.006,HR=1.436)、M分期(p=0.005,HR=3.175)和N分期(p=0.004,HR=2.627)与OS显著相关,随后的多变量Cox回归分析表明,风险评分(p=0.001,HR=7.830)和N分期(p=001,HR=3.640)(图7E,F)是癌症的独立预后因素。

风险与癌症的临床特征有关
在癌症研究中进一步研究了风险评分与临床特征以及集群亚组之间的关系(图8A)。METTL16(p=1.1E-08)在高危人群中含量更高(图8B)。YTHDF1(p=3.4E-10)和ZC3H13(p=2.4E-15)在高危组中的表达显著较低(图8C,D)。此外,PD-L1和风险评分均无统计学意义(图8E)。就癌症的生存阶段而言,高危组和低危组之间存在显著差异(图8A)。还研究了风险评分与免疫核心、集群、TNM分期、分级、HPV分期、顺铂使用和肿瘤大小之间的关系(图9A-G)。尽管免疫评分和风险评分的差异并不显著,但高免疫评分组的中位风险评分高于低免疫评分组(图9A)。此外,在1/2组(图9B)、TNM分期(图9C)、分级(图9D)、HPV分期(图9E)和顺铂使用(图9F)中未检测到统计学显著差异。数据表明,治疗后,患有肿瘤的癌症患者的风险评分明显高于无肿瘤患者(p=0.002,图9G)。TMB和m6A调节因子之间的关系也在作者的研究中进行了研究;然而,在高TMB组和低TMB组之间,没有发现免疫核心、PD-L1表达、风险评分或聚类的统计学显著差异。这些数据表明,癌症患者的风险评分可能对临床结果有显著影响。


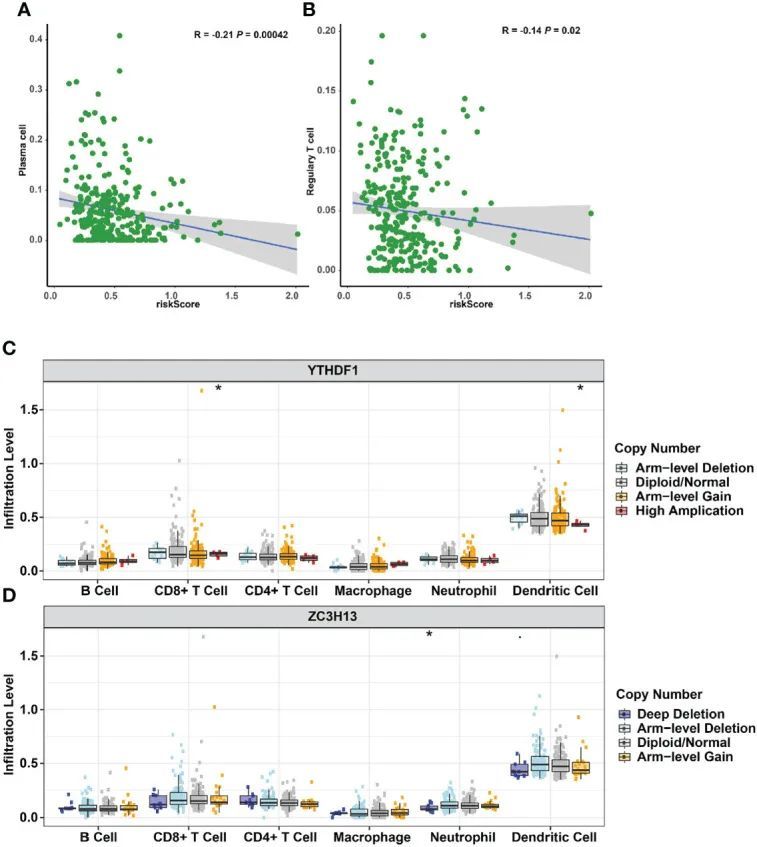
m6A调节信号基因改变与免疫细胞浸润的关系
通过检查22种免疫细胞类型的风险评分与浸润程度之间的联系,评估三种m6A甲基化调节因子对宫颈癌症时间的影响。风险评分与浆细胞浸润(p=4.2E-4,图10A)和Treg浸润(p=0.02,图10B)呈负相关。宫颈癌症时间与基于m6A调节因子的风险特征相关。此外,还研究了基于m6A调节剂信号的体细胞CNA对免疫细胞浸润的影响,以初步阐明风险评分和多种免疫细胞渗透的潜在机制。子宫颈癌症中CD8+T细胞、树突状细胞和中性粒细胞的浸润受到检测到的m6A调节信号CNA的显著影响,包括臂级缺失、双倍体/正常、臂级增加、高扩增和深度缺失(图10C,D)。这项研究进一步证明了m6A甲基化调节因子在宫颈癌症患者的时间中起着重要作用。
宫颈癌症组织和细胞中m6A与PD-L1的相关性研究
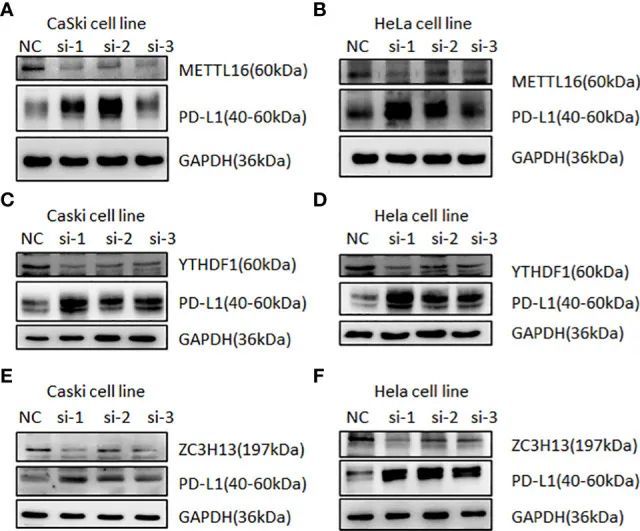
在人类子宫颈癌症组织中,与周围正常组织相比,PD-L1、METTL16、ZC3H13和YTHDF1在子宫颈癌症患者中高表达(图11)。此外,两种癌症细胞系中METTL16、YTHDF1或ZC3H13的下调提高了PD-L1的表达(图12)。本研究表明,METTL16、YTHDF1和ZC3H13可调节PD-L1在癌症中的表达。

总结
总之,该研究着眼于m6A RNA调节因子在宫颈癌症中的表达、它们与PD-L1的关系以及推定的调节机制。使用m6A调节因子的一致聚类来评估TIME中免疫细胞浸润程度的差异。m6A调节因子可以通过调节TIME和PD-L1的表达来促进癌症宫颈患者的免疫治疗反应。更重要的是,作者创建了一个包含三个m6A RNA甲基化基因的预后标志物,并将风险评分确定为宫颈癌症队列中的一个独立预后因素,这表明预后标志物是预测癌症患者生存结果的可行工具。