今天给同学们分享一篇生信文章“Novel Implication of the Basement Membrane for Breast Cancer Outcome and Immune Infiltration”,这篇文章发表在Int J Biol Sci期刊上,影响因子为3.5。

结果解读:
建立骨髓评分的预后骨髓基因选择策略
通过BM基因集和研究中使用的三个数据集的交集,作者获得了203个BM基因(图1A)。然后,从数十个候选中,作者进行了差异表达分析(|log2FC|>1和FDR<0.05),获得了77个在TCGA-BRCA中明显上调或下调的BM基因。结果以热图的形式显示(图1B)和火山图(图1C)。同时,肿瘤学图显示了具有最多体细胞突变的前20个BM基因(图11D)。然后,作者对TCGA-BRCA中的OS进行了单变量分析,以获得12个BM基因,这些基因更有可能是进一步考虑的基础(图1E)。更重要的是,使用LASSO-Cox回归分析鉴定了六个关键的BM基因,包括LOXL1、FBLN1、FBLN5、SDC1、ADAMTS8和PXDNL(图1F、1F、G)。
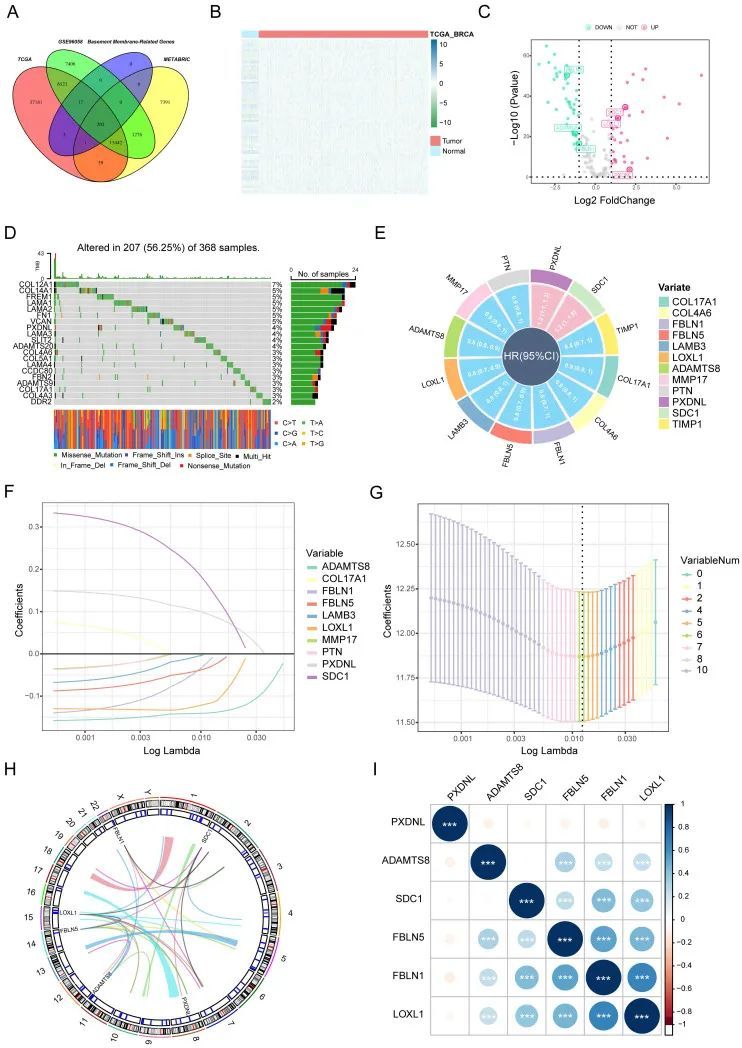
通过BM基因集和研究中使用的三个数据集的交叉,作者获得了203个BM基因(图1A)。然后,从数十个候选中,作者进行了差异表达分析(|log2FC|>1和FDR<0.05),获得了77个在TCGA-BRCA中明显上调或下调的BM基因。结果以热图的形式显示(图1B)和火山图(图1C)。同时,肿瘤学图显示了具有最多体细胞突变的前20个BM基因(图1D)。然后,作者对TCGA-BRCA中的OS进行了单变量分析,以获得12个BM基因,这些基因更有可能是进一步考虑的基础(图1E)。更重要的是,使用LASSO-Cox回归分析鉴定了六个关键的BM基因,包括LOXL1、FBLN1、FBLN5、SDC1、ADAMTS8和PXDNL(图1F、1F、G)。
BMscore在预测癌症患者预后方面的有效性
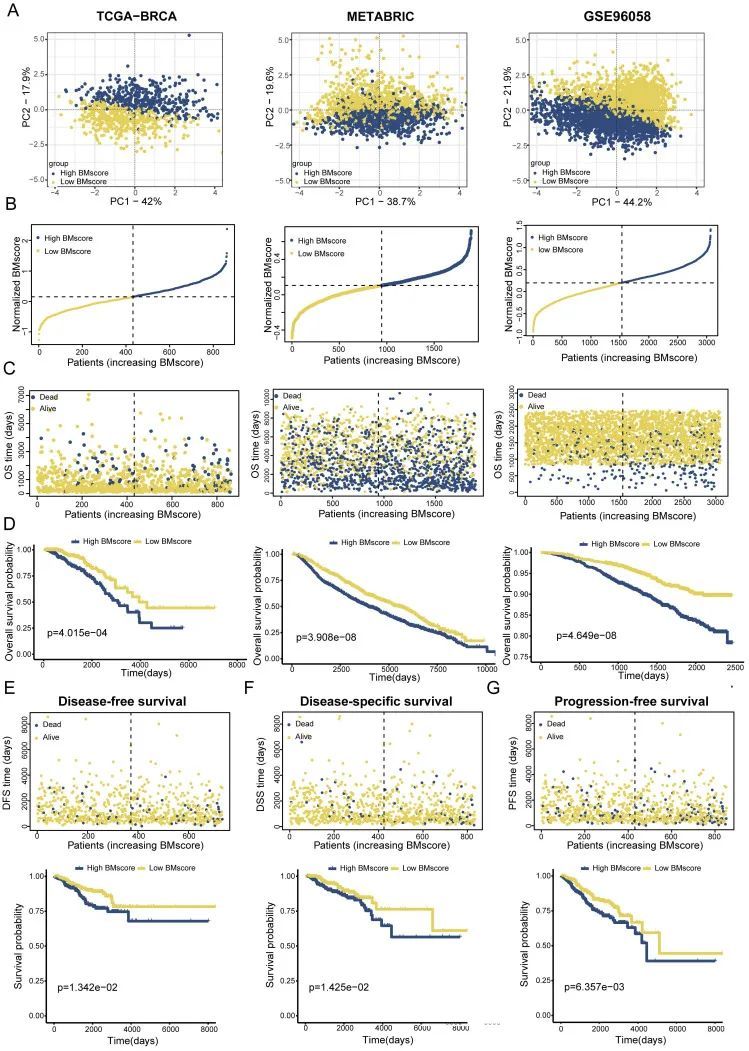
为了验证BMscore在预测癌症患者生存概率方面的适用性,来自TCGA-BRCA训练集和两个验证集的患者可以根据中值分别定义为高和低BMscore亚组,并通过二维PCA图进行可视化(图3A)。正如预期的那样,乳腺癌症患者的死亡率随着所有队列的BMscore的升高而显著增加(图3B、3B、C)。此外,在KM分析中,BMscore较高的患者OS概率较差(图3D),进一步强化了上述结论。由于BM已被报道参与肿瘤侵袭和转移,作者还对TCGA-BRCA中的DFS、DSS和PFS进行了KM生存分析。从结果来看,在BMscore高的乳腺癌中观察到死亡人数显著增加,这表明DFS更不利(图3E,p=1.342e-02),DSS(图3F,p=1.425e-02)和PFS(图3G,p=6.357e-03)。
乳腺癌症的BMscore特征
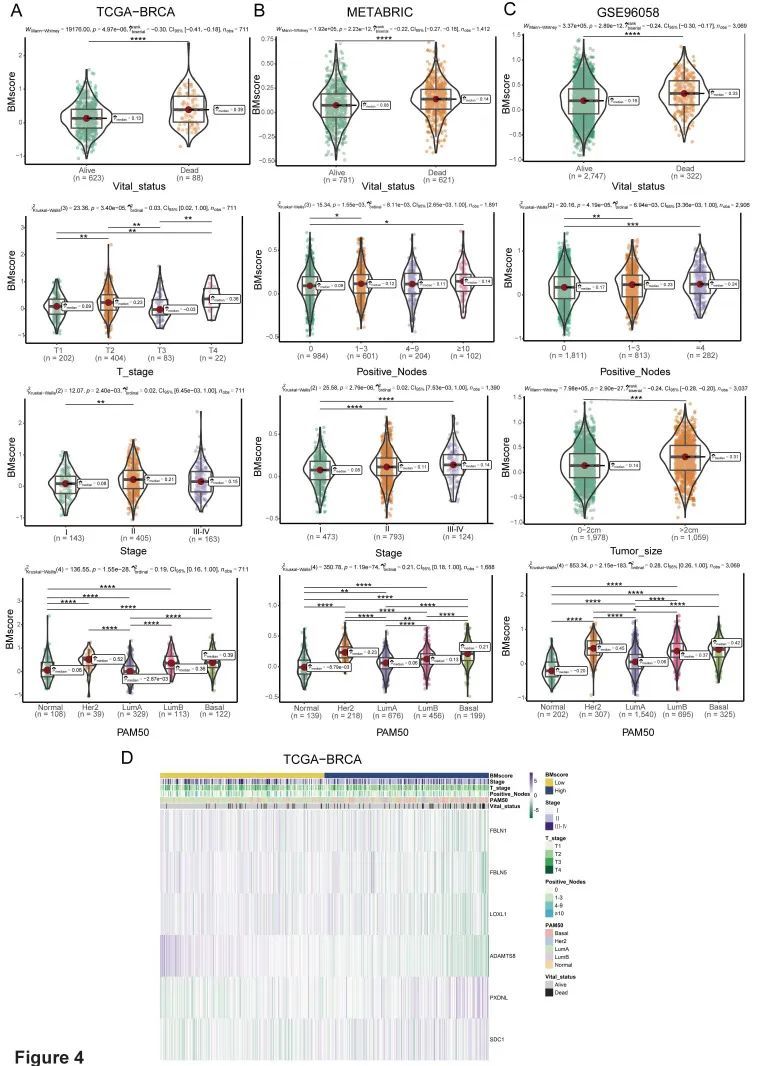
由于BMscore已被证明对乳腺癌症患者的临床结果具有预测价值,作者进一步揭示了BMscore与癌症其他特征的相关性。对于临床病理参数,研究结果表明,BMscore与TCGA-BRCA的T分期、分期和分子亚型具有显著相关性(图(图4A、D),METABRIC的阳性节点、分期和亚型(图4B),以及GSE96058中的阳性淋巴结、肿瘤大小和亚型(图4C)。总之,乳腺癌症的BMscore水平与临床特征之间出现了显著的关系,这意味着BMscore高的患者更容易出现淋巴结转移和严重的临床分期。
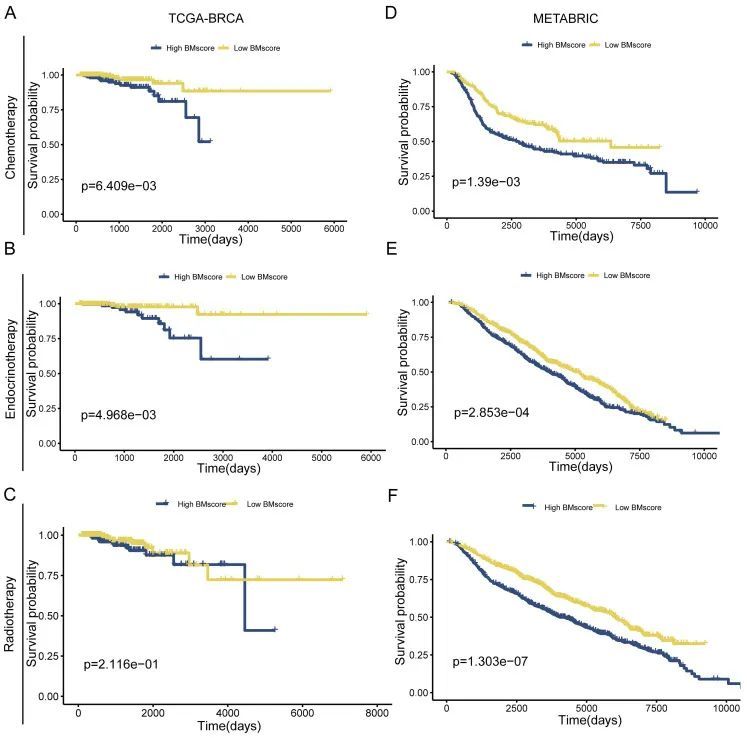
由于根治性手术后对辅助治疗反应不佳,一些患者的生存时间通常会更短。因此,作者探讨了BMscore是否有能力预测癌症临床治疗的反应。TCGA-BRCA的结果显示了一个意想不到的发现,表明高BMscore和化疗耐药性之间存在显著的正相关性(图5A,p=6.409e-03)和内分泌治疗(图5B,p=4.968e-03)除了放疗(图5C,p=2.116e-01)。同样,METABRIC的验证结果表明,高BMscore人群对化疗的反应要小得多(图5D,p=1.39e-03)和内分泌治疗(图5E,p=2.853e-04)以及放射治疗(图5F,p=1.303e-07)。从这一方面来看,BMscore签名可以有效地用于识别癌症耐治疗患者。
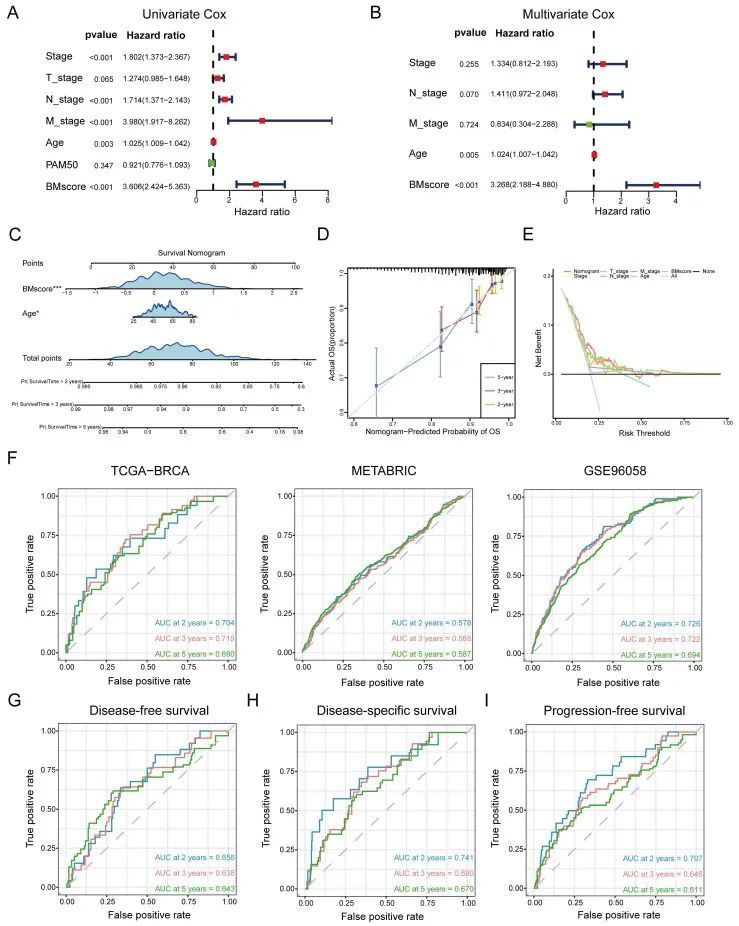
乳腺癌患者BMscore独立预后价值的鉴定和评价
总之,BMscore特征在预测癌症患者的预后和治疗反应方面表现良好。然而,仍有必要进行额外的研究,以调查BMscore是否可以作为影响癌症生存率的独立和不良预后预测指标。除了BMscore外,还纳入了多个风险因素(年龄、T分期、N分期、M分期和PAM50亚型),对TCGA-BRCA的OS进行单变量和多变量Cox分析。单变量分析确定,BMscore(p<0.001)、分期(p<001)、年龄(p=0.003)、N分期(p>0.001)和M分期(p=0.001)是OS的独立危险因素(图6A),随后,在OS的多变量分析中,年龄(p=0.005)和BMscore(p<0.001)仍然是独立的预测因素(图6B)。然后构建了一个包含这两个因素的预后列线图来预测不利的OS(图6C)。校准(图6D)和DCA曲线(图(图6E)TCGA-BRCA中的列线图用于评估预测性能和临床实用性,这表明列线图能够为预后提供有价值的判断。
BMscore对乳腺癌症免疫微环境的不可忽视的影响
鉴于肿瘤免疫微环境在癌症中的主要作用,作者接下来评估了BMscore对肿瘤免疫浸润的影响。根据ESTIMATE算法,较高的基质评分和ESTIMATE评分表明高BMscore肿瘤的基质细胞浸润程度更大(图7A)。值得注意的是,不同BMscore亚组的免疫评分没有显著差异。这一发现表明,BMscore高的乳腺肿瘤纯度低,这可能会导致该亚群的预后较差。
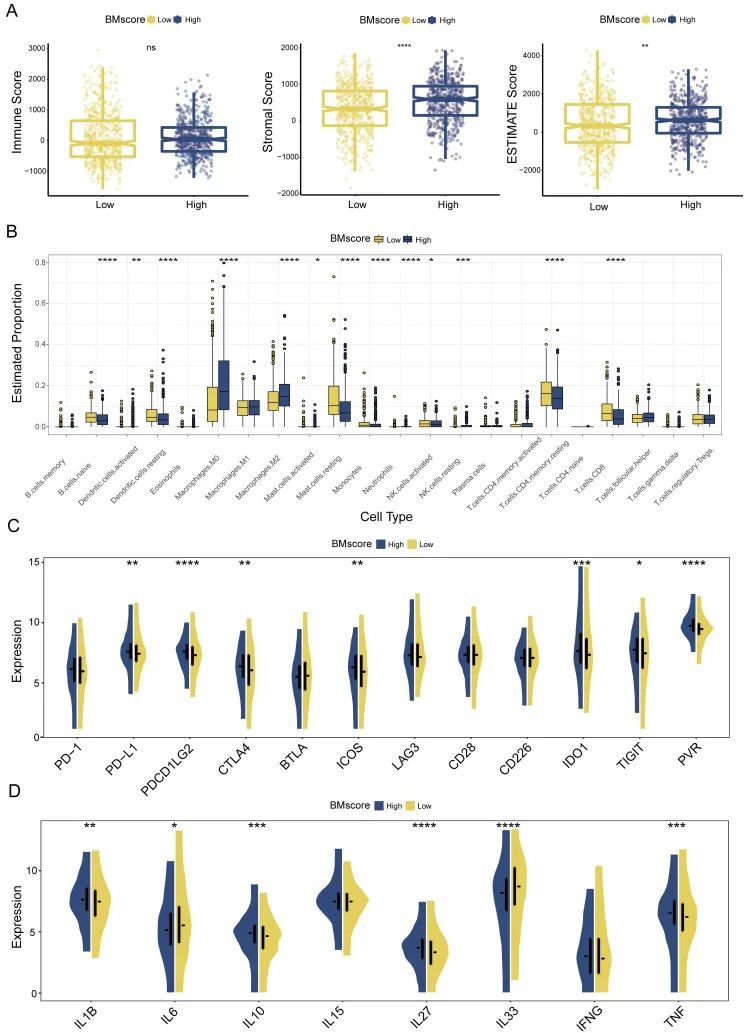
尽管骨髓和免疫细胞都是肿瘤微环境的重要组成部分,但它们之间的联系仍然不明确,这促使作者进行了后续的分析。使用CIBERSORT算法,作者推断了所有三个队列中不同BMscore水平的乳腺癌症样本中22个免疫细胞的浸润水平。在TCGA-BRCA的高BMscore组中,在浸润的M0巨噬细胞、M2巨噬细胞和静息NK细胞中观察到特别显著的增加,而在初始B细胞、静息树突状细胞、静息肥大细胞、单核细胞、活化的NK细胞、静息CD4+记忆T细胞和CD8+T细胞的浸润中观察到显著减少(图7B)。结合METABRIC和GSE96058的结果,可以总结出,M0巨噬细胞、M2巨噬细胞和调节性T细胞的浸润在具有高BM评分的乳腺癌症中增加,这进一步证实了BM的致癌和免疫抑制作用。
同时,作者分析了BMscore水平与免疫检查点和细胞因子表达之间的相关性。结果显示,高BMscores表示免疫检查点分子的表达上调,包括CTLA4、IDO1、ICOS和PVR,这些分子共同来源于TCGA-BRCA(图7C)、METABRIC和GSE96058。上述线索表明,BMscore高的患者可能对免疫检查点阻断治疗更敏感,尤其是抗CTLA4治疗。在细胞因子方面,作者注意到TNF、IL27和IL1B在高BMscore亚组中高度表达,而IL33和IL6在纳入所有队列的数据后明显减少(TCGA-BRCA,图7D;METABRIC;GSE96058)。总之,结果表明,促肿瘤细胞因子的表达有助于具有高BMscore的癌症患者的预后特征。
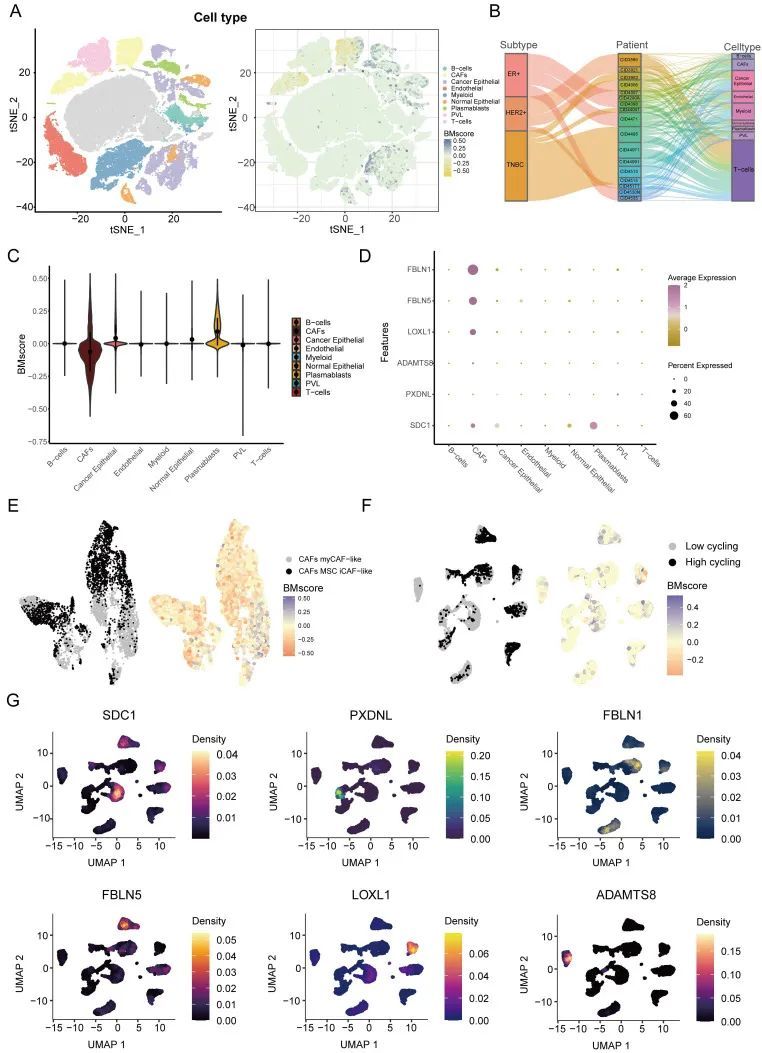
接下来,作者使用单细胞RNA转录组数据探讨了乳腺癌症中BMscore的详细分布。作者注释了GSE176078中的主要细胞类型,然后作者发现癌症上皮细胞、CAFs和浆母细胞的BMscore与其他细胞类型的BMscores显著不同(图8A)。由于癌症有多种亚型,作者筛选出细胞计数低于2000的患者,并使用Sankey图显示了癌症三种亚型中患者的比例和每个患者的每个细胞类型的比例(图8B)。小提琴图更清楚地说明了不同细胞类型的骨髓基质分数的差异,一致表明肿瘤细胞的骨髓基质得分更高(图8C)。然后,点图提供了每种细胞类型中六个模型基因表达的可视化,结果与之前的描述一致(图8D)。由于BMscore在CAF细胞内变化显著,作者进一步注释了CAF细胞进行分类,作者发现大多数BMscore高的细胞被分类为myCAF样细胞,这些细胞最集中在乳腺肿瘤的侵袭部分(图8E)36。此外,为了研究癌症上皮细胞的内部异质性与BMscore和模型基因之间的关系,作者将癌症上皮细胞分为高和低细胞循环组,并显示了BMscore的分布和模型基因在这些组中的表达(图8F、G)。
乳腺癌症患者BMscore与EMT活性呈正相关
骨髓丢失被认为是导致肿瘤恶性的重要步骤37,这促使作者研究骨髓评分和EMT之间的相关性。对于功能富集分析,在高BMscore组中富集的标志性途径包括顶端连接、凝血、上皮-间质转化、糖酵解和mTORC1信号传导(图9A)。此外,高BMscore组的GO术语包括表皮细胞分化、表皮发育、细胞外基质结构成分、角质形成细胞分化和皮肤发育(图9B)。此外,KEGG富集分析显示,高BMscore与谷氨酸能突触、IL-17信号通路、血小板活化、脂肪细胞脂解调节和金黄色葡萄球菌感染有关(图9C)。值得注意的是,该结果为BM在癌症进展和转移中的意义提供了线索。
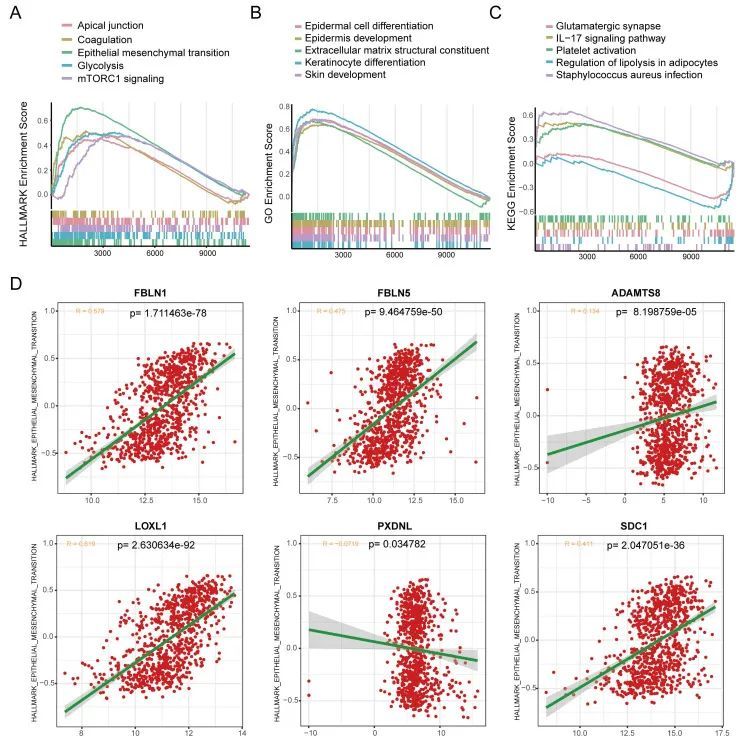
由于BM缺乏使患者容易发生肿瘤细胞转移,并且EMT在乳腺癌症转移中起着重要作用38,作者想知道BM评分和EMT活性之间是否有任何关联。通过相关性分析的散点图(图9D),作者发现EMT途径与FBLN1(R=0.579,p=1.711463e-78)、FBLN5(R=0.475,p=9.464759e-50)、LOXL1(R=0.619,p=2.630634e-92)和SDC1(R=0.411,p=2.047051e-36)的表达之间存在强正相关。
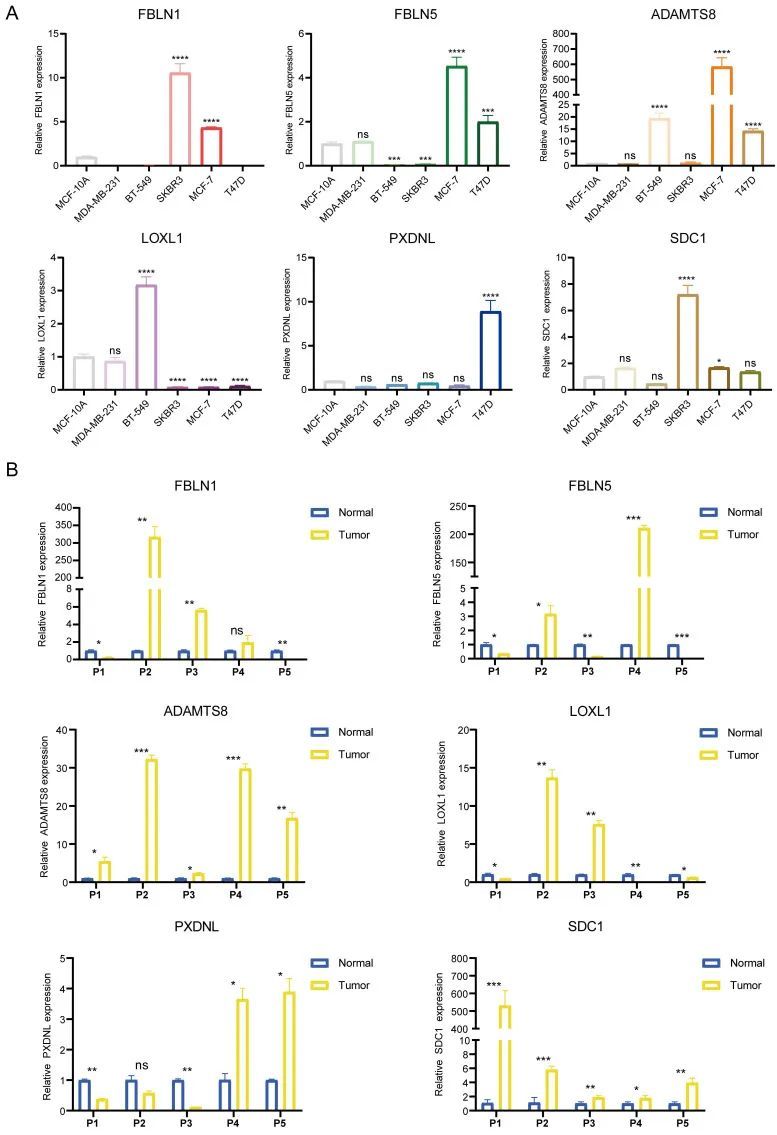
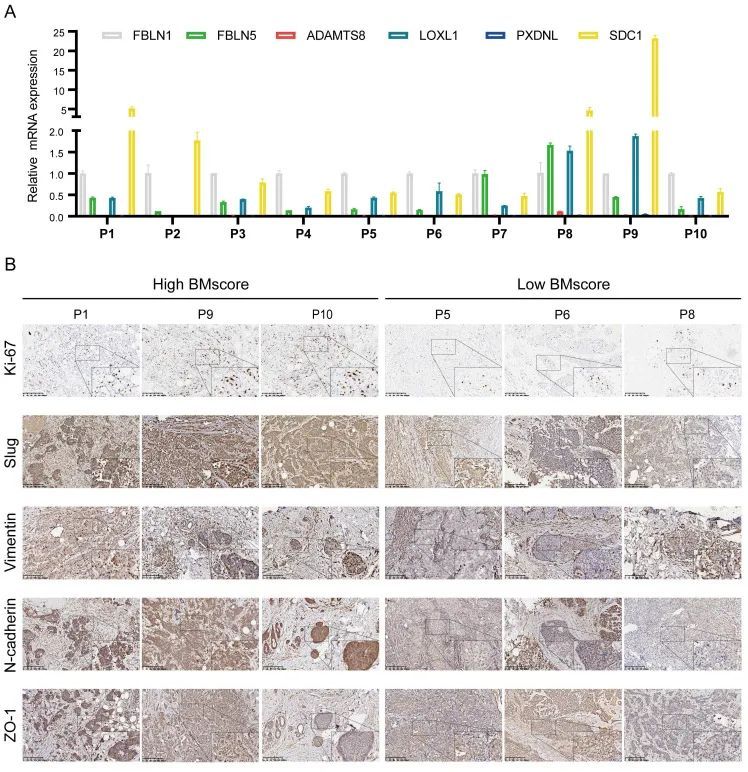
结合作者早期发现的EMT信号通路在高BMscore组中富集,作者假设BMscore与EMT水平呈正相关。为了验证作者的推测,作者首先在10个人类乳腺癌症样本中检测了6个含BMscore基因的mRNA水平(图10A)。之后,使用前面描述的公式计算每个样本的BMscore。作者选择了6个BMscore评分最高和最低的样本,并通过免疫组织化学检测这些肿瘤的冷冻切片,以检测Ki-67和几种EMT标记物的蛋白水平,包括蛞蝓、波形蛋白、N-钙粘蛋白和ZO-1(图10B)。出乎意料的是,作者发现这些蛋白质在具有高BMscore的组织中相对更丰富,这揭示了BMscore和EMT活性之间的强阳性关系。因此,BMscore高的癌症患者可能有更大的EMT介导的转移风险。
SDC1是BMscore的关键参与者,也是癌症的肿瘤促进剂
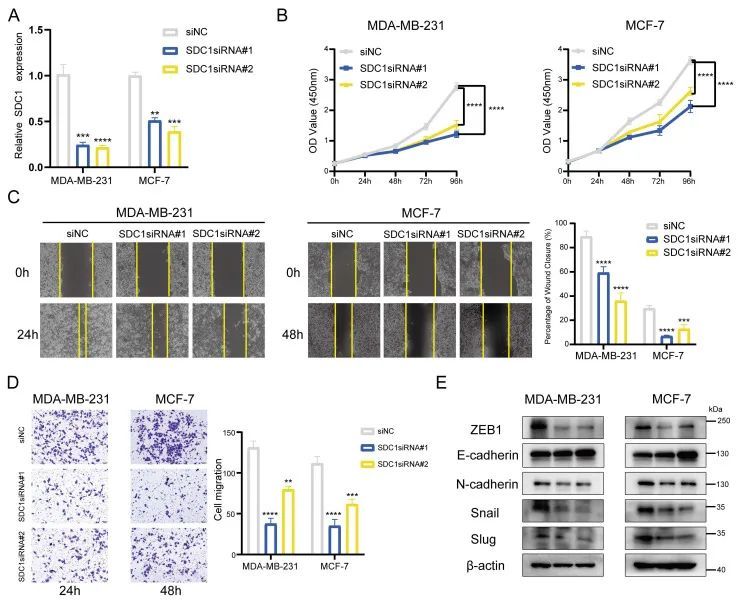
通过总结上述所有发现,作者确定SDC1是与BMscore特征相关的关键基因,并在体外进行了额外的实验。通过siRNA介导的敲除,MDA-MB-231和MCF-7细胞中SDC1 mRNA水平降低(图11A)。CCK8细胞增殖测定在SDC1减少的MDA-MB-231和MCF-7细胞系中均显示出显著的生长抑制(图11B)。类似地,SDC1在乳腺癌症细胞中诱导的迁移抑制减少,如抓伤愈合所示(图11C)和transwell迁移分析(图11D)。此外,在siRNA转染的细胞中检测EMT标记物的蛋白质水平,以验证SDC1的改变是否导致EMT标记基因的变化。正如预期的那样,SDC1沉默抑制了蜗牛、蛞蝓、N-钙粘蛋白和ZEB1的蛋白质表达,同时观察到E-钙粘蛋白的相应增加(图11E)。到目前为止,作者的数据证实了SDC1在癌症EMT相关进展中的关键作用。
总结
总之,本研究中提出的BM-相关基因标志是一个实用的预后指标,可以在评估癌症患者的生存结果方面产生显著差异。此外,来自癌症患者的临床组织样本证实了BMscore和EMT活性之间的强正相关性,这加强了基底膜在癌症中的新意义。