今天给同学们分享一篇单细胞分析+干湿结合的生信文章“Tumor-associated endothelial cell prognostic risk model and tumor immune environment modulation in liver cancer based on single-cell and bulk RNA sequencing: Experimental verification”,这篇文章于2023年9月9日发表在Int Immunopharmacol 期刊上,影响因子为5.3。

全球肝癌发病率正逐渐上升 。乙型病毒感染、丙型病毒感染和非酒精性肝炎已被确定为肝癌的主要危险因素。肝癌肿瘤微环境具有极强的异质性,包含基质细胞、各种免疫细胞和分化程度不同的肿瘤细胞。这一特点决定了肝癌患者从临床治疗中获益有限。
1.肝癌中肿瘤相关内皮细胞标记基因的鉴定
在对 GSE189903 中的单细胞测序数据进行质量控制后,39,092 个细胞和 20,543 个基因可用于下一步分析。共选择了 3000 个高变异基因进行 PCA 降维。降维结果经聚类后共得到 29 个细胞簇。经过 SingleR 软件注释和查阅以前的文献,16 个细胞群被注释为 TEC。通过 Wilcoxon-Mann-Whitney 检验,87 个细胞被认定为标记基因(图 1)。
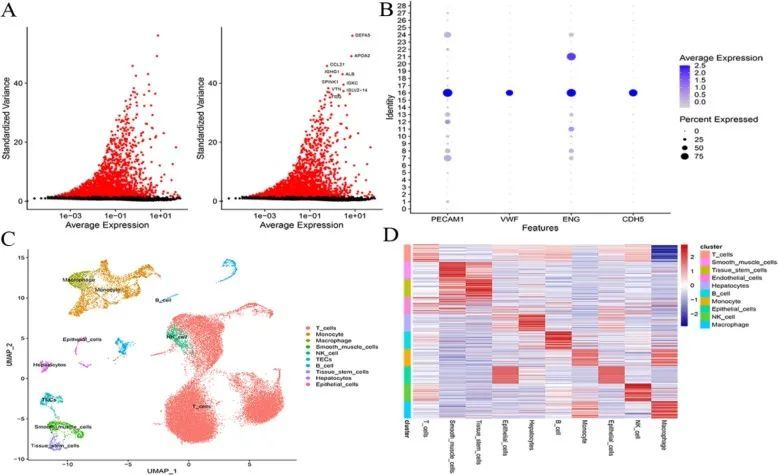
图1 单细胞测序分析
2.肿瘤相关内皮细胞标记基因富集分析结果
GO和KEGG分析结果显示,TECs的标记基因主要与血管生成调控、血管生成、血管生成调控、细胞增殖、白细胞跨内皮细胞迁移、细胞粘附等特征有关(图2A,B)。
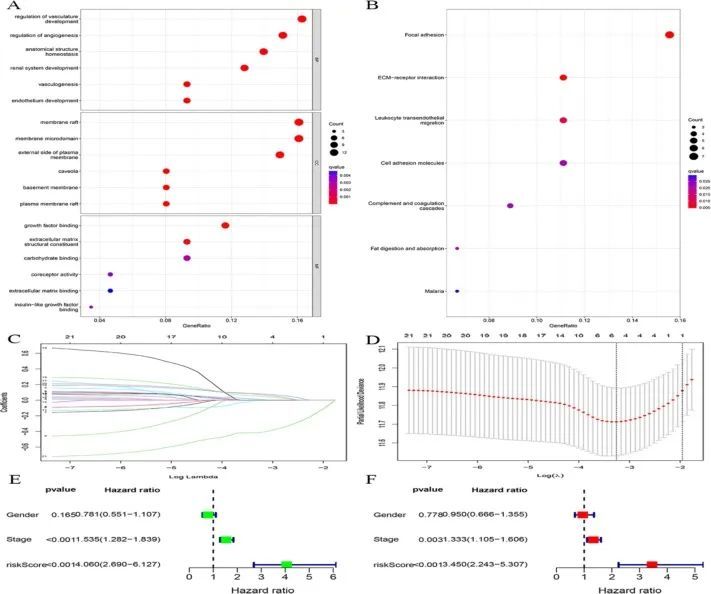
图2 GO 和 KEGG 富集分析结果气泡图
3. Building the model 3.3.建立模型
对这 87 个基因进行了单变量 Cox 回归分析,得出了 21 个与预后相关的基因。为避免模型过拟合,对单变量 Cox 回归结果进行了 LASSO 回归分析(图 2C,D)。对 LASSO 回归结果进行多因素 Cox 回归分析,以建立风险模型。最终将 IGFBP3、RHOC、S100A16、FSCN1 和 CLEC3B 纳入模型。
4. Model validation 3.4.模型验证
临床指标的单变量和多因素Cox回归分析表明,风险模型是一个独立的预后变量(图2E、F)。来自 ICGC 数据库和 GSE76427 数据库的患者作为独立验证集进行了验证。生存曲线显示,与低风险组相比,建模组和验证组的高风险组患者预后较差,差异有统计学意义(图 3A-C)。建模组和验证组的随时间变化的 ROC 曲线下面积均大于 0.700,表明风险模型具有突出的预测能力(图 3D-F)。热图显示,IGFBP3、RHOC、S100A16 和 FSCN1 在高风险组的表达高于低风险组。然而,CLEC3B 在低危组的表达高于高危组(图 4)。肝癌组织和正常组织中多个基因的蛋白表达量不同(图 5)。
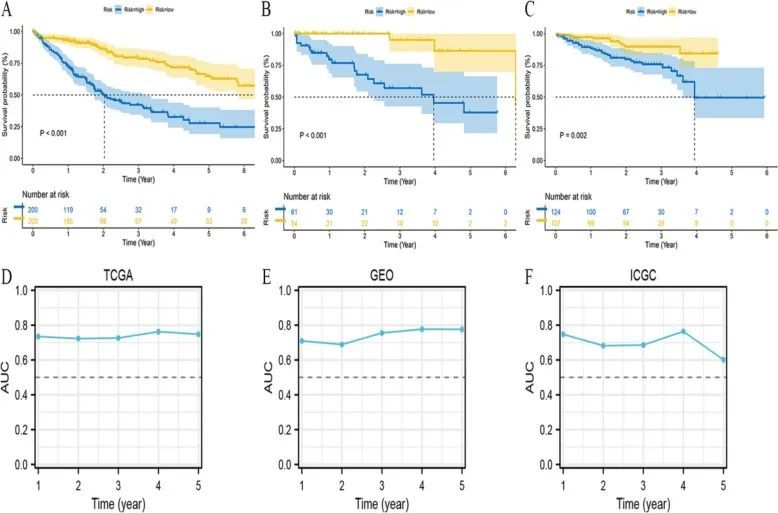
图3 TCGA、GEO 和 ICGC 的 K-M 生存分析
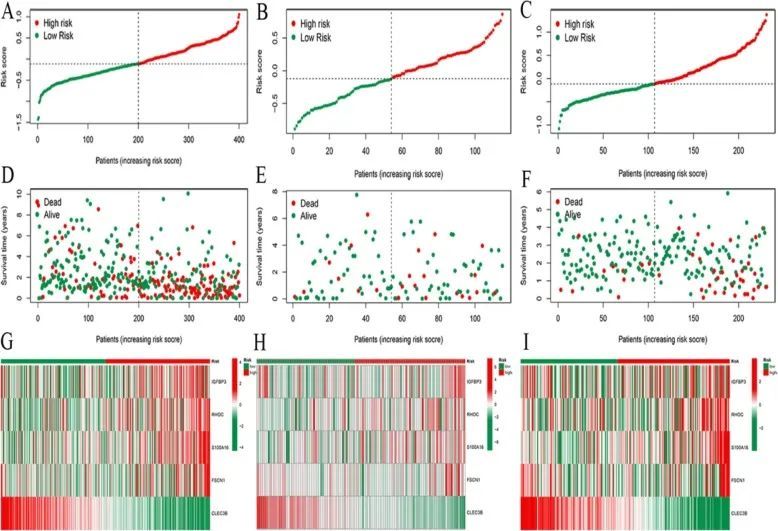
图4 TCGA、GEO 和 ICGC 数据库的预后分析
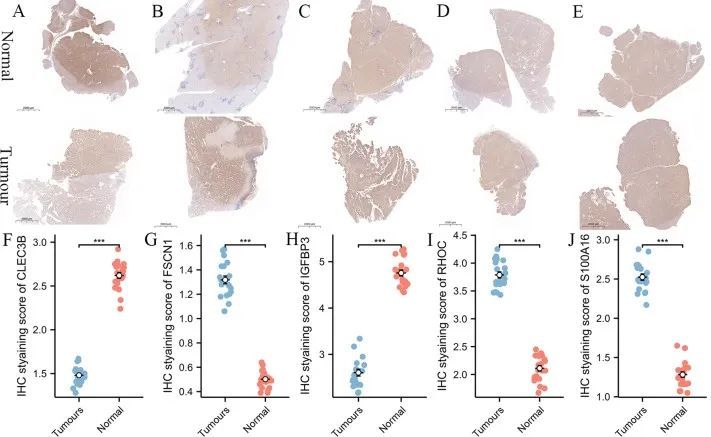
图5
5.肿瘤突变负荷分析
肿瘤突变分析结果显示,高危组和低危组的前十大突变基因是一致的。但是,每个基因的突变类型各不相同。高危组和低危组的肿瘤突变负荷没有差异。但是,肿瘤突变负荷高组患者的生存率比肿瘤突变负荷低组患者差(图 6)。
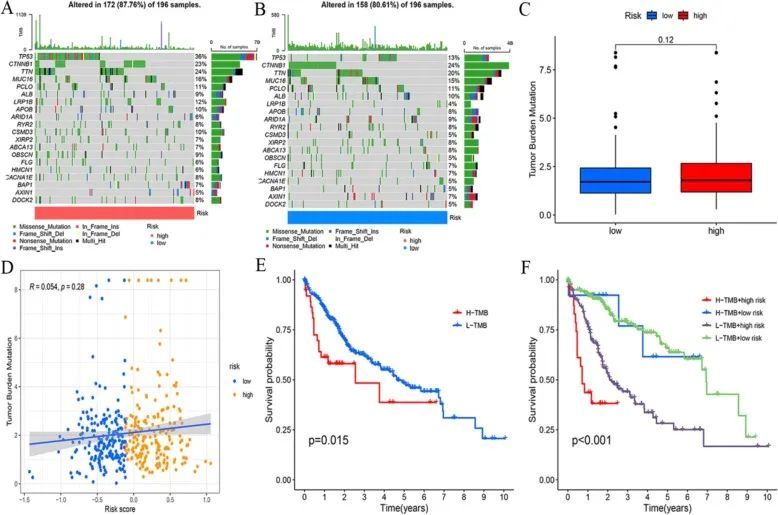
图6
6.风险评分与肿瘤免疫微环境特征的相关性
CIBERSORT 的结果显示,高风险组和低风险组的 B 细胞、T 细胞、单核细胞、树突状细胞、肥大细胞和中性粒细胞的免疫浸润丰度存在显著差异(图 7A、B)。ssGSEA算法显示树突状细胞、CD8+ T 细胞、细胞溶解活性、巨噬细胞、NK 细胞、I 型 IFN 反应、II 型 IFN 反应、肥大细胞和中性粒细胞的活性存在差异(图 7C)。估算算法显示,高风险组的间质评分、总评分和肿瘤纯度评分均低于低风险组(图 7D)。风险模型与 CD8+ 细胞、CD4+ 细胞、B 细胞和 NK 细胞具有高度相关性(图 8)。
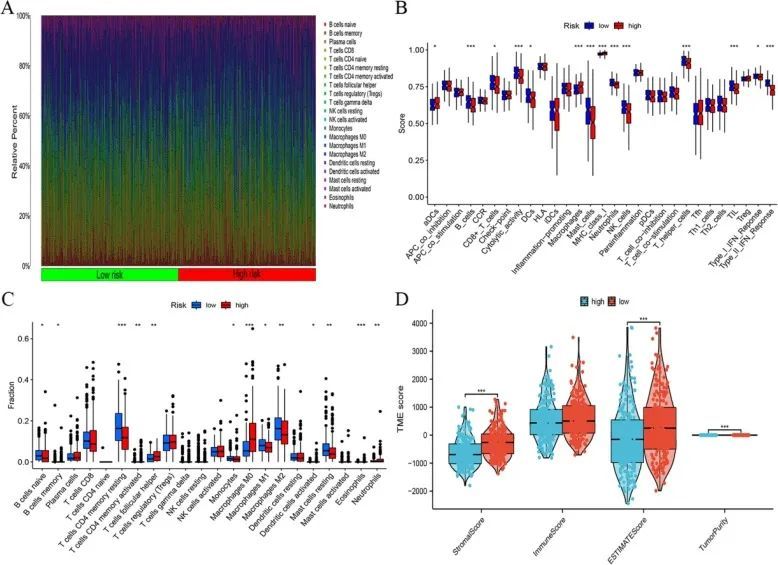
图7 (A、B)高危组和低危组免疫细胞浸润分析
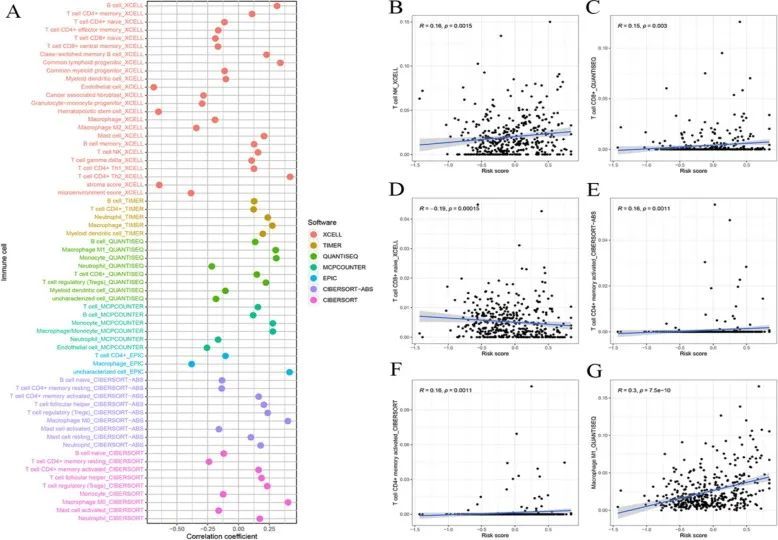
图8 风险评分与免疫细胞的相关性分析
7.免疫疗法预测
TCIA 预测表明,低风险组对 PDL1 和抗 PD1 更有效(图 9A-D)。高风险组患者的 TIDE 评分高于低风险组患者,这表明高风险组免疫逃逸的可能性更大。高危患者从免疫检查点抑制治疗中获益较少。此外,两组患者的 CAF 评分、MDSC 评分、T 细胞功能障碍评分和 T 细胞排斥评分也各不相同(图 9E-H)。相关性分析发现,IGFBP3、FSCN1、风险模型和大多数免疫检查点阻断基因之间存在极高的相关性。风险模型基因是预测免疫检查点免疫疗法的有用工具(图 10A)。
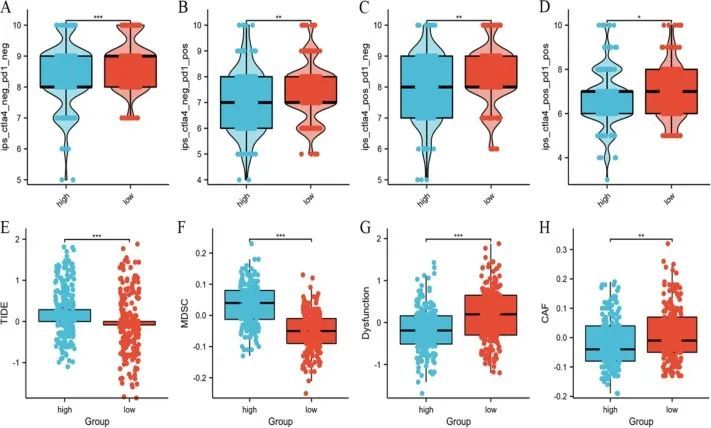
图9 对免疫疗法反应的预测
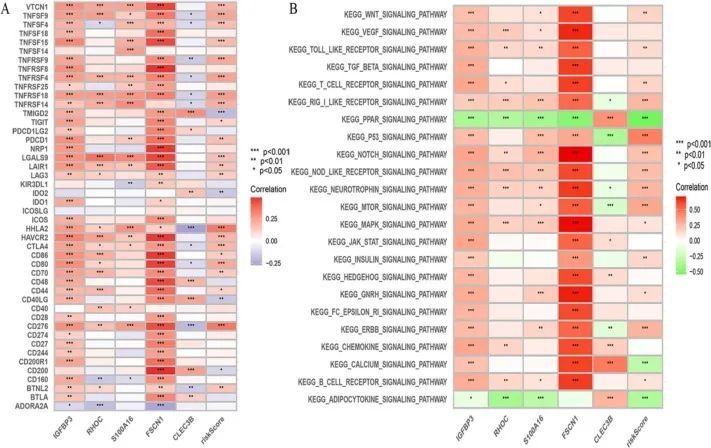
图10 免疫检查点阻断基因和 GSVA 富集分析
8.GSVA 富集分析
GSVA 富集显示,IGFBP3、FSCN1 和 P53、钙离子、B 细胞受体、WNT 和 MAPK 信号通路密切相关。RHOC、S100A16、CLEC3B、PPAR、VEGF、趋化因子等信号通路影响了 TEC 的功能(图 10B)。
9.独立样本验证
通过对武汉大学人民医院的15例肝癌患者样本进行RT-PCR检测,验证了基因表达的差异。结果显示,RHOC、S100A16 和 FSCN1 在肝癌组织中高表达。然而,IGFBP3和CLEC3B在肝癌组织中的表达水平较低。结果与 TCGA 数据库一致(图 11)。
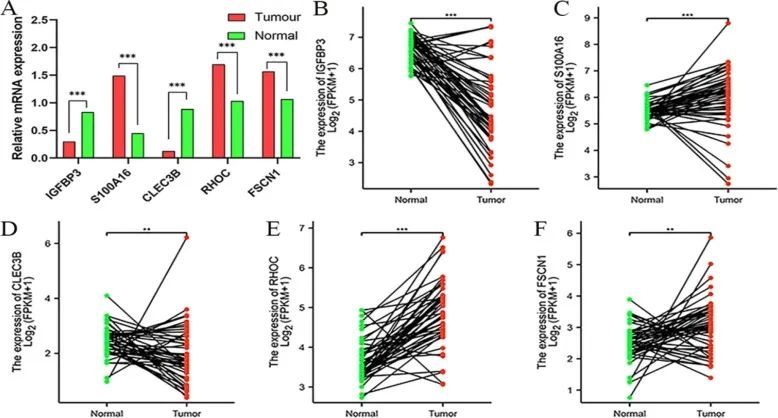
图11 通过 RT qPCR 验证构成风险模型的基因表达
总结
基于TECs标记基因的风险模型可作为预测肝细胞癌患者预后和对免疫疗法反应的工具。肿瘤内皮相关标记基因可能成为新的治疗靶点。不过,这些发现还需要在细胞、组织和动物身上进一步验证。