今天给同学们分享一篇铜死亡+铁死亡联合分析的生信文章“Cross-talk between cuproptosis and ferroptosis regulators defines the tumor microenvironment for the prediction of prognosis and therapies in lung adenocarcinoma”,这篇文章于2023年1月17日发表在Front Immunol 期刊上,影响因子为8.786。

2021年,癌症占全球癌症死亡人数的25%。肺腺癌(LUAD)是癌症最主要的组织学亚型之一。尽管癌症治疗取得了巨大进展,但大多数国家2010年至2014年间LUAD患者的5年生存率在10%至20%之间。因此,识别新的生物标志物并全面了解潜在的治疗机制,以预测LUAD的有效治疗是重要的。
1. LUAD中铜死亡调节因子的遗传和转录改变
这项研究的工作流程如图1所示。作者的研究分析了14种铜死亡调节因子。为了揭示铜死亡调节因子的基因改变,作者简要概述了恶性肿瘤中非沉默体细胞突变的发生率。在UCEC、BLCA和CESC的TCGA队列中,铜死亡调节因子的突变发生率中等高,但在UVM中较低。在561个LUAD样本中,67个(11.94%)携带铜死亡调节因子突变(图2A)。ATP7A(4%)和ATP7B(3%)的突变频率最高,而LIAS、LIPT1、GCSH、PDHB、LIPT2和SLC31A1没有发现突变。GCSH、ATP7B、DBT、ATP7A和DLST之间表现出显著的突变共现。然而,在TCGA-LUAD队列中,有突变和没有突变的患者之间没有生存差异。检测到铜死亡调节因子的染色体位置,如图2B所示。在TCGA-LUAD队列中,分析了相邻非肿瘤和LUAD样本之间铜死亡调节因子的mRNA表达(图2C)。分析了铜死亡调节因子在NSCLC和正常肺上皮细胞中的表达(图2D)。此外,对CNV改变频率的探索确定,在LIPT2、SLC31A1和DLD中,CNV增益的发生率很高。为了发现遗传变异与mRNA表达之间的关系,作者发现具有CNV增益的LIAS显示出高mRNA表达(图2C)。有趣的是,表现出更高频率的CNV损失的DBT和FDX1显示出高表达。
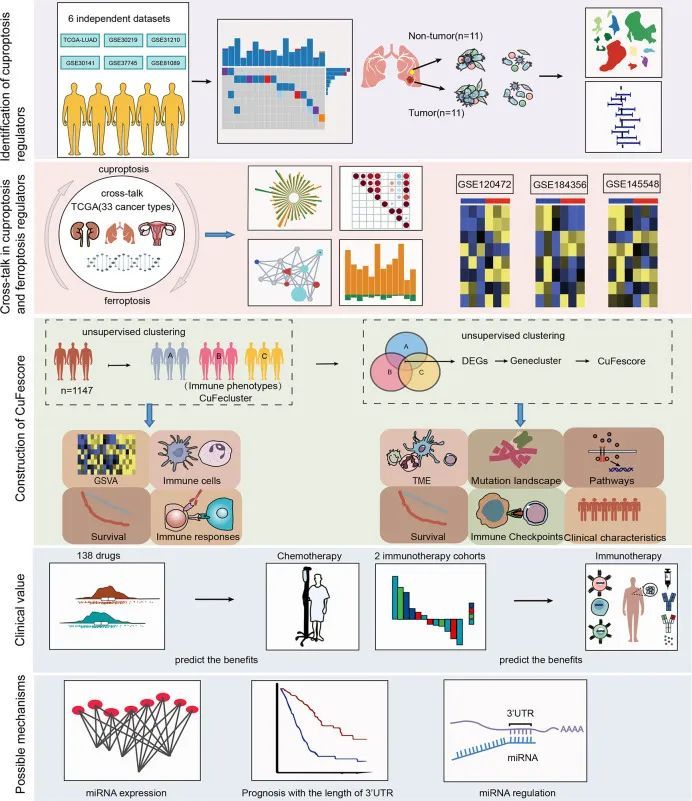
图1 工作流程
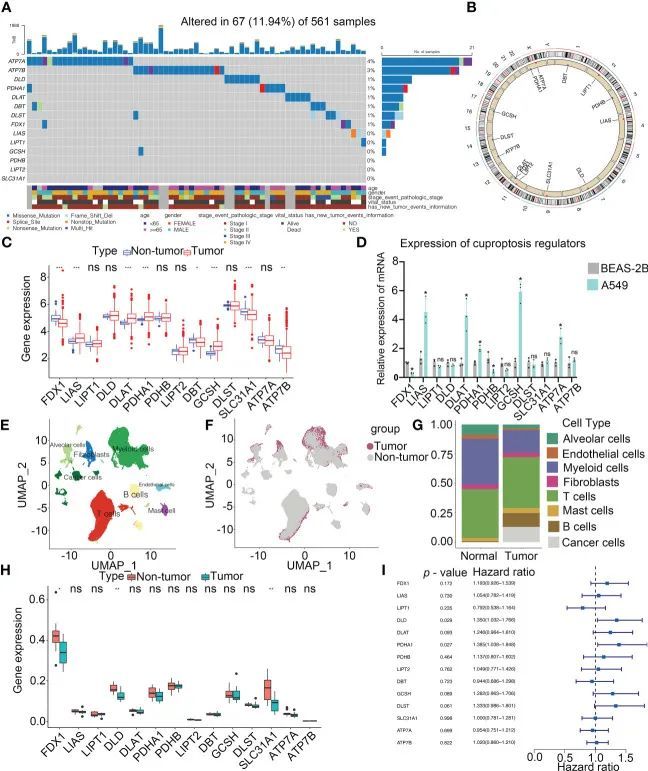
图2 LUAD中铜死亡调节因子的遗传和表达变异
组织的单细胞图谱已成为评估恶性肿瘤中不同细胞类型临床相关性的重要工具。分析来自11个LUAD和11个非肿瘤样本的208506个细胞的全转录组数据库。根据细胞特异性标记物,作者确定了8种细胞类型,包括肺泡细胞、B细胞、癌症细胞、成纤维细胞、髓样细胞、T细胞、内皮细胞和肥大细胞(图2E)。所有肿瘤细胞均来源于肿瘤样品(图2F、G)。值得注意的是,在正常和癌组织样本中,T细胞在所有细胞亚群中所占比例最大(图2G)。基于scRNA-seq的分析,非肿瘤组织中FDX1、DLD和SLC31A1的表达远高于肿瘤组织中的表达,这与作者的批量测序分析结果一致(图2H)。单变量Cox回归分析确定了LUAD患者铜死亡调节因子的预后意义(图2I)。9种铜死亡调节因子的低水平与LUAD患者的高OS发生率显著相关。因此,作者的结果表明,非肿瘤和LUAD样本之间的遗传景观和铜死亡调节因子表达的高度异质性,表明铜死亡调节蛋白表达失衡在LUAD中至关重要。
2. 铜死亡和铁死亡调节因子之间的鉴定
为了探索各种细胞死亡途径中的潜在相互联系,作者研究了铜死亡和铁死亡调节因子之间的串扰。从TCGA中获得33种癌症的全基因组组学数据进行分析。作者发现,大多数杯突症和铁死亡调节因子在33种癌症类型中表现出可比的突变频率(图3A)。此外,作者的研究结果表明,铜死亡和铁死亡调节因子之间存在很强的相关性(图3B)。铁死亡调节因子与来自GeneMANIA数据库的铁死亡调节因子相互作用(图3C)。为了确定与互连性相关的关键调节因子,作者进行了WGCNA,以确定33种癌症类型中铁死亡调节因子中的关键基因(图3D)。有趣的是,在不同的癌症中,关键铜死亡调节因子的数量与关键铁死亡调节因子的数目密切相关(图3E),表明不同癌症中铜死亡和铁死亡调节蛋白之间可能存在串扰。作者还研究了各种癌症中标志性致癌途径的活性。为了验证铜死亡和铁死亡调节因子之间的调节,作者分析了先前研究中几种铁死亡性调控因子被敲除后铜死亡调节因子的表达。在GSE120472队列中,原代小鼠胚胎成纤维细胞(MEFs)中Pten的敲除导致3种铜死亡调节因子的上调,包括Dbt、Slc31a1和Atp7a。在GSE184356队列中,TFAM的敲低导致人类真皮成纤维细胞中PDHA1、PDHB、ATP7A和ATP7B的显著变化。在GSE145548队列中,乳腺癌细胞MCF7中ATF2的敲除导致杯状增生调节因子(DLST、GCSH、PDHA1、LIPT1和DLD)的显著变化。此外,作者将siRNA和shRNA转染到A549细胞中,以验证铜死亡和铁死亡调节因子之间的相关性。SL31A1的表达在PTEN敲低后上调,而ATP7A的水平在TFAM敲低后升高,LIPT1在ATF2敲低后被抑制(图3F),这表明铜死亡和铁死亡调节因子之间存在强烈的相关性。因此,作者的研究结果表明了癌症中铜死亡和铁死亡调节因子之间的串扰和生物调节。
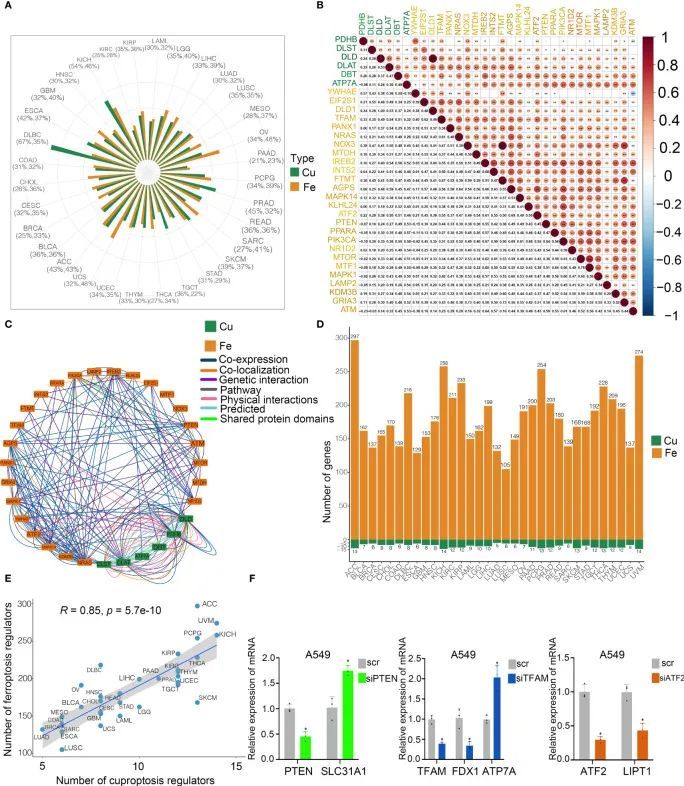
图3 癌症中铜死亡和铁死亡调节因子之间的串扰
3. 不同铜死亡和铁死亡调节因子模式的TME细胞浸润特征
通过根据铜死亡和铁死亡调节因子的水平进行无监督聚类,将来自6个队列(TCGA、GSE30219、GSE31210、GSE3141、GSE37745和GSE81089;n=1147)的患者分为三个亚型,命名为CuFeCluster A/B/C。主成分分析表明,这3个聚类中存在相对明显的差异(图4A)。与CuFeClusterA和C中的患者相比,CuFeCluster B中的患者具有更有利的预后(图4B)。对来自6个不同队列的1147名患者进行了GSVA富集途径,以确定3个CuFeCluster的生物学功能。与CuFeClusterA和CuFeClusterC相比,CuFeClusterB与免疫完全激活有关,包括B细胞受体信号通路、自然杀伤细胞介导的细胞毒性、抗原处理和呈递、细胞因子-细胞因子-受体相互作用和趋化因子信号通路(图4C、D)。此外,CuFecluster B富含各种活化免疫细胞的浸润(图4E)。考虑到相应的生存优势,CuFecluster B被归类为免疫炎症表型。这种表型的特点是存在适应性免疫细胞浸润以及免疫激活。CuFecluster A与几个细胞增殖过程相关,特别是错配修复、DNA复制和细胞周期(图4C),而CuFeclusters A与先天免疫细胞(包括MDSC、嗜酸性粒细胞、自然杀伤细胞、单核细胞、肥大细胞和巨噬细胞)相对高度相关(图4E)。有趣的是,CuFeClusterA也与TGF-β家族成员和TGF-β家庭成员受体高度相关(图4F)。先前的一项研究表明,免疫排斥表型的区别在于存在大量免疫细胞和TGF-β信号通路的活性水平升高,而免疫细胞无法穿透肿瘤的实质,因为它们在包围肿瘤细胞巢的基质中受到阻碍。因此,确定CuFeClusterA代表免疫排斥亚型。此外,发现CuFecluster C获得的免疫细胞数量较少,免疫反应受到抑制(图4D–F),这与免疫表型的主要特征一致。因此,就TME的细胞浸润特性而言,三种CuFeCluster之间存在显著差异。
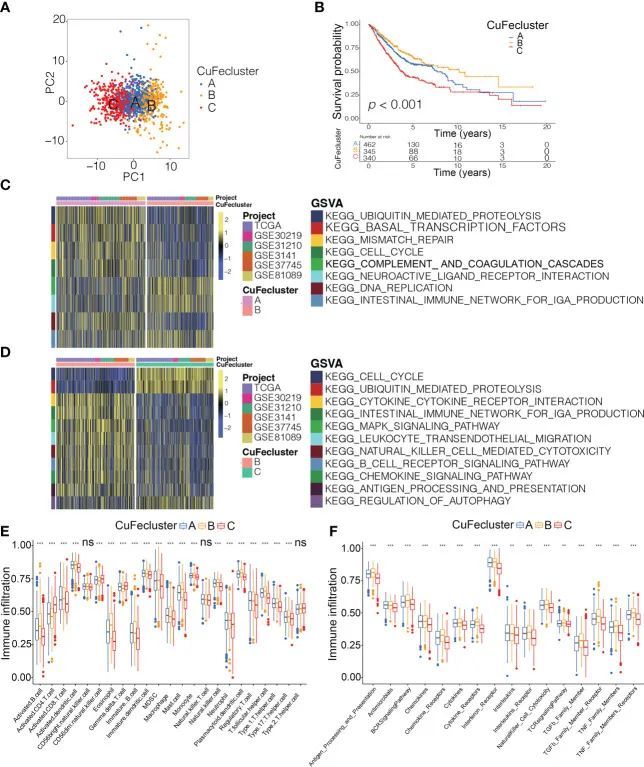
图4 不同CuFeCluster的肿瘤微环境细胞浸润特征和转录组特征
4. 铜死亡/铁死亡调节因子相关基因亚型的鉴定及CuFe评分的建立
为了根据不同的铜死亡/铁死亡亚组评估可能的遗传修饰,作者获得了108个交集的DEG(图5A),并通过单变量Cox回归分析发现了105个具有预后意义的DEG。作者进行了无监督聚类分析,并将患者分为3种独特的基因组亚型,作者称之为基因亚型A/B/C。值得注意的是,与其他聚类相比,基因亚型a的预后显著改善(p<0.001,图5B)。尽管作者的研究显示预后中存在铜死亡/铁死亡相关基因改变,但作者根据铜死亡/铁死亡相关DEG的表达生成了预测个别患者铜死亡和脱铁修饰的应用评分。冲积图说明了CuFescore建立过程中涉及的步骤(图5C)。作者在评估中发现,亚型B(图5D)和亚型A(图5E)中的患者的CuFe评分较低。此外,作者检查了3种不同亚型的重叠。在高CuFe评分组中,CuFe簇A占患者的36.6%,在低CuFescore组中,52.4%的样本与CuFe簇B重叠。与CuFe评分高的队列的生存率相比,CuFe分数低的亚组的生存概率要高得多(70%vs 52%,图5F),与早期(T1-2)和晚期(T3-4)癌症的发现相比较(图S5A)。与这一发现一致,与死亡病例相比,存活病例的平均CuFe评分要低得多(图5G)。Kaplan-Meier分析显示,低CuFe评分组患者的预后更好(p<0.001,图5H)。CuFescore模型的稳定性在4个独立的LUAD队列中进行了验证,以验证预后值。低CuFescore组的富集途径是DNA复制、错配修复和细胞周期(图5I)。此外,研究表明,低CuFe评分的患者与早期临床和病理特征和分期相关(图5J),这表明这些患者具有以CuFe簇B和免疫炎症亚型为特征的生存优势。此外,与时间相关的AUC曲线确定,CuFe评分作为4个队列中LUAD患者OS的预测性生物标志物(图5K)。因此,这些数据表明CuFe评分与LUAD患者的预后相关。
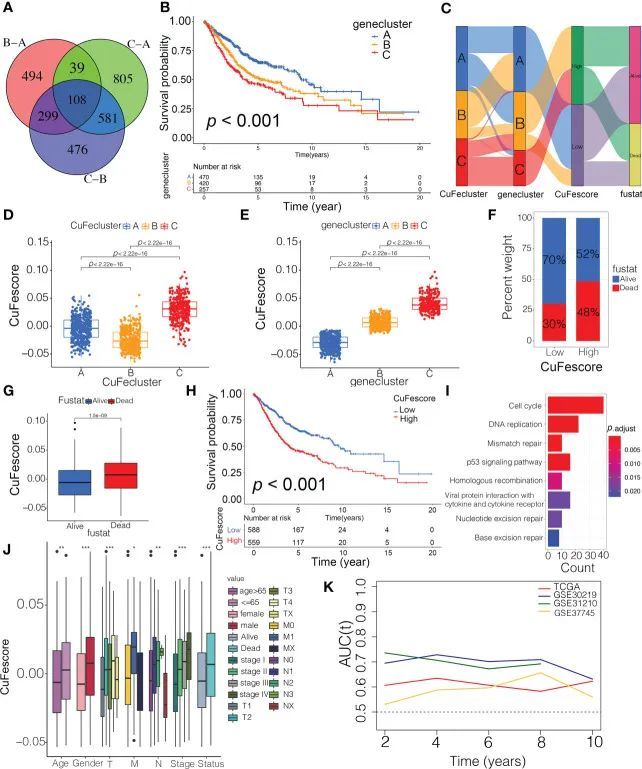
图5 CuFescore的构建及其预后价值
5. CuFescore与免疫检查点之间的关联
基于与免疫相关途径(包括免疫检查点、CD8 T效应器和抗原处理机制)的强相关性,作者假设CuFe评分与免疫疗法有关。在这项研究中,作者检查了免疫治疗相关的参数,如肿瘤突变负荷(TMB)和免疫检查点。与低CuFescore组相比,高CuFescole组的TMB更高(p=2.8e-16;图6A)。此外,CuFe评分也与TMB呈正相关(R=0.45,p<2.2e-16,图6B)。TMB低亚组和高亚组之间未发现差异(p=0.084,图6C)。通过结合CuFe评分和TMB,作者注意到CuFe评分低的患者和TMB评分高的患者表现出良好的预后(p<0.001,图6D)。CuFescore与肿瘤浸润免疫细胞(TIIC)相关,包括活化的树突状细胞、活化的CD4 T和CD8 T细胞以及活化的B细胞。作者还评估了两个CuFescore组之间TME细胞的差异。研究结果表明,低CuFescore表现出M0和M1巨噬细胞、CD4记忆激活的T细胞、CD8 T细胞、活化的NK细胞、中性粒细胞和激活的肥大细胞的浸润水平升高,而高CuFescores表现出巨噬细胞、激活的CD4 T细胞和活化的肥大细胞水平升高(图6E、F),表明CuFe评分低的患者是免疫激活的。总的来说,作者的发现证明了CuFescore与包括TMB和浸润免疫细胞在内的免疫信号有关。
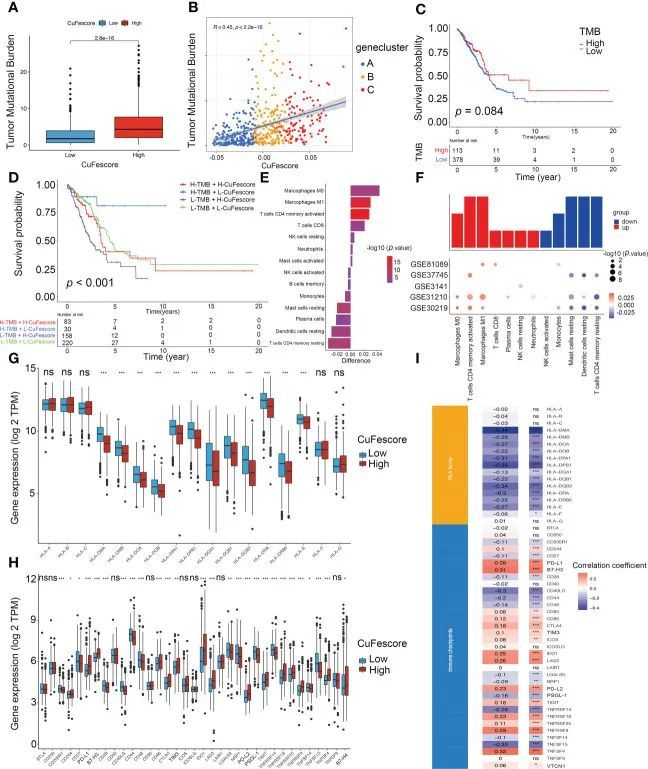
图6 CuFescore和免疫检查点之间的相关性
Wilcoxon检验表明,在12个HLA家族基因(图6G)和27个免疫检查点(图6H)的表达方面,2个CuFescore组之间存在显著差异。此外,CuFe评分与13个HLA家族基因和29个免疫检查点表达显著相关(图6I)。因此,数据显示CuFe评分与肿瘤免疫检查点高度相关。
6. 高和低CuFescore组的突变状况
为了进一步检查CuFescore与LUAD突变之间的相关性,作者从TCGA队列中确定了CuFescor高组和低组之间的体细胞突变。频繁突变的基因如图7A、B所示。值得注意的是,20个基因的突变在CuFe评分高的患者中更为频繁(图7C)。此外,在低(图7D)和高CuFe评分组(图7E)中,发现这些基因的突变之间存在显著的共现现象。
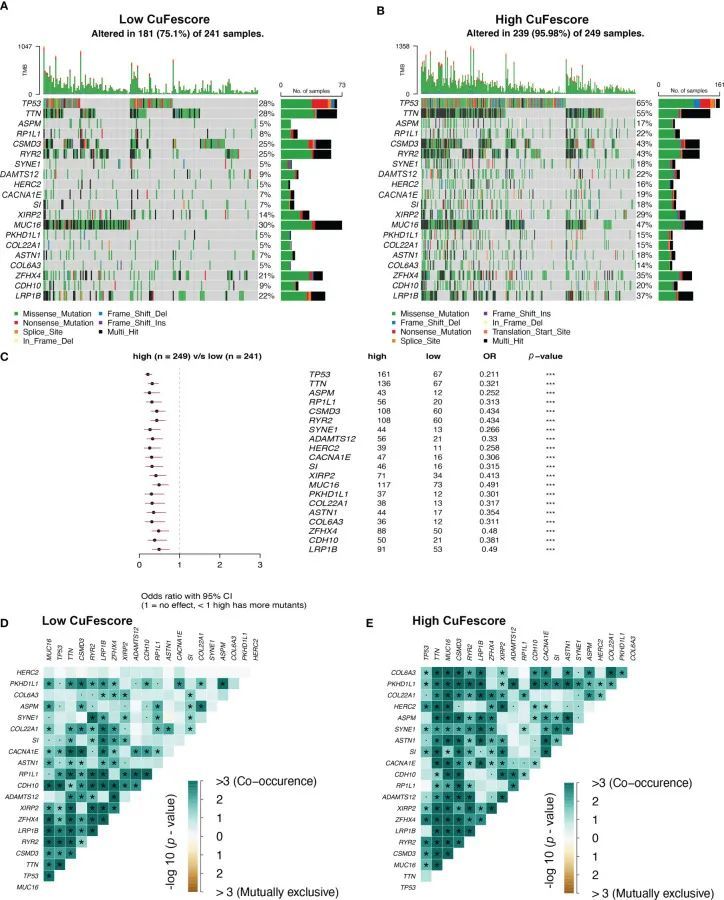
图7 CuFe评分与肿瘤突变状态的相关性
7. CuFescore预测化疗和免疫治疗的益处
为了评估CuFe评分预测化疗药物反应性的价值,计算了138种药物的IC50值(图8A)。CuFe评分低的患者对阿西替尼(p=0.0014,图8B)和埃洛替尼(p<0.001,图8C)有很强的敏感性,而CuFe评分高的患者对多西他赛(p<001,图8D)和吉西他滨(p<.001,图8E)有很高的敏感性,这表明CuFe评分可能被用作抗LUAD药物的预测性生物标志物。
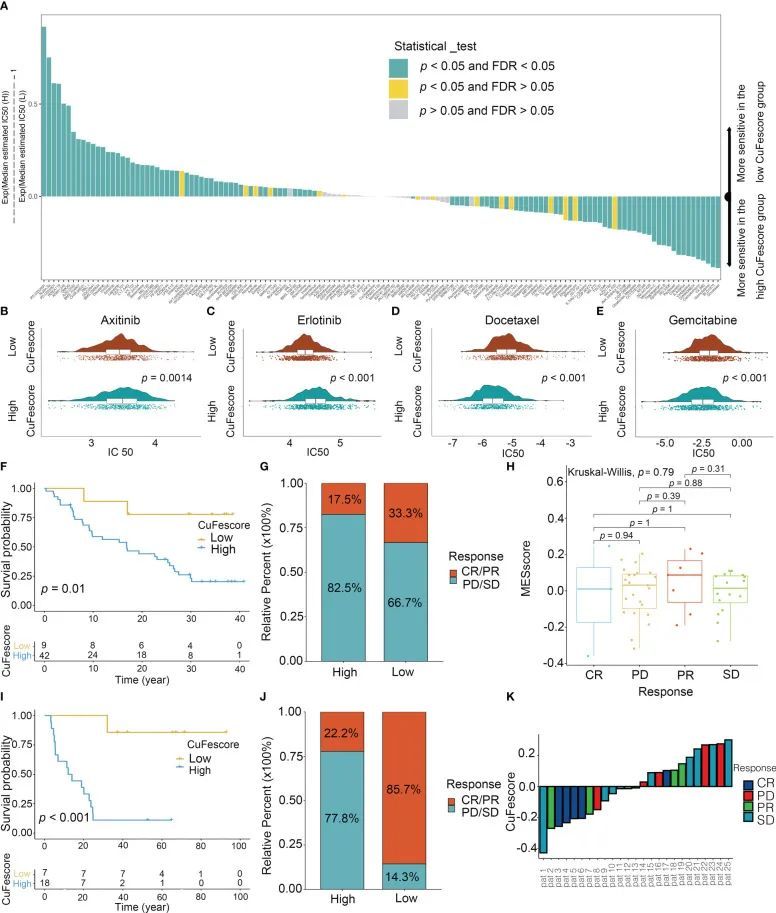
图8 CuFescore在化疗和免疫治疗中的作用
为了探讨CuFe评分对免疫检查点阻断(ICB)治疗反应的预测价值,作者用CuFe评分分析了2个免疫治疗队列(GSE91061和GSE100797)。根据铜死亡/铁死亡调节因子相关基因的水平,作者计算了接受免疫治疗的患者的铜铁评分,并将他们分为高铜铁评分组和低铜铁分数组。在GSE91061队列中,与接受抗CTLA4和抗PD1治疗的高CuFe评分组患者相比,低CuFe评分的患者预后更好(p=0.01,图8F)。尽管完全缓解(CR)、进展性疾病(PD)、部分缓解(PR)和稳定性疾病(SD)患者之间的CuFe评分没有差异(图8H),但低CuFe评分的患者对PD-1阻断表现出显著的治疗益处和改善的免疫敏感性(应答者/无应答者:33.3%/17.5%,图8G)。此外,这一发现也在GSE100797中得到了验证。CuFe评分低的患者生存期延长(图8I),治疗效果显著改善(有应答者/无应答者:85.7%/22.2%,图8J)。与CuFe评分高的患者相比,CuFe评分低的患者对过继性T细胞治疗的显著临床反应得到了验证(图8K)。总之,CuFescore与肿瘤免疫表型具有显著相关性,并能有效预测患者对ICB治疗的反应性。
8. CuFescore与miRNA和转录后调控相关
CuFescore是一个依赖于铜死亡和铁死亡调节因子的评估系统,这些调节因子存在于转录后修饰的关联中。为了评估CuFescore在转录和转录后事件解释中的调节,作者分析了APA事件。鉴于APA处理的转录物具有短的3’UTR,从而耐受miRNA的调节,作者假设CuFescore与miRNA的表达密切相关,这是APA事件作用下的潜在机制。在TCGA-LUAD队列中,作者在高和低CuFe评分组之间检测到79种差异表达的miRNA。参与自噬、ROS信号通路、MAPK信号通路和其他通路的miRNA靶向基因富集(图9A)。在参与自噬的56个miRNA靶向基因中,有29个的表达水平升高。此外,cGMP-PKG信号通路(11/22)和cAMP信号通路(12/23)在高CuFescore组中表达水平较低的miRNA靶向基因中富集。根据所获得的发现,CuFescore与miRNA的表达以及信号通路的调节有着非常紧密的联系。
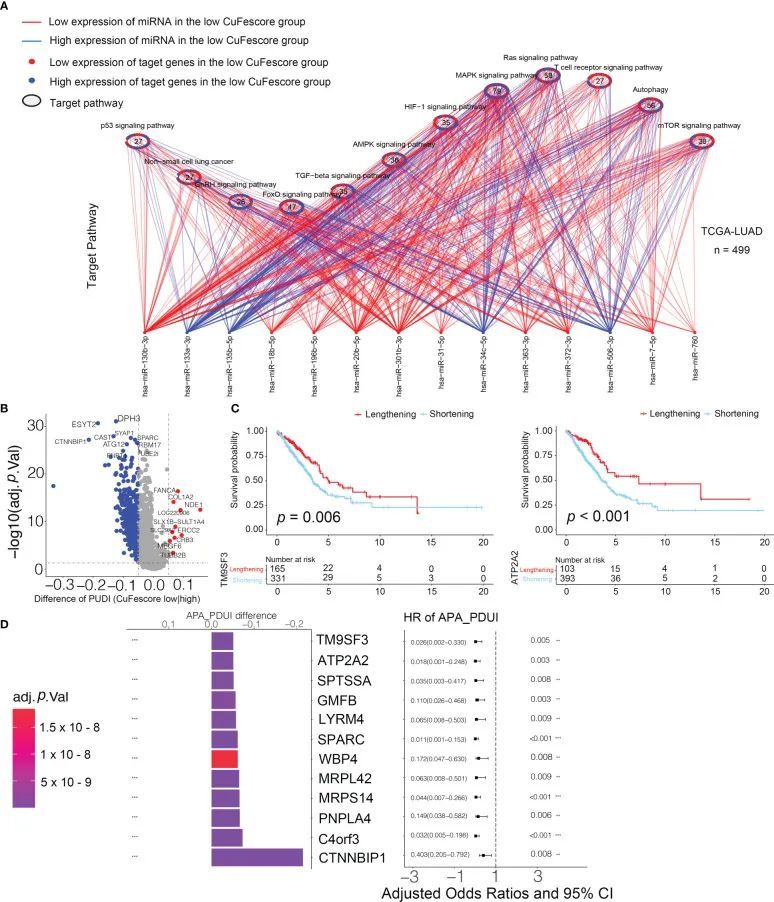
图9 与CuFescore和转录后特征相关
作者检测了APA事件,以发现CuFescore和转录后特征之间的联系。作者发现了高和低CuFe评分组之间具有APA差异的基因,并检查了预后意义,以显示LUAD患者的生存是否受3’UTR长度的影响(图9B)。APA事件延长的基因属于低CuFe评分组,与生存期延长一致(图9C)。TM9SF3和ATP2A2被认为是白血病、三阴性乳腺癌和弥漫性星形细胞瘤的原癌基因。2个基因的短转录本与个体的不良预后之间存在相关性(图9D)。此外,TM9SF3被3’UTR上的miR-1193直接靶向。作者的印象是,由于基因的3'-UTR已经缩短,miRNA可能不会与基因结合,从而消除对原癌基因的抑制作用,增强LUAD的进展。
总结
总之,作者建立了一个CuFescore模型来预测LUAD患者的预后,该模型与免疫检查点和突变密切相关。CuFescore是一种应用评分系统,用于评估对化疗药物的敏感性和确定有资格接受免疫治疗的LUAD患者。