肝细胞癌(HCC)是世界上最常见的恶性肿瘤之一,发病率高、恶性程度高、生存率低。铜死亡是一种由硫辛酸化三羧酸循环蛋白介导的新型细胞死亡方式,与线粒体代谢密切相关。然而,铜死亡相关基因(CRGs)的表达水平与HCC的预后关系仍不清楚。
1. CRG的差异表达和遗传改变
该研究的一般流程如图1所示。首先,作者从之前的研究中获得了19个CRGs(NFE2L2,NLRP3,ATP7B,ATP7A,SLC31A1,FDX1,LIAS,LIPT1,LIPT2,DLD,DLAT,PDHA1,PDHB,MTF1,GLS,CDKN2A,DBT,GCSH,DLST)。接下来,作者分析了TCGA数据库中HCC患者的肿瘤组织和正常组织之间的CRGs的差异表达基因。结果显示,APT7A,LIAS,LIPT1,LIPT2,DLD,DLAT,PDHA1,PDHB,MTF1,GLS,CDKN2A和DLST在肿瘤组织中的表达显著高于正常组织,而NLRP3,SLC31A1和DBT在正常组织中的表达水平较高(图2A)。CRGs表达的相关性分析显示MTF1和ATP7A之间存在强烈的正相关关系(图2B)。接下来,作者利用String(https://string-db.org/)构建了蛋白质相互作用(PPI)网络(图2C)。作者对CRGs进行了拷贝数变异(CNV)频率分析。结果显示,ATP7B和CDKN2A拷贝数的增加频率显著高于删除频率,而NLRP3和LIAS拷贝的删除频率显著高于删除频率(图2D,E)。作者还发现,在371个肝癌样本中,有38个体细胞(10.24%)发生了突变,其中CDKN2A的突变频率较高(3%)(图2F)。

图1 本研究的流程图
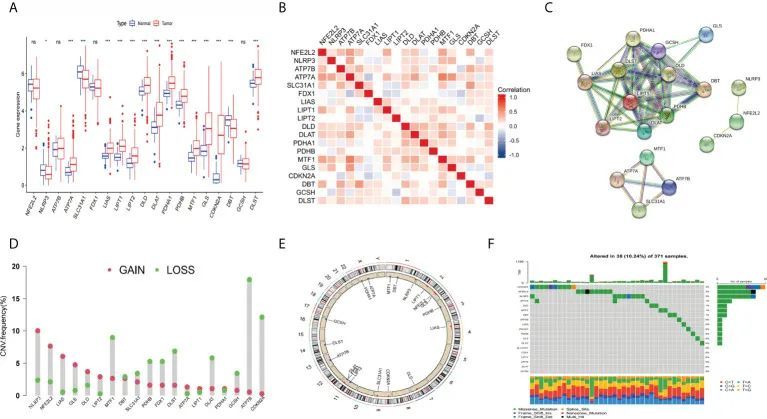
图2 HCC中CRGs的表达和遗传改变
接下来,作者使用KM分析和COX分析来评估TCGA和GSE76427数据集中HCC患者的CRGs的预后意义。研究表明,KM分析中的15个基因与OS预后相关(图3A-O)。COX分析显示这些基因与HCC患者相关。CRGs的预后网络图表明LIAS、FDX1、SLC31A1和ATP7B是HCC的保护因子,而NFE2L2、NLRP3、ATP7A、LIPT1、DLD、DLAT、PDHA1、PDHB、MTF1、GLS、CDKN2A、DBT、GCSH和DLST是风险因子(图3P)。
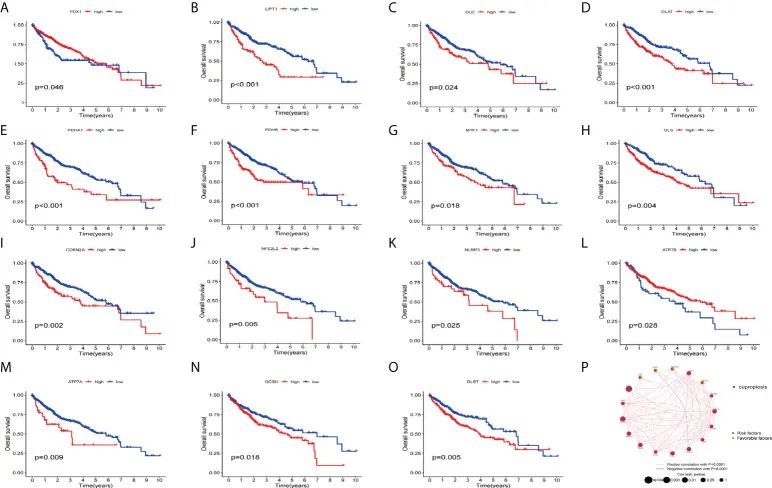
图3 HCC患者在TCGA和GEO中CRGs的预后意义
2. HCC患者在TCGA和GEO中CRGs的预后意义
亚型的一致性矩阵在K=3时效果最佳。因此,作者将所有HCC患者分为三个主要亚型(A亚型、B亚型和C亚型)(图4A)。接下来,作者对这三个亚型进行生存分析,KM曲线显示不同亚型之间的预后差异显著,而患有B亚型的HCC患者预后最好(图4B)。作者通过将TCGA和GSE76427中的HCC患者的年龄、性别和临床分期结合起来,构建了一个复杂的基于亚型的热图(图4C)。基因集变异分析(GSVA)显示了A亚型、B亚型和C亚型中前20个最显著通路的差异(图4D-F)。箱线图显示了三个亚型中不同免疫细胞比例的差异(图4G)。
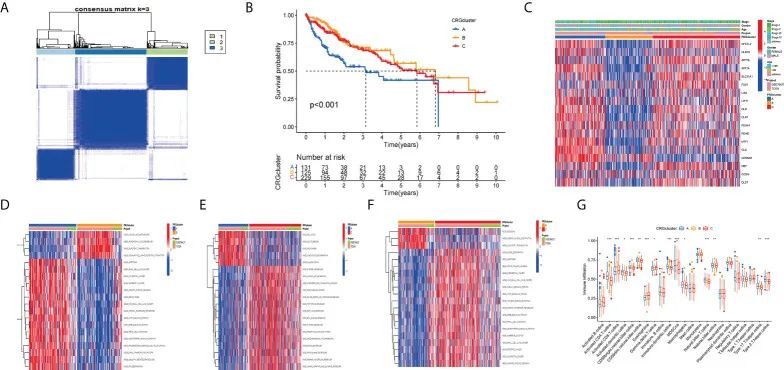
图4 标识的聚类分析
3. 交集基因和富集分析
主成分分析(PCA)结果显示,根据CRGs的表达水平,作者可以将群集A、群集B和群集C(图5A)进行分割。接下来,作者对这三个群集进行差异分析,以获得不同类型中不同表达的铜死亡相关基因(DECRGs)。Venn图显示了DECRGs的交集(图5B)。然后,作者使用GO和KEGG富集分析来确定可能的功能和通路。GO分析显示DECRGs与细胞组分(CC)中的内质网腔和基底侧质膜密切相关。生物过程(BP)主要涉及对异物刺激的反应和体液水平的调节。分子功能(MF)可以影响铁离子结合和单加氧酶活性(图5C)。KEGG富集分析的结果显示DECRGs参与了化学致癌- DNA加合物、酒精性肝病、细胞色素P450介导的异物代谢和药物代谢-细胞色素P450、胆汁分泌和视黄醇代谢(图5D)。
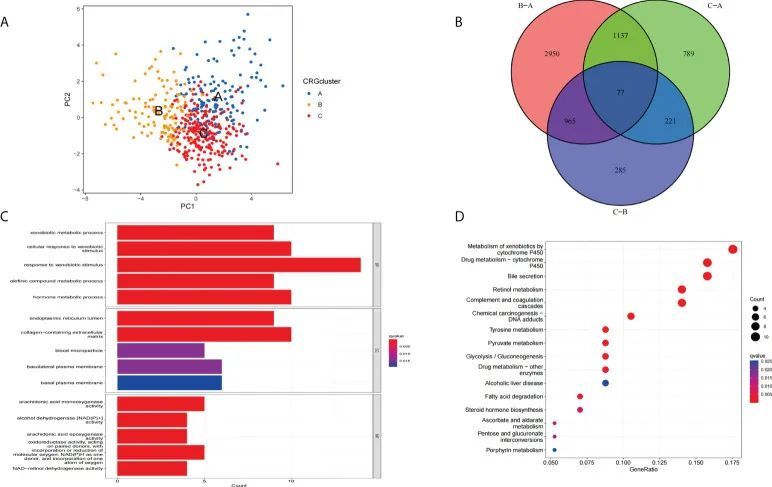
图5 DECRG的功能富集分析
4. 共识聚类分析用于分区亚型和预后模型构建
首先,作者以1:1的比例随机将487名患者分为训练集(n = 244)和测试集(n = 243)。然后,作者通过单变量Cox回归分析筛选出77个差异表达相关基因(DECRGs),以获得单变量显著基因(uniSigGenes),并对uniSigGenes进行亚型分型。
根据最高相关系数选择的k值,作者将所有HCC患者分为三个主要亚型(A类、B类和C类)(图6A、B)。B类亚型的患者与A类和C类亚型相比,具有更好的生存期(图6C)。通过将TCGA和GSE76427中HCC患者的年龄、性别和临床分期结合起来,构建了一个复杂的基于亚型的热图(图6D)。此外,作者分析了不同亚型之间与CRGs相关的基因的差异表达。箱线图显示,在B类亚型中,SLC31A1、FDX1、FDX1和GCSH的表达水平最高(图6E)。接下来,作者进行了LASSO回归分析,以减少在生成标识过程中基因的过拟合,并确定了11个显著基因(LASSOSigGenes)(图6F、G)。然后,对LASSOSigGenes进行了多变量COX回归分析,最终确定了最佳的四个基因(TAF6、SPP2、CFHR4、DNASE1L3)。训练集中的数据用于构建预后模型,训练集中的244名患者根据风险评分公式计算的中位数得分被分为低风险组和高风险组。然后,根据训练组风险评分的中位数值,将243名患者分为低风险组和高风险组。接下来,作者将训练集和测试集文件合并,得到所有的数据集文件。桑基图展示了预后模型的构建情况(图6H)。箱线图显示了CRGs聚类(图6I)和基因聚类(图6J)中风险评分的差异。对收集文件中CRGs表达的差异分析进行了箱线图结果展示(图6K)。
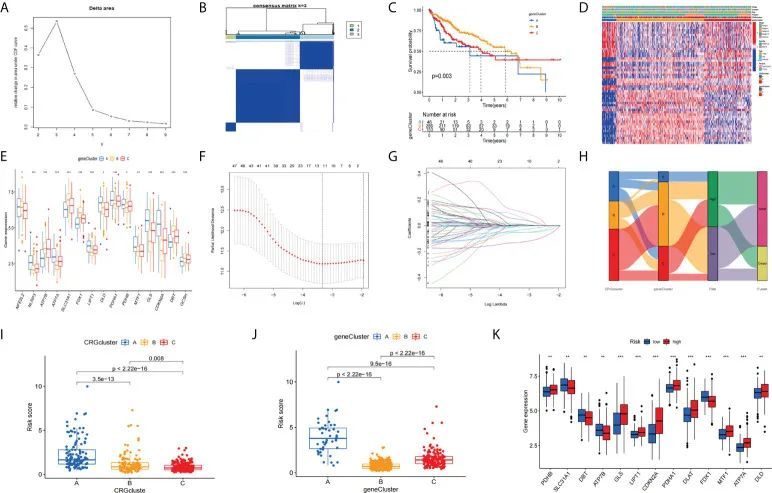
图6 标志的聚类分析
5. 验证该标志的预后价值
作者对整个数据集、训练集和测试集进行了预后分析。KM曲线显示,与高风险组相比,低风险组的总生存率概率更好(图7A-C)。此外,作者绘制了1年、2年和3年的ROC曲线,以评估该标志的敏感性和特异性(所有AUC > 0.600,图7E-G)。作者在所有数据集中进行了单变量和多变量COX回归分析。单变量Cox回归分析表明,风险评分和临床分期与总生存期相关(图7D)。多变量Cox回归分析还确定了风险评分和临床分期作为总生存期的独立预测因子(图7H)。接下来,作者构建了与总生存期相关的示意图,以测试比例风险假设(图7I)在多变量Cox模型中。随后的校准曲线进一步验证了示意图的准确性(图7J)。最后,作者对临床因素(年龄、性别和肿瘤分期)进行了临床分层分析,以了解该标志的适用性。作者观察到,对于年龄<= 65岁或> 65岁的HCC患者,低风险组的生存率明显高于高风险组(图7K,L,所有p <0.001)。此外,对于男性或女性HCC患者,低风险组明显高于高风险组(图7M,N,所有p <0.05)。同样,对于肿瘤分期I-II(p <0.001)或III-IV(p <0.001)的患者,低风险组的生存率明显高于高风险组(图7P,O)。
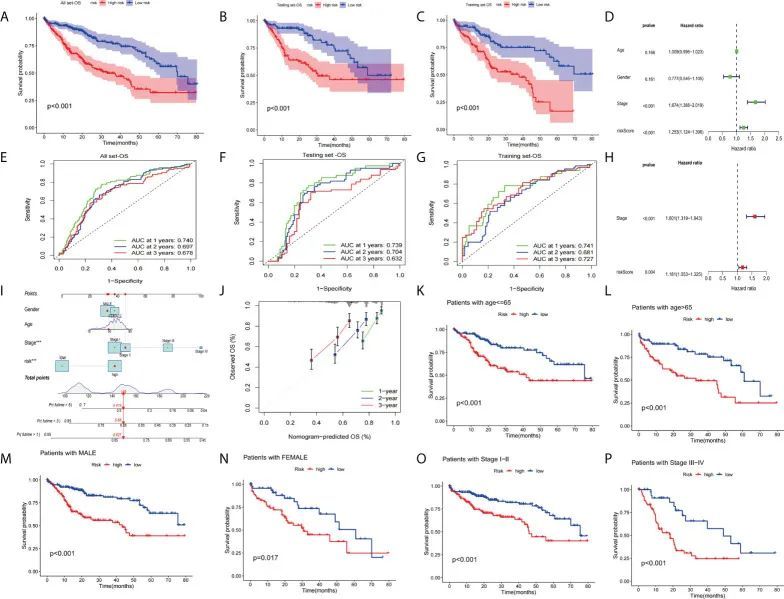
图7 验证预后价值的标志
接下来,作者分析了构建该标志的四个基因在整个数据集(图8A)、训练集(图8B)和测试集(图8C)中的表达差异。通过热图的映射,作者发现TAF6基因上调,而SPP2、CFHR4和DNASE1L3基因在低风险组中表达较高。此外,作者还分析了TP53基因的突变情况,发现在这三个组中,高风险组中TP53基因的突变频率较高(图8D、图8E、图8F)。
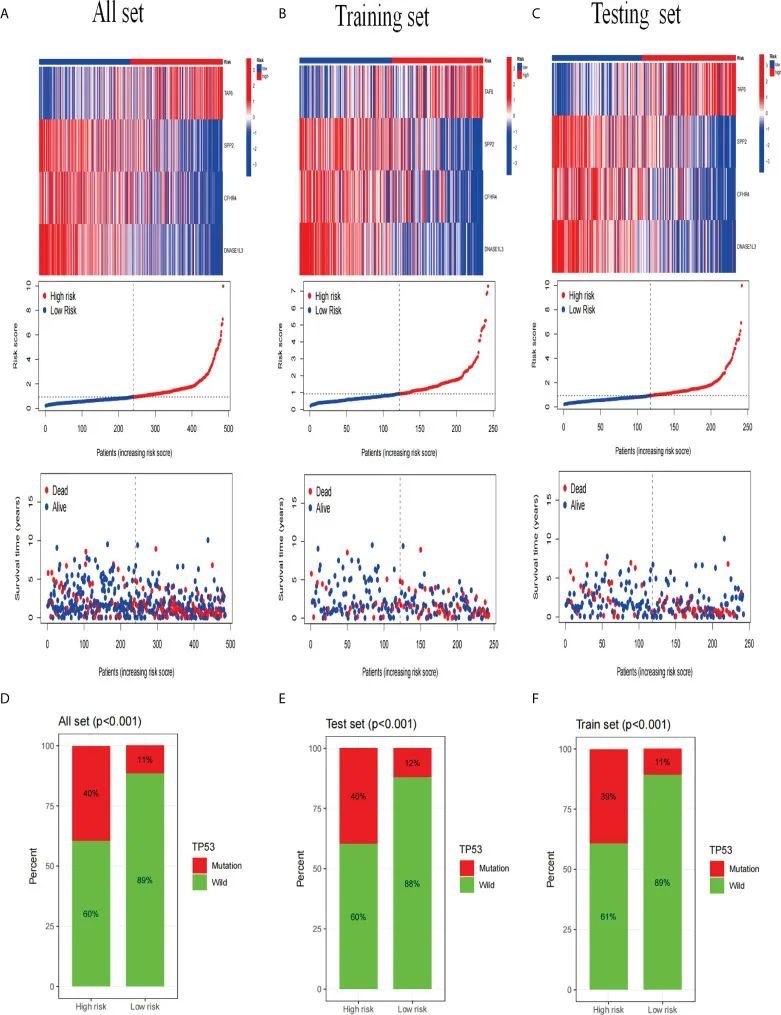
图8 基因表达和突变相关性分析
6. 基因表达和突变相关性分析
免疫疗法已经彻底改变了癌症治疗,使癌症患者的生存时间更长。然而,免疫细胞浸润和免疫检查点是免疫疗法中的重要因素。因此,作者对特征和免疫之间的关系进行了多方面的分析。结果显示,两组之间没有差异,风险组的基质得分和估计得分显著高于高风险组(图9A)。接下来,作者分析了这四个基因与免疫细胞的相关性。相关性热图(图9B)显示了免疫相关性的结果。然后,作者分析了高风险组和低风险组之间检查点基因的表达情况。箱线图结果显示所有检查点基因的表达在统计上都有显著差异(图9C),尤其是IDO2、TNFRSF14、CTLA4、TNFRSF18、TNFRSF4、LGALS9、CD276、HHLA2、CD80、VTCN1、HAVCR2、TNFSF4和TNFSF15(p<0.001)。研究表明,肝癌的复发、转移和化疗抵抗与癌症干细胞的存在有关。
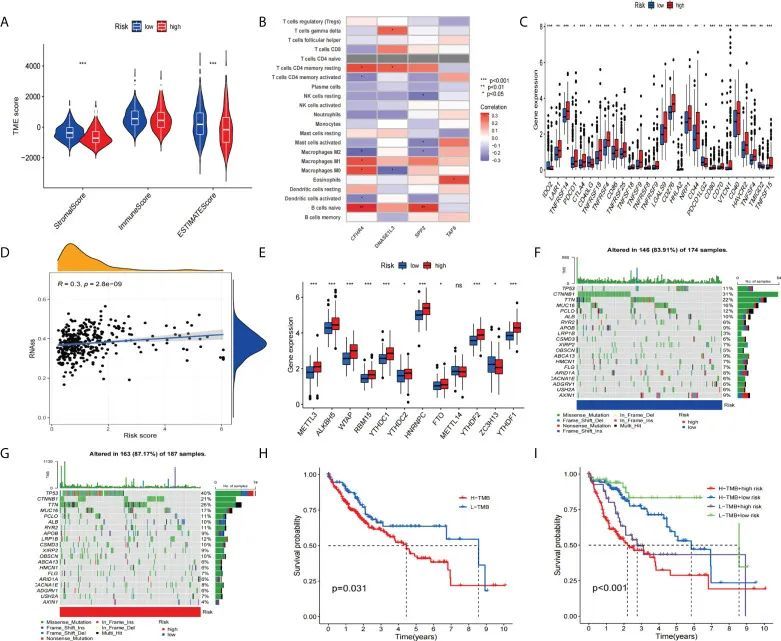
图9 为了评估不同组别的肿瘤微环境、免疫检查点基因和肿瘤突变负荷(TMB)
所以作者进行了干细胞相关性分析。相关散点图(图9D)显示了更高的风险评分和更高的干细胞含量。此外,作者分析了高风险组和低风险组之间的m6A相关基因表达差异。结果(图9E)显示,METTL3、ALK8H5、WTAP、RBM15、YTHDC1、YTHDC2、HNRNPC、FTO、YTHDF2和YTHDF1在高风险组中的表达较低风险组更高。接下来,作者分析了高风险组和低风险组的突变频率差异。瀑布图显示(图9F、G),TP53的突变频率在高风险组中远高于低风险组。此外,KM生存曲线显示了更高的TMB值和更高的风险评分与较差的生存率相关(图9H、I)。
7. 标志预测化疗和免疫疗法的疗效
作者比较了高风险和低风险人群之间的关系,并评估了该特征对HCC药物治疗的预测效果。作者的研究表明,低风险组与阿昔替尼、伊马替尼、拉帕替尼、吉非替尼和比卡鲁胺等化疗药物的IC50显著相关(图10A-E)。相反,高风险组对顺铂、吉西他滨、多柔比星、依托泊苷、雷帕霉素和尼洛替尼的治疗更敏感(图10F-K)。此外,作者通过TIDE评分评估了高风险和低风险患者在免疫治疗方面的差异。结果显示,高风险患者的TIDE评分明显较低(图10L)与低风险患者相比。接下来,作者使用TIMER2.0对构成该特征的四个基因与PDC1、LMTK3和CTLA4表达进行相关分析。经过纯度调整后,结果显示,在肝细胞癌中,CFHR4、DNASE1L3和SPP2的表达水平与PDCD1、LMTK3和CTLA4显著负相关,而TAF6与PDCD1、LMTK3和CTLA4呈正相关。
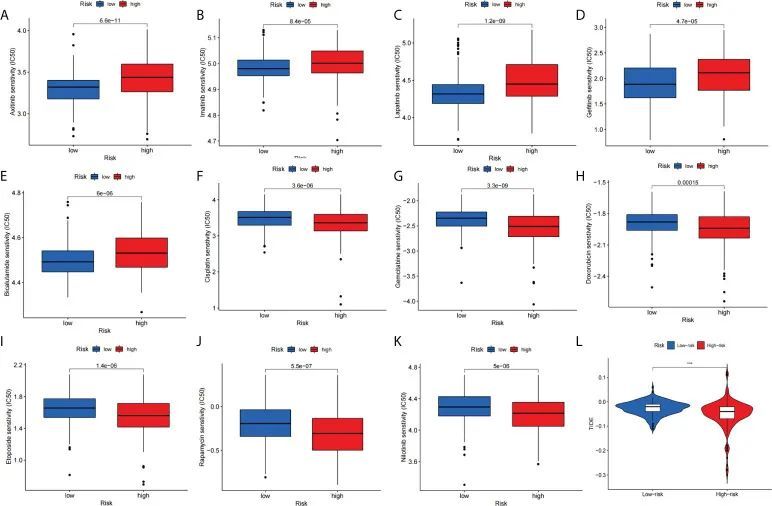
图10 标志预测化疗和免疫疗法的反应
8. 差异表达分析和预后分析的标志基因
为了进一步探索标识的可信度,作者对来自TCGA和CPTAC的数据进行了标识基因表达的差异分析。TCGA数据的分析显示(图11A-D),CFHR4、DNASE1L3和SPP2在癌旁非肿瘤组织中显著升高,而TAF6在HCC组织中上调。然后作者分析了CPTAC数据集,结果与之前的研究一致(图11E-H)。此外,作者使用TIMER2.0分析了HCC患者中野生型TP53和突变型TP53两组之间的标识基因表达差异。箱线图(图11I-L)显示CFHR4、DNASE1L3和SPP2在野生型TP53组中的表达水平较高,而TAF6在突变型TP53组中表达水平较高。
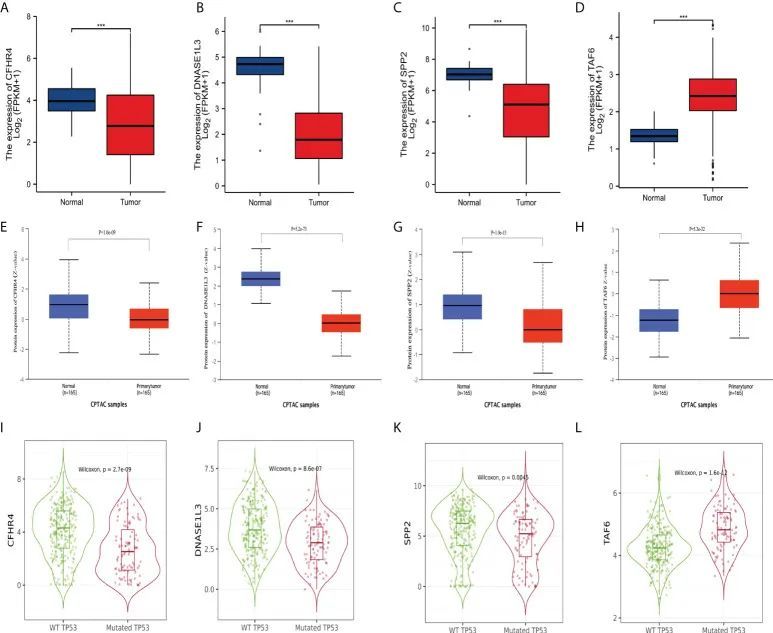
图11 特征基因的差异表达情况
接下来,作者分析了标记基因与预后的关系。作者使用Kaplan-Meier Plotter来分析HCC患者中标记基因与总体生存(OS)的关联。OS的KM曲线显示,所有四个基因与HCC患者的预后显著相关。然后,作者对ICGC数据库中的肝癌数据进行了预后分析(附图2B)。结果表明,CFHR4和DNASE1L3的低表达与HCC患者的不良预后相关,而TAF6的高表达与患者的不良预后相关。此外,作者还分析了TCGA数据库中HCC的不同组织学分级、病理分期和T分期中标记基因的差异表达。除了DNASE1L3在T分期之间没有显示出统计学差异外,这四个基因(CFHR4、DNASE1L3、SPP2和TAF6)在不同组织学分级、病理分期和T分期的HCC中的表达水平有所变化。
9. 验证标识基因表达水平
作者在南昌大学第二附属医院收集了16例肝细胞癌(HCC)患者的组织样本,用于分析特征基因表达水平。实时定量PCR结果显示,CFHR4、SPP2和DNASE1L3在非肿瘤组织(非肿瘤)中的表达水平较肿瘤组织(肿瘤)高(图12A-C),而TAF6在肿瘤组织中的表达水平较非肿瘤组织高(图12D)。由于TAF6在这四个特征基因中的重要性,作者进一步对其进行了评估。免疫组化结果显示,TAF6在肝癌中高度表达(图12E,F)。这些结果进一步验证了上述生物信息学研究的正确性。此外,作者还评估了肝癌细胞系中TAF6的表达水平,包括HepG2、SMCC7721、MHCC97H、Huh-7和HCCLM3。如图12G所示,与HL7702(正常肝细胞)相比,肝癌细胞系中TAF6的表达水平相对较高。接下来,作者选择TAF6 mRNA表达水平最高的HCCLM3进行后续试验。使用实时定量PCR检测了TAF6的沉默效率。柱状图(图12H)显示si-TAF6#1和si-TAF6#2的沉默效果更好。
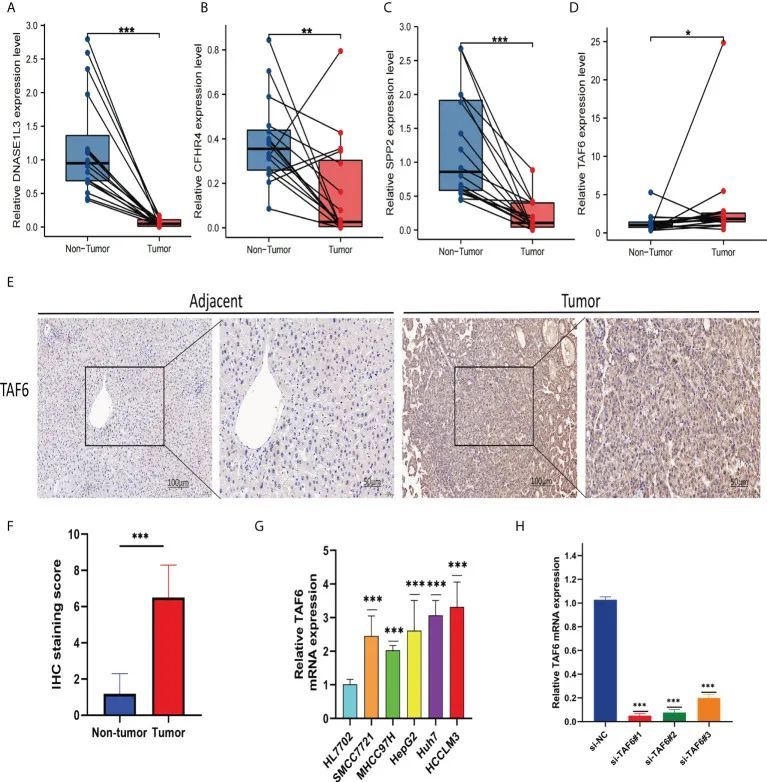
图12 验证组织中四个标志基因的mRNA表达水平
10. TAF6的表达与HCC的预后不良相关
在后续试验中,作者使用了更好的si-TAF6#1和si-TAF6#2进行了实验。为了评估TAF6对HCC细胞增殖的影响,作者在HCCLM3细胞中使用了CCK-8和EdU染色实验,分别进行了TAF6的干扰和非干扰组。在干扰TAF6表达后,si-TAF6#1和si-TAF6#2组的细胞增殖率明显低于si-NC组(图13A、D、E)。进一步分析了抑制TAF6表达对HCC细胞迁移的影响。透过Transwell实验和划痕愈合实验,作者发现抑制TAF6表达可以显著降低HCCLM3细胞的迁移能力(图13B、C、F、G)。此外,作者还探索了HCC细胞中免疫检查点PD-1与TAF6之间的关系。有趣的是,作者发现抑制TAF6表达可以通过免疫印迹法降低PD-1的蛋白表达(图13H-J)。总结来说,在体外实验数据中,高表达的TAF6与HCC患者的免疫治疗效果好和预后差密切相关。
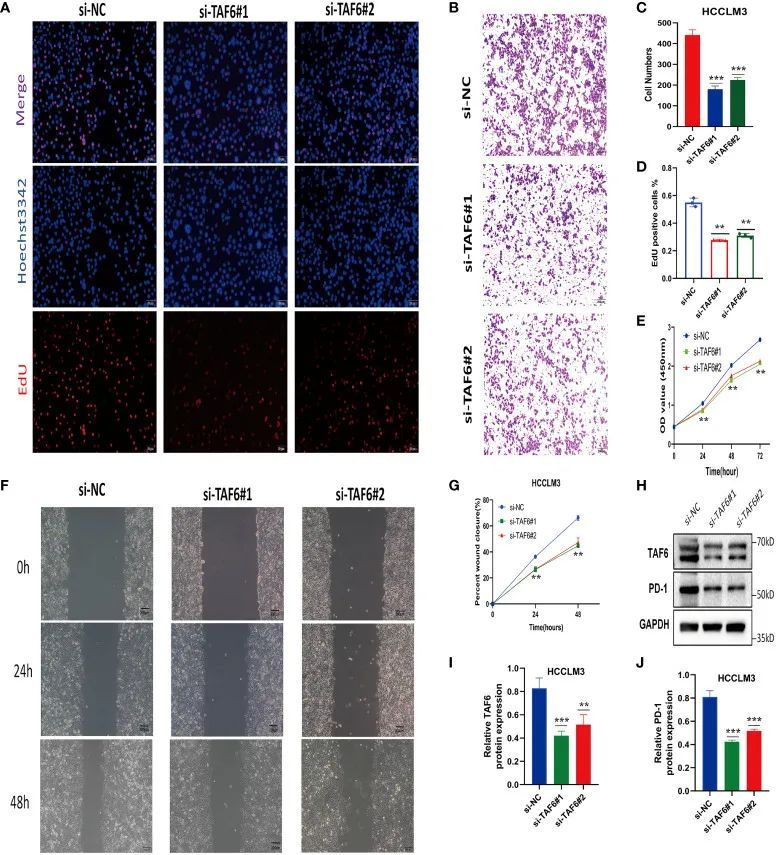
图13 TAF6对HCC的体外不良影响
总结
总之,作者构建了一个新的预后相关基因(CRGs)标识,以更好地预测肝细胞癌(HCC)的预后。这个标识将帮助临床医生评估患者的整体预后,并为制定治疗策略提供新的思路。


![[每周一更]-(第63期):Linux-nsenter命令使用说明](https://img-blog.csdnimg.cn/cf674001010b4247a162c2173c46b6d9.jpeg#pic_center)