声明
本文是学习GB-T 18643-2021 鸡马立克氏病诊断技术. 而整理的学习笔记,分享出来希望更多人受益,如果存在侵权请及时联系我们
1 范围
本标准规定了鸡马立克氏病临床诊断,以及病毒分离、琼脂免疫扩散试验、PCR
检测和荧光定量
PCR 检测等实验室检测的技术要求和综合判定。
本标准适用于鸡马立克氏病的检测、诊断、检疫和流行病学调查等。
2 缩略语
下列缩略语适用于本文件。
AGID: 琼脂免疫扩散试验(Agar gel immunodiffusion)
AL: 禽白血病(Avian leukosis)
CEF: 鸡胚成纤维细胞(Chicken embryo fibroblast)
CKC: 鸡肾细胞(Chicken kidney cells)
DEF: 鸭胚成纤维细胞(Duck embryo fibroblast)
CPE: 致细胞病变效应(Cytopathic effect)
DEF: 鸭胚成纤维细胞(Duck embryo fibroblast)
DNA: 脱氧核糖核酸(Deoxyribonucleic acid)
EB:溴化乙锭(Ethidium bromide)
FBS:胎牛血清(Fetal bovine serum)
LL: 禽淋巴性白血病(Lymphoid leukosis)
M199:M199 培养基(M199 Medium)
MD: 鸡马立克氏病(Marek’s disease)
MDV: 鸡马立克氏病病毒(Marek’s disease virus)
PCR: 聚合酶链式反应(Polymerase chain reaction)
PBS:磷酸盐缓冲液(Phosphate-buffered saline buffer)
RE: 禽网状内皮组织增生病(Reticularendotheliosis)
3 临床诊断
3.1 临床症状
在鸡群中,病鸡临床症状表现为严重消瘦,瘫痪且两腿前后伸展呈"劈叉"姿势,皮肤毛囊结节以及
眼盲症等, 一般可以作为 MD 的示病症状,可初步推测为 MD。
3.2 剖检变化
3.2.1 内脏型
内脏型 MD
的病理变化为肝、性腺、脾、肾、肺、前胃及心脏出现广泛的弥漫性淋巴瘤。青年鸡的肝
脏一般中度肿大,但成年鸡肝脏严重肿大。
GB/T 18643—2021
3.2.2 神经型
神经型MD
的病理变化为外周神经肿胀,呈半透明水肿样,色泽变淡,横纹消失,其肿胀程度一般
为正常神经的2倍~3倍。这些变化多发生在腰荐神经丛、坐骨神经丛、臂神经丛、颈部迷走神经丛等
部位。由于多为不对称性,通过比较对侧神经将有助于判定。
3.2.3 皮肤型
皮肤型 MD
病理变化比较少见。其病理变化特征为:以皮肤的羽毛囊为中心,形成半球形隆起的
肿瘤,其表面有时可见鳞片状棕色痂皮。
3.2.4 眼型
眼型 MD
是由于淋巴细胞浸润虹膜而导致的病理变化,虹膜呈环状或斑点状褪色,出现淡灰色;瞳
孔不规则,有时偏向虹膜一侧。
3.3 病理组织学变化
采集病鸡肿胀的外周神经和内脏的肿瘤组织样品,按常规方法制备石蜡切片、苏木素伊红染色,通
过普通光学显微镜进行病理组织学观察判定。
根据病变组织中浸润细胞的种类及形态学,外周神经病理组织学变化可分为A、B、C三个型。在同
只鸡的不同神经可能会出现不同的病变型。 A
型病变以淋巴母细胞,大、中、小淋巴细胞及巨噬细胞的 增生浸润为主。 B
型病变表现神经水肿,神经纤维被水肿液分离,水肿液中以小淋巴细胞、浆细胞和许
旺氏细胞增生为主。 C 型病变为轻微的水肿和轻度小淋巴细胞增生。
内脏和其他组织的肿瘤与 A
型神经病变相似。通常以出现大小各异的淋巴细胞增生为主。
3.4 鉴别诊断
3.4.1 与禽白血病(Avian leukosis,AL)鉴别诊断
AL 在病理剖检中容易与缺乏外周神经病变的内脏型 MD 相混淆。
一般需要通过流行病学和病理 组织学进行鉴别诊断。常见的AL
包括由A、B亚群白血病病毒引起的禽淋巴性白血病(Lymphoid leu-
kosis,LL)和由J 亚群白血病病毒引起的髓细胞瘤白血病。
在流行病学方面,AL
一般发生于16周龄以上的鸡,多发生于24周龄~40周龄之间。而 MD 的死
亡高峰一般发生在10周龄~20周龄之间。另外,LL 的发病率较低,
一般不超过5%,而 MD 的发病率
较高。
LL 肿瘤病理组织学变化主要表现为大小均一的淋巴母细胞增生浸润。另外,在
LL 与 MD 引起的 法氏囊肿瘤中,其肿瘤细胞的浸润部位存在着差异。 MD
肿瘤细胞主要在滤泡间增殖,而 LL 肿瘤细胞
则主要在滤泡内增殖。
J
亚群白血病病毒引起的肿瘤病主要包括髓细胞性、成红细胞性和成髓细胞性白血病,以及肾母细
胞瘤、血管肉瘤和组织细胞性肉瘤病。前三者的主要表现是在受影响的组织器官内,可见显著的未成熟
髓细胞的增殖。肿瘤细胞大小不一,核浆比高,呈现细胞多形性,细胞核呈椭圆形,个体较大且偏心分
布,核膜增厚且不规则。核仁明显,染色质呈细密的点状或较大点状或浓染块状分布,并可见非典型的
核分裂像。肿瘤细胞的细胞质中含有少量至多量的球形嗜酸性颗粒。 J
亚群白血病病毒引起的髓细胞
瘤白血病在病理组织学上易与 MD 区分。
3.4.2
与禽网状内皮组织增生病(Reticularendotheliosis,RE)鉴别诊断
尽管 RE
在不同的鸡群中感染率差异较大,但一般发病率较低。本病在病理组织学方面,RE
法氏
GB/T 18643—2021
囊肿瘤主要表现为慢性 B
细胞性淋巴瘤,与淋巴细胞性白血病相似;非法氏囊肿瘤主要表现为 T 细 胞
性淋巴瘤,表现为形态相似的淋巴母细胞增殖,可能混杂有一部分小型淋巴细胞。
3.5 临床诊断判定
发病鸡符合 MD 临床症状和病理变化,判定为 MD 疑似病例。
4 病毒分离
4.1 试剂
4.1.1 磷酸盐缓冲液(PBS pH 7.4):配方见 A.1。
4.1.2 细胞培养液与细胞维持液:配方见 A.2。
4.1.3 淋巴细胞分离液。
4.1.4 SPGA/EDTA 缓冲液:配方见 A.3。
4.1.5 细胞冻存液:配方见A.4。
4.2 器材
4.2.1 倒置显微镜。
4.2.2 超声波仪。
4.2.3 细胞培养箱。
4.2.4 微量可调移液器:(10μL~200μL,50μL~300μL) 单道移液器。
4.2.5 手动或电动移液装置。
4.2.6 细胞培养皿。
4.3 细胞
4.3.1 鸡肾细胞。
4.3.2 鸭胚成纤维细胞。
4.3.3 鸡胚成纤维细胞。
4.4 操作方法
4.4.1 病料处理
4.4.1.1 淋巴细胞的分离
无菌采集疑似 MD 发病鸡的抗凝血,按照常规方法,利用淋巴细胞分离液分离。
4.4.1.2 羽髓组织处理
无菌采集疑似 MD 发病鸡羽髓于离心管中,剪碎,加入1 mL SPGA/EDTA
缓冲液,悬浮,悬浮液
超声后用0.45 μm 的滤膜进行过滤。
4.4.2 制备单层细胞
按常规法制备原代的 CKC 或 DEF 或 CEF,37℃
静置培养,形成单层细胞后用于病毒接种。
4.4.3 接种细胞
将0.2 mL 悬浮液用细胞维持液稀释至1 mL
接种到单层细胞中(细胞培养皿的直径为60 mm), 将
接种和未接种的对照细胞放在细胞培养箱中进行培养。羽髓组织悬液在接种细胞前,应倒掉细胞培养
GB/T 18643—2021
液,加入羽髓组织悬液经40 min 吸附后加入细胞维持液。每2 d
换一次细胞维持液,若被检样品中含 有 MDV, 通常在3 d~5d 时出现 CPE,
形成由圆形和梭形的折光性细胞和多核细胞组成的蚀斑,大约
7 d~10d时进行蚀斑计数。
4.4.4 病毒继代或收获
每天观察并记录。7 d~10d 后,视CPE
情况,按常规方法继代或冻存细胞毒于液氮中。
4.4.5 病毒鉴定
4.4.5.1 血清学鉴定
应用标准抗原和阳性血清按5.4.1方法进行,中央孔加血清,检测分离毒抗原。
4.4.5.2 分子生物学鉴定
按照6.4 方法进行 PCR 检测。
4.5 病毒分离检测结果判定
以4.4.5任何一种方法检测为阳性,都可以判定为 MDV 阳性。
5 琼脂免疫扩散试验检测
5.1 概述
MD
AGID既可用于抗原的检测,也可以用于抗体的检测。在人工感染试验中,病毒抗原一般在
MDV 感染鸡14 d~24d 后可检测到;抗体一般在病毒感染21 d 后可检测到。
5.2 试 剂
5.2.1 标准抗原:MDV 抗原由 MDV 标准强毒的细胞培养物制备。
5.2.2 标准阴、阳性血清:标准阴、阳性血清分别由 SPF 鸡和接种 MDV
标准强毒的细胞培养物的 SPF 鸡血清制备。
5.2.3 溶液配制
5.2.3.1 磷酸盐缓冲液(PBS pH 7.4
5.2.3.2 1%硫柳汞溶液:配方见 B.1。
5.2.3.3 生理盐水:配方见B.2。
5.2.3.4 琼脂平板的制备:配方见B.3。
5.3 器材
5.3.1 平 皿
5.3.2 打孔器。
5.3.3 针 头 。
5.4 操作方法
5.4.1 抗原(病原)检测
5.4.1.1 打 孔
在已制备的琼脂板上,用直径4 mm 或 3 mm
直径的打孔器按六角形图案打孔,或用梅花形打孔器
GB/T 18643—2021
打孔。中心孔与外周孔距离为3 mm。
将孔中的琼脂用针头挑出,应避免琼脂层脱离平皿底部。
5.4.1.2 封底
用酒精灯火焰轻烤平皿底部至琼脂轻微融化为止,封闭孔的底部。
5.4.1.3 加样
用微量移液器吸取用灭菌生理盐水稀释的标准阳性血清(按产品使用说明书的要求稀释),滴入中
央孔。标准阳性抗原悬液分别加入外周相对的两孔中,在外周的其余孔中加入被检的羽髓浸出液。每
孔均以加满不溢出为度,每加一个样品应换一个吸头。
5.4.1.4 感作
加样完毕后,静置5 min~10
min,将平皿轻轻倒置,放入湿盒内,置37℃温箱中反应,分别在24 h
和48 h 观察结果。
5.4.2 抗体检测
操作方法同5.4.1,按如下操作加样:标准抗原液用灭菌生理盐水稀释(按产品使用说明书的要求稀
释),用微量移液器吸取,滴入中央孔,标准阳性血清分别加入外周相对的两孔中,待检血清按顺序分别
加入外周的其余孔中。每孔均以加满不溢出为度,每加一个样品应换一个吸头。
5.5 结果判定
5.5.1 MD 琼脂免疫扩散试验结果判定示意图见图1:
标准阳性血清
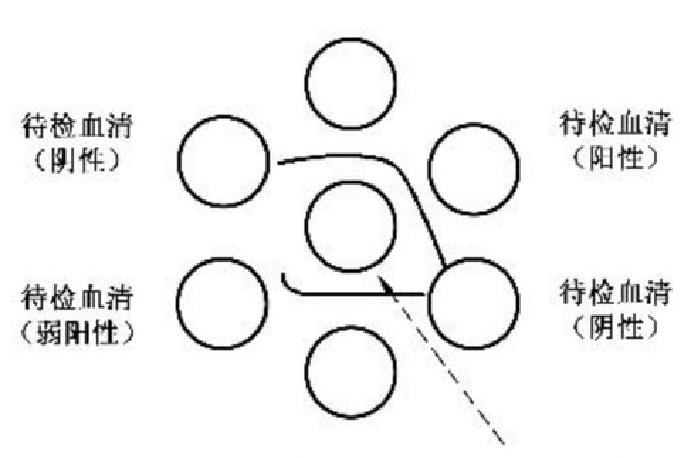
标准阳性血清 标准阳性抗原
标准阳性抗原
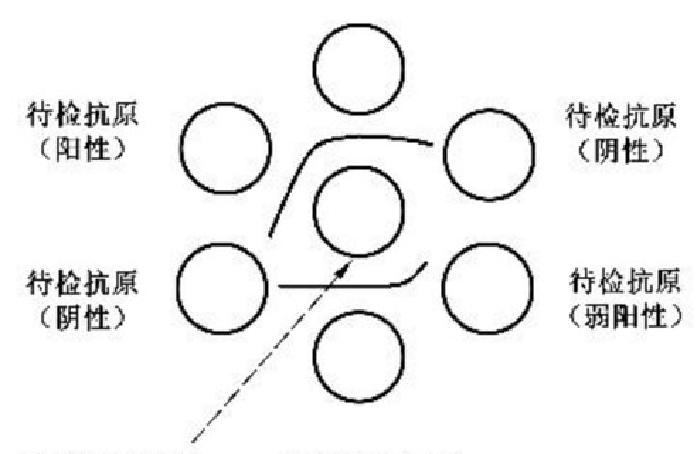
标准阳性血清 标准阳性抗原
图 1 MD 琼脂免疫扩散试验结果判定示意图
5.5.2
将琼脂板置日光灯或侧强光下进行观察,当标准阳性血清与标准抗原孔间有明显沉淀线,表明
阳性对照成立;在阳性对照成立情况下,当待检血清(或抗原)与标准抗原(或标准阳性血清)孔间有明显
沉淀线,且此沉淀线与标准抗原和标准血清孔间的沉淀线末端相融合,则待检样品为阳性。
5.5.3
当标准阳性血清与标准抗原孔的沉淀线的末端在比邻的待检血清孔或待检抗原孔处的末端向
中央孔方向弯曲时,待检样品为弱阳性。
5.5.4
当阳性对照成立,而待检血清(或抗原)与标准抗原(或标准阳性血清)孔之间无沉淀线,或标准
阳性血清与抗原孔间的沉淀线末端向毗邻的待检血清孔或待检抗原孔直伸或向外侧偏弯曲时,该待检
血清为阴性。
5.5.5 介于阴、阳性之间为可疑。可疑应重检,二次检测仍为可疑判为阳性。
GB/T 18643—2021
6 PCR 检测
6.1 概述
针对 MDV 血清1型病毒特有的 meq 基因和132碱基重复序列(132 bpr)的 PCR
检测,可以对
MDV
血清1型病毒感染进行检测和鉴定;同时可以对野毒株和疫苗株感染加以区分。
6.2 试剂
6.2.1 阴性和阳性对照:分别为 SPF 鸡的组织和 MDV
强、弱毒细胞株培养物提取的核酸, -20℃ 保存。
6.2.2 组织细胞裂解液:为病毒总DNA 提取试剂,配方见附录C 中 的C.1。
6.2.3 苯酚,氯仿,异戊醇:均为分析纯。
6.2.4 75%乙醇:用无水乙醇和水配制, -20℃预冷。
6.3 器材
6.3.1 PCR 扩增仪。
6.3.2 台式低温高速离心机。
6.3.3 稳压稳流电泳仪和水平电泳槽。
6.3.4 凝胶成像仪(或紫外透射仪)。
6.3.5 - 20℃冰箱。
6.3.6 微量可调移液器(0.5μL~10μL、5μL~40μL、40μL~200μL和200μL~1000μL
各1支)。
6.3.7 PCR 扩增管。
6.4 操作方法
6.4.1 样品准备
本方法适用所有的 MD
病原样品,包括羽髓、肝脏、脾脏、肾脏等器官,以及淋巴细胞与细胞培养物
等。在无菌环境中,将采集的动物机体组织研磨,加 PBS 洗2次,12000 g/min
离心10 min,取沉淀用
于提取总 DNA。 细胞样品不需要研磨处理,直接用于提取总 DNA。
6.4.2 核酸提取
6.4.2.1 酚氯仿法
提取方法见C.2。
6.4.2.2 核酸提取等效方法
MDV 核酸提取可以采用细胞、血液和组织提取试剂盒,按照使用说明书操作。
6.4.3 PCR 扩增
6.4.3.1 扩增试剂的准备
在试剂配制区进行。设 PCR 反应数为n,n
为待检样品数+阳性对照+阴性对照,宜按 n+1 个反
应进行配制,每个样本检测反应体系配制见C.3。 将上下游引物(见 C.4),Taq
酶,buffer,dNTP 和去离 子水按照使用量加入到一个离心管中,混匀,每个 PCR
管中分装19μL,记录好待检样品管、阴性对照
管、阳性对照管,转移至样本处理区。
GB/T 18643—2021
6.4.3.2 加样
在样本处理区进行,在已分装有 PCR 反应液的 PCR
扩增管中分别加入已制备好的 DNA 溶液
1μL, 盖紧。
6.4.3.3 PCR 反应
将 PCR 管放入PCR 扩增仪中,按照设定扩增条件(见C.5)进行扩增。
6.4.4 琼脂糖凝胶电泳
6.4.4.1 1%琼脂糖凝胶板的制备:配方见 C.6。
依据样品数选用适宜的梳子,待凝胶冷却凝固后拔出
梳子(胶中形成加样孔),放入电泳槽中,加1×TAE 缓冲液(配方见 C.7)淹没胶面。
6.4.4.2 加样:取6μL~8μLPCR 扩增产物和2 μL
加样缓冲液混匀后加入一个加样孔。每次电泳同 时加样标准 DNA
Marker、阴性对照、阳性对照。
6.4.4.3 电泳:电压80 V~100 V,或电流40 mA~50 mA;
电泳30 min~40 min。
6.5 PCR 检测结果判定
6.5.1 试验成立判定
电泳结束后,取出凝胶板置于紫外透射仪或凝胶成像系统观察。阳性对照样品,meq
基因应检测 到786 bp 大小条带,132 bpr 应检测到317 bp
大小的条带,且阴性对照无扩增条带,则试验成立;否则,
此次试验视为无效。
6.5.2 阳性判定
6.5.2.1 若待检样品扩增结果,meq 基因检测为786 bp
或963 bp 大小条带;132 bpr 检测产物为317 bp 或 449
bp大小单一条带,或者为多带型条带(存在2条以上的条带,
一般可出现5条~8条,大小为185 bp, 317 bp,449 bp,581 bp,713 bp,845 bp,977
bp,1109 bp),表明检测样品中MDV 血清1型病毒阳性(示例图
见 C.8)。
6.5.2.2 若待检样品扩增结果,meq 基因检测为786 bp
大小条带,132 bpr 检测为317 bp 或449 bp 大 小单一条带,表明该 MDV
为野毒株(示例图见C.8)。
6.5.2.3 若待检样品扩增结果,meq 基因检测为963 bp
大小条带,132 bpr 检测为多带型条带(存在2条 以上的条带,
一般可出现5条~8条,大小为185 bp,317 bp,449 bp,581 bp,713 bp,845 bp,977
bp,
1109 bp),表明检测样品中MDV 血清1型病毒阳性,表明该MDV
为疫苗毒(示例图见图C.1、图 C.2)。
6.5.2.4 若待检样品 meq 基因检测和132 bpr
检测出现与6.5.2.2或6.5.2.3不一致情况,则需要序列
测定等方法进行综合分析。
6.5.3 阴性判定
如待检样品无目的条带扩增,判为阴性。
7 荧光定量 PCR(q-PCR) 检测
7.1 试剂
见6.2。
7.2 器材
7.2.1 荧光定量 PCR 扩增仪。
GB/T 18643—2021
7.2.2 其余器材:见6.3。
7.3 操作方法
7.3.1 样品准备
见6.4.1。
7.3.2 核酸提取
见6.4.2。
7.3.3 q-PCR 扩增
按如下步骤进行 q-PCR 扩增:
a) 扩增试剂的准备:在试剂配制区进行。设实时荧光定量 PCR 反应管数为
n,n 为待检样品数 +阳性管数+阴性管数,宜按n+1
个反应进行配制。配制反应液在冰盒中进行。每个样本检
测反应体系配制见附录D 中的 D.1。 将上下游引物及探针(见D.2), 热启动 Taq
酶,buffer, dNTP 和去离子水按照使用量加入到一个离心管中,混匀,每个
PCR 管中分装23μL,记录好
待检样品管、阴性对照管、阳性对照管,转移至样本处理区。
b) 加样:在核酸提取区进行。在每个 PCR 反应管内加入7.3.2制备的核酸2μL,
盖上盖子,
500 r/min~1000 r/min离心30 s。 转移至检测区。
c) q-PCR 反应:把 PCR 管放在荧光定量 PCR 仪器上,按照设定扩增条件(见
D.3)进行 q-PCR 扩增。
7.3.4 试验成立条件
试验成立条件如下:
a) 阳性对照扩增曲线应成标准的 S 曲线,且 Ct 值应小于25。
b) 阴性对照扩增曲线应为基线下的水平线。
7.4 q-PCR 检测结果判定
若被检样本检测结果显示曲线成标准的 S 曲线,且 Ct 值≤35,报告为 MDV
核酸阳性;若无 S 曲 线,报告为 MDV 核酸阴性;35<Ct
值≤40判定为可疑,可疑样品重新检测,如重复后仍然35<Ct 值≤40,
且扩增曲线均为典型的S 曲线,报告为 MDV 核酸阳性;如重复后仍然35<Ct
值≤40,且无典型 S 曲
线,报告为 MDV 核酸阴性。
8 综合判定
8.1 临床检测鸡只或相关细胞培养物,经病毒分离,或 AGID 试验,或 PCR
检测,或 q-PCR 检测,其中 一种方法检测为阳性,可判定为 MDV 感染。
8.2 临床疑似判定发生 MD 的鸡只,经分离出 MDV
且鉴定为野毒株感染,或经琼脂免疫扩散试验检 测出抗原阳性,或经 PCR
检测结果符合野毒株特征,可判定为发生 MD。
8.3 临床无明显特异症状的鸡只,经分离出MDV 且鉴定为野毒株感染,或经 PCR
检测结果符合野毒
株特征,判定为存在 MDV 野毒株感染。
8.4 临床无明显特异症状的鸡只,分离出 MDV 且鉴定为疫苗株感染,或经
PCR 检测结果符合疫苗株
特征,判定为正常的 MD 疫苗免疫。
GB/T 18643—2021
附 录 A
(规范性附录)
病毒分离用溶液配制
A.1 磷酸盐缓冲液(PBS pH7.4)
氯化钠(NaCl)
氯化钾(KCl)
磷酸氢二钠(Na₂HPO₄)
磷酸二氢钾(KH₂PO₄)
调 pH 值至7.4,加去离子水定容至1000 mL, 高压消毒灭菌112 kPa,30
min,保存于4℃。
A.2 细胞培养与细胞维持液
A.2.1 细胞培养液
M199 培养基 94 mL
胎牛血清 5 mL
双抗(其中青霉素浓度为10000 U/mL, 链霉素浓度为10 mg/mL) 1mL
将胎牛血清和双抗依次加入 M199 中混匀,保存于4℃。
A.2.2 细胞维持液
M199 培养基 96 mL
胎牛血清 3 mL
双抗(其中青霉素浓度为10000 U/mL, 链霉素浓度为10 mg/mL) 1 mL
将胎牛血清和双抗依次加入 M199 中混匀,保存于4℃。
A.3 SPGA/EDTA 缓冲液
| 蔗糖(Sucrose) | 7.462 g |
|---|---|
| 磷酸二氢钾(KH₂PO₄) | 0.052 g |
| 磷酸氢二钾(K₂HPO₄) | 0.125 g |
| L-谷氨酸钠 | 0.083 g |
| 牛血清粉 | 1.000 g |
| 乙二胺四乙酸(EDTA) | 0.200 g |
| 去离子水 | 80 mL |
调 pH 值至6.5左右,加去离子水定容至100 mL, 过滤除菌,保存于4℃。
A.4 细胞冻存液
M199 培养基 70 mL
GB/T 18643—2021
胎牛血清 20 mL
二甲基亚砜(DMSO) 10 mL
将胎牛血清和二甲基亚砜依次加入 M199 中混匀,保存于4℃。
GB/T 18643—2021
附 录 B
(规范性附录)
琼脂免疫扩散试验用溶液配制
B.1 1% 硫柳汞溶液
硫柳汞(C₉H₉HgNaO₂S) 1g
去离子水 100 mL
溶解后,置于100 mL 瓶中盖塞,室温保存。
B.2 生理盐水
氯化钠(NaCl) 0.9 g
加去离子至 100 mL
将氯化钠加入90 mL 去离子水中,充分溶解,加去离子水将溶液定容至100 mL,
高压消毒灭菌
112 kPa,30 min,保存于4℃。
B.3 琼脂平板的制备
在250 mL 容量的三角瓶中分别加入pH7.4 的 PBS100 mL、琼脂糖1
g,氯化钠8g,将三角瓶在水
浴中煮沸使琼脂糖充分融化,再加入1%硫柳汞1mL,
混匀,冷却至45℃~50℃,将洁净干热灭菌的直
径为90 mm 的平皿置于平台上,每个平皿加入18 mL~20mL
加盖待凝固后,把平皿倒置以防水分蒸
发。放普通冰箱4℃中冷藏保存备用,有效期为2周。
GB/T 18643—2021
附 录 C
(规范性附录)
PCR 检测用引物、反应条件及溶液配制
C.1 组织细胞裂解液
TE(Tris 10 mol/L,EDTA 1 mmol/L) 920 μL
十二烷基硫酸钠(10%SDS) 50 μL
氯化钠(5 mol/L NaCl) 20 μL
蛋白酶 K(PK 20 mg/mL) 10 μL
需要使用时配制。
C.2 核酸提取方法
C.2.1 取待检样本、阴性对照、阳性对照各5μL~10μL(1μg/μL)
分别置于1.5 mL 离心管中,每管加
入1000 μL 组织细胞裂解液,置于37℃水浴4 h,期间适当旋转混匀。
C.2.2 将溶液冷却至室温,加入等体积的用100 mmol/LTris-ClpH8.0
平衡过的苯酚,颠倒混匀;4℃
下,12000 g 离心10 min。
C.2.3 用宽口移液管吸出水相于新的干净的离心管中,重复步骤C.2.2。
C.2.4
用宽口移液管吸出水相于新的干净的离心管中,加入等体积的苯酚/氯仿/异戊醇(25:24:1)
倒转混匀成乳浊状,静置5 min 后,12000 g 离心10 min。
C.2.5
用宽口移液管吸出水相于新的干净的离心管中,加入等体积的异戊醇,倒转混匀,静置5
min
后,12000 g 离心10 min。
C.2.6 重复步骤 C.2.5。
C.2.7
用宽口移液管吸出水相于干净的离心管中,加入2.5倍体积的无水乙醇,倒转混匀,
-20 ℃静置
2 h,4 ℃ 12000 g/min 离心20 min 后,弃尽上清。
C.2.8 沉淀用75%的冷乙醇洗涤2次,12000 g/min 离心10 min,
尽量吸干液体;室温干燥5 min~
10 min。
C.2.9 每管加入10μLTE 缓冲液(pH 8.0)溶解DNA。 提取的DNA 即可用于PCR
扩增,也可以-70℃
冰箱储存备用。
C.3 MDV PCR 检测反应体系
MDV PCR 反应体系试剂配制见表 C.1。
表 C.1 PCR 反应体系配制表
|
|
|---|---|
|
|
|
|
|
|
GB/T 18643—2021
表 C.1 (续)
|
|
|---|---|
|
|
|
|
| 13.8 μL |
C.4 MDV
MDV
PCR 检测用引物
PCR 检测用引物见表 C.2。
表 C.2 PCR 检测用引物序列
|
|
|
|
|---|---|---|---|
|
| 786 bp或963 bp |
|
|
| ||
132 bpr上游 |
|
| 132 bpr |
132 bpr下游 |
|
C.5 MDV PCR 扩增条件
第一阶段:94℃,2 min;
第二阶段:94℃,1 min,53℃,1min,72℃,2min,30
第三阶段:72℃,10 min。
C.6 1% 琼脂糖凝胶的配制
琼脂糖 1 g
1×TAE 缓冲液 100 mL
取50×TAE 缓冲液2 mL, 加入98 mL 去离子水,配成100 mL1×TAE 入琼脂糖1
g,加热充分溶解,当温度降低至50℃左右,加入3μL~5μLEB
制胶模具内,插入齿梳,等待凝胶凝固。
缓冲液,加入三角烧瓶,加
或 EB 替代物,混匀后倒入
C.7 50×TAE 缓冲液的配制(pH 8.0)
三羟甲基氨基甲烷(Tris) 242 g
乙二胺四乙酸钠盐(Na₂EDTA ·2H₂O) 37.2 g
将上列试剂按次序溶于900 mL 去离子水中,充分溶解,加入57.1 mL
的醋酸,充分搅拌,加去离子
水将溶液定容至1 L, 室温保存。
GB/T 18643—2021
C.8 PCR 检测示例图
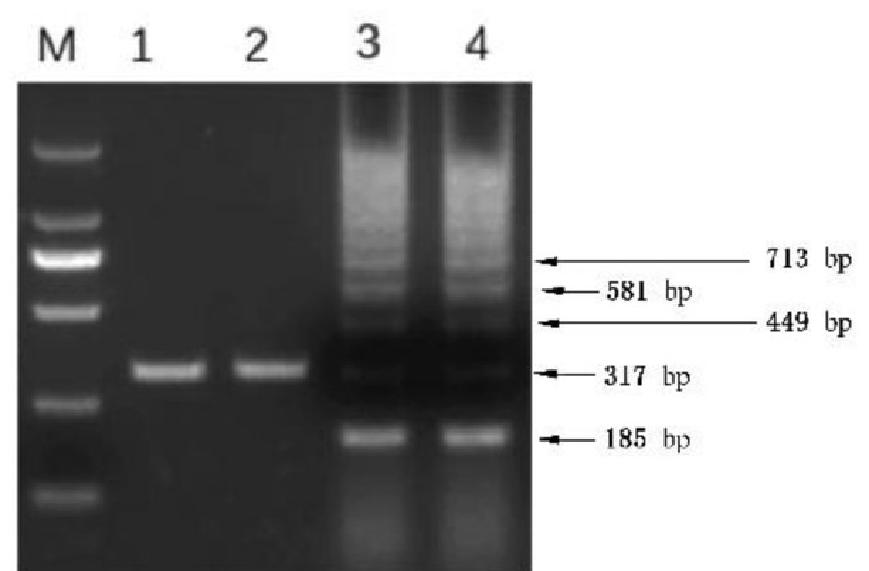
说明:
M ——DL2000Marker;
1,2— 野毒株;
3,4— 疫苗毒株。
图 C.1 132 bpr引物扩增结果示例图
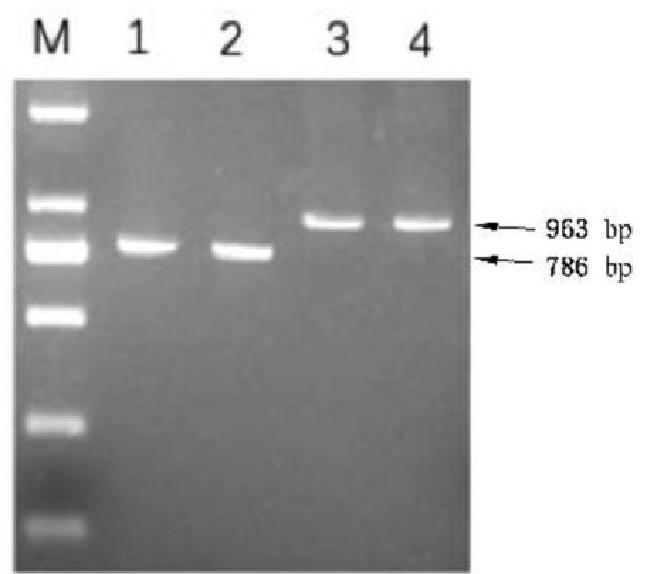
说明:
M — DL2000Marker;
1,2——野毒株;
3,4- 疫苗毒株。
图 C.2 meq 引物扩增结果示例图
GB/T 18643—2021
附 录 D
(规范性附录)
q-PCR 检测用引物、探针和反应条件
q-PCR 检测反应体系
q-PCR反应体系试剂配制见表 D.1。
表 D.1 PCR 反应体系配制表
|
|
|---|---|
|
|
|
|
|
|
|
|
| 2.5 μL |
| 0.5 μL |
| 16 μL |
D.2 MDV q-PCR 检测用引物和探针序列
MDV q-PCR 检测用引物及探针序列见表 D.2。
表 D.2 q-PCR 检测用引物和探针序列
|
|
|
|
|---|---|---|---|
|
| 69 bp |
|
|
| ||
|
|
D.3 MDV q-PCR 扩增条件
第一阶段:95℃,2 min;
第二阶段:94℃,15 s,60℃,45s, 在40个循环内动态检测荧光(FAM);
第三阶段:37℃,30 s。

延伸阅读
更多内容 可以 GB-T 18643-2021 鸡马立克氏病诊断技术. 进一步学习
联系我们
DB52-T 1002-2015 湄潭翠芽茶加工技术规程 贵州省.pdf