发表单位:中国林业科学院林木遗传育种国家重点实验室/中国林业科学研究院亚热带林业研究所
发表时间:2023年8月9日
期刊:Plant Communications(IF:10.5)
2023年8月9日,中国林业科学院林木遗传育种国家重点实验室/中国林业科学研究院亚热带林业研究所袁志林研究团队及其合作者在Plant Communications上发表了题为“Loss of the accessory chromosome converts a pathogenic tree-root fungus into a mutualistic endophyte”的研究性论文。研究揭示了真菌附属染色体(ACs)决定与共生连续体中生活方式转变相关的特定特征的机制,AC缺失诱导了与根部定殖和吲哚乙酸及黑色素生物合成相关的基因上调,且顺式调控元件发生了显著重塑,增强了共生有效性。爱基百客为该研究提供了RNA-seq、ATAC-seq测序和部分分析工作。


研究背景
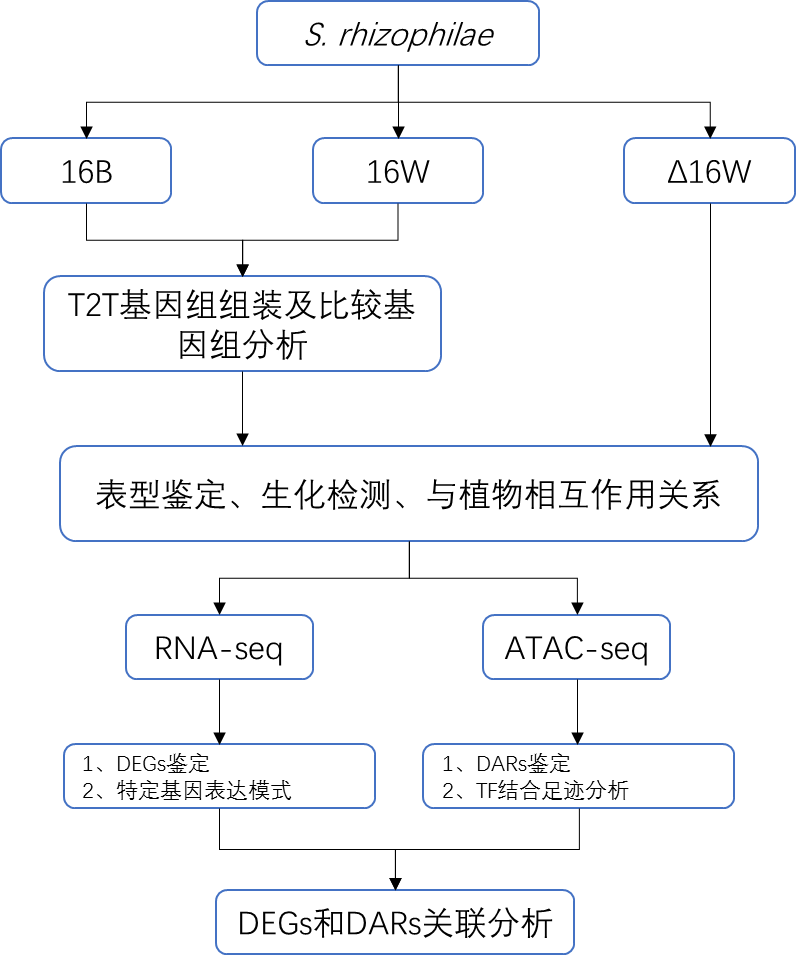
菌根真菌和内生真菌都可以显著影响宿主植物的生长和存活,根-真菌相互作用方式可以从寄生到互利共生。特定基因簇表达和拷贝数变异(CNVs)是决定部分真菌中宿主特异性和生活方式以及它们与宿主植物相互作用的遗传因素。此外,一些植物病原真菌含有作为毒力/宿主特异性决定因素的辅助染色体(ACs)。然而,在植物-真菌共生体中,ACs决定与生活方式转变相关的特定特征的机制还未见描述。课题组前期从美洲黑杨根际土壤中分离鉴定到了一种新型真菌的两个同域分离株16W和16B,表型具有明显差异,但潜在机制尚不清楚。此研究从基因组结构变异、染色质可及性和转录水平分析了16W和16B菌株之间黑化的差异及其定殖根系和促进杨树生长的能力的遗传机制。
研究材料
Stagonosporopsis rhizophilae sp. nov.同域分离菌株16W和16B,以及AC缺失的16W突变体菌株(D16W)。
技术路线
研究结果
1、S. rhizophilae的系统进化和比较基因组分析
研究首先对S. rhizophilae的两个分离株16W和16B进行了T2T基因组组装,并用BUSCO分析评估了组装完整性,16W和16B的基因组大小分别为31.8Mb和31.3Mb。此外,在16W和16B基因组中分别注释了11,488和11,381个蛋白编码基因,两者之间共享10,890个同源蛋白家族,S. rhizophilae、S. tanaceti和S. vannaccii之间共享8,081个同源蛋白家族。系统发育分析还证实16W和16B与S. tanaceti接近,估计分化时间为1670万年前(mya)。
接下来,研究对16B和16W进行了比较基因组分析,二者的18条共享染色体具有99.4%的核苷酸一致性及高度基因组共线性,而没有任何大规模的结构重排(图1A)。16W中最小的染色体(Chr19)在16B中缺失,其具有典型的ACs特征,即重复序列比例高(12.5%),GC含量低(44%),基因密度低(233个基因/Mb)和染色体特异转座子(TEs)(图1B、C)。根据基因注释的结果,Chr19上一共有136个基因,与体外培养相比,这些基因更多的在植物中特异性表达(图1D)。
此外,来自Chr19的测序reads与16B及近亲S. tanaceti和S. vannaccii的基因组序列没有任何同源区域,代表Chr19是16W特异性的。以Chr19上的4个蛋白质进行NR比对并构建系统发育树,结果显示Chr19上基因编码的蛋白质反而与链格孢属及相关类群的蛋白质高度相似,暗示Chr19是16W通过链格孢属或相关类群的水平染色体转移获得的。
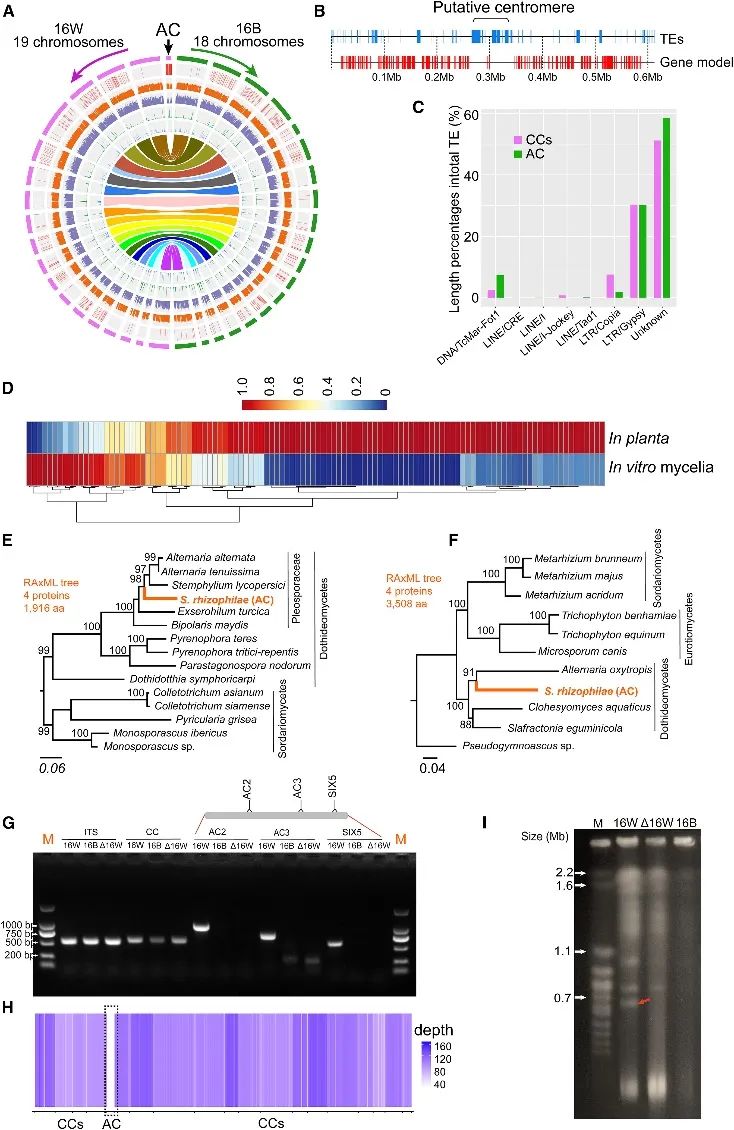
图1. S. rhizophilae分离菌的AC获得和缺失鉴定
2、AC丢失对真菌表型性状的影响
先前对子囊真菌的研究表明,ACs是不稳定的,可以在有丝分裂或减数分裂过程中丢失,而不会对真菌的基本生长产生任何不利影响。此研究利用多菌灵(一种杀真菌剂)处理16W获得了一些具有独特表型特征的菌落,经PCR检测、测序和脉冲场凝胶电泳检测(图1G-I),证实该菌落(D16W)中的AC完全缺失。
野生型(16B和16W)和突变型(D16W)在细胞大小、生长速率、菌落外观以及黑色素和吲哚-3-乙酸(IAA)产量方面存在显著差异(图2A-E)。比如,16W菌落为白色,具有薄且透明的菌丝;而16B菌落在新鲜培养基中为深绿色,在较老培养基中为黑色,具有严重黑化的菌丝;D16W菌落显示出介于16B和16W菌落之间的特征(图2A)。此外,D 16W在PDA上偶尔还不稳定,表现为嵌合的白色可育斑块和不规则或V形扇形,可能是因为染色体缺失导致了基因组结构、可及性和基因表达的失调。在生化方面,与D16W和16B相比,16W的IAA分泌量较低,而D16W的IAA分泌量明显高于16B,尤其是在存在色氨酸(Trp)的情况下(图2D);黑色素也有类似的积累模式(图2E)。
当暴露于非生物胁迫时,三个分离株表现出不同的生物行为(图2F)。大多数情况下,用化学应激物处理抑制了所有三个分离株的生长,但是16W中的生长减少显著低于16B和D16W。这表明16W比D16W和16B更能适应压力环境。
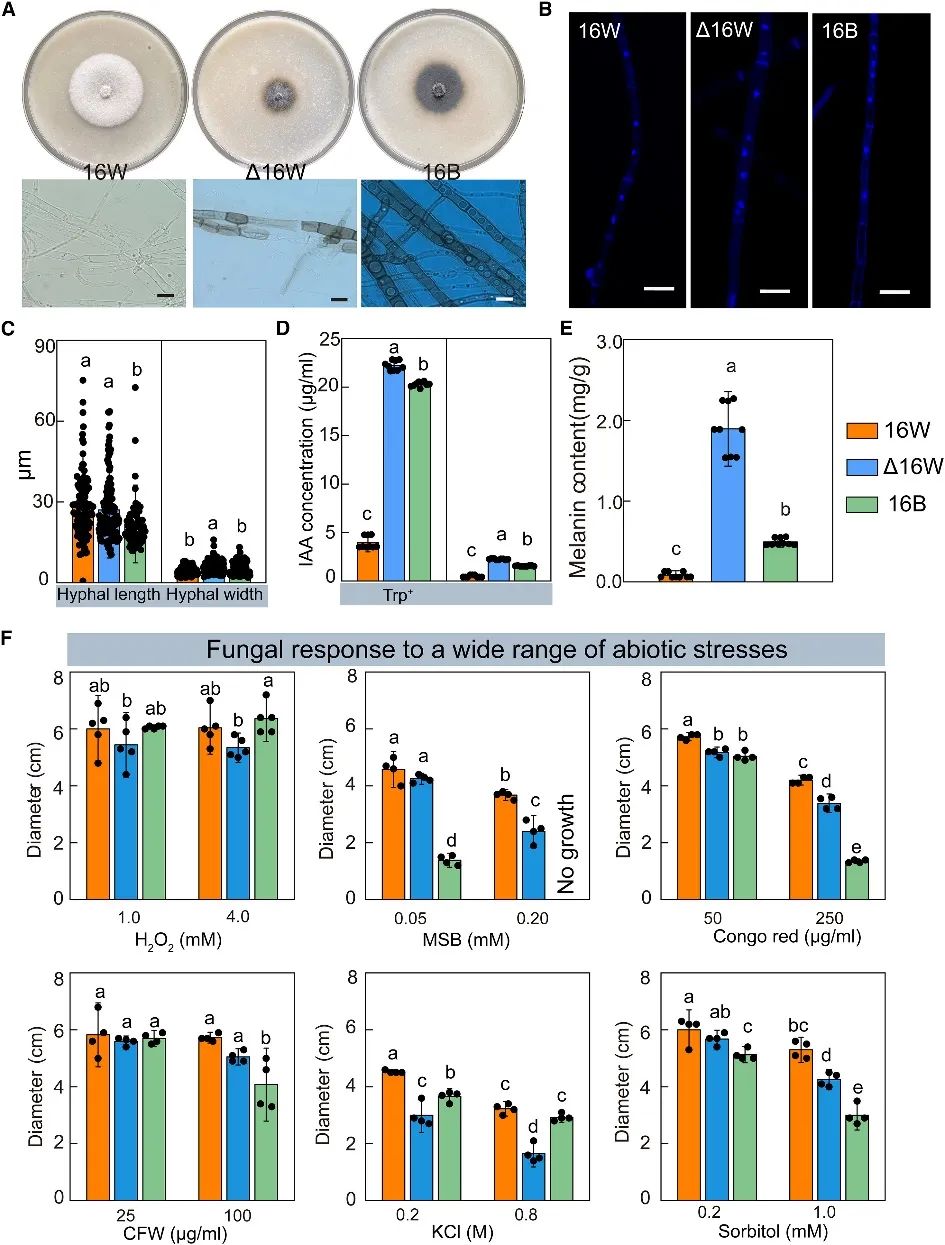
图2. AC调节S. rhizophilae分离株的表型、生理特性和对胁迫的耐受性
3、AC丢失增加了共生有效性
AC缺失还改变了杨树与S. rhizophilae相互作用的结果。在接种菌分离株后三周,与对照组相比,用16W处理的杨树植物表现出生长受阻和叶片叶绿素含量降低,但它们没有表现出任何明显的疾病症状,表明16W最有可能腐生或轻度寄生在杨树上。相比之下,与用或不用16W接种处理的那些相比,在D16W和16B定殖的杨树植物中,不定根和侧根的数量显著增加(图3A)。当研究扩展到更广泛的植物-真菌共生中时,与相应的对照相比,D16W和16B都显著促进了小麦和拟南芥的生长,而16W降低了小麦和拟南芥的健康(图3A)。这一结果表明,植物-S. rhizophilae相互作用模型在单子叶和双子叶植物谱系中很大程度上是保守的。相反,尽管16W的生长刺激作用没有超过D16W和16B,但所有三种分离株都显著促进了地钱的生长。这表明AC对非维管地钱没有负面影响。
16W在穿透杨树根部方面还存在缺陷,其菌丝只存在于根部表面,而D16W和16B的菌丝则可以沿着表皮和皮层细胞强烈渗透和增殖(图3B)。此外,接种16B和D16W的定殖根中有强烈的H2O2积累,而接种16W的定殖根在早期没有H2O2积累,且在后期的积累量低于接种16B和D16W的(图3C)。作者推测广泛的定殖和微菌核发育需要根细胞壁的重塑,因此与H2O2的产生相关。
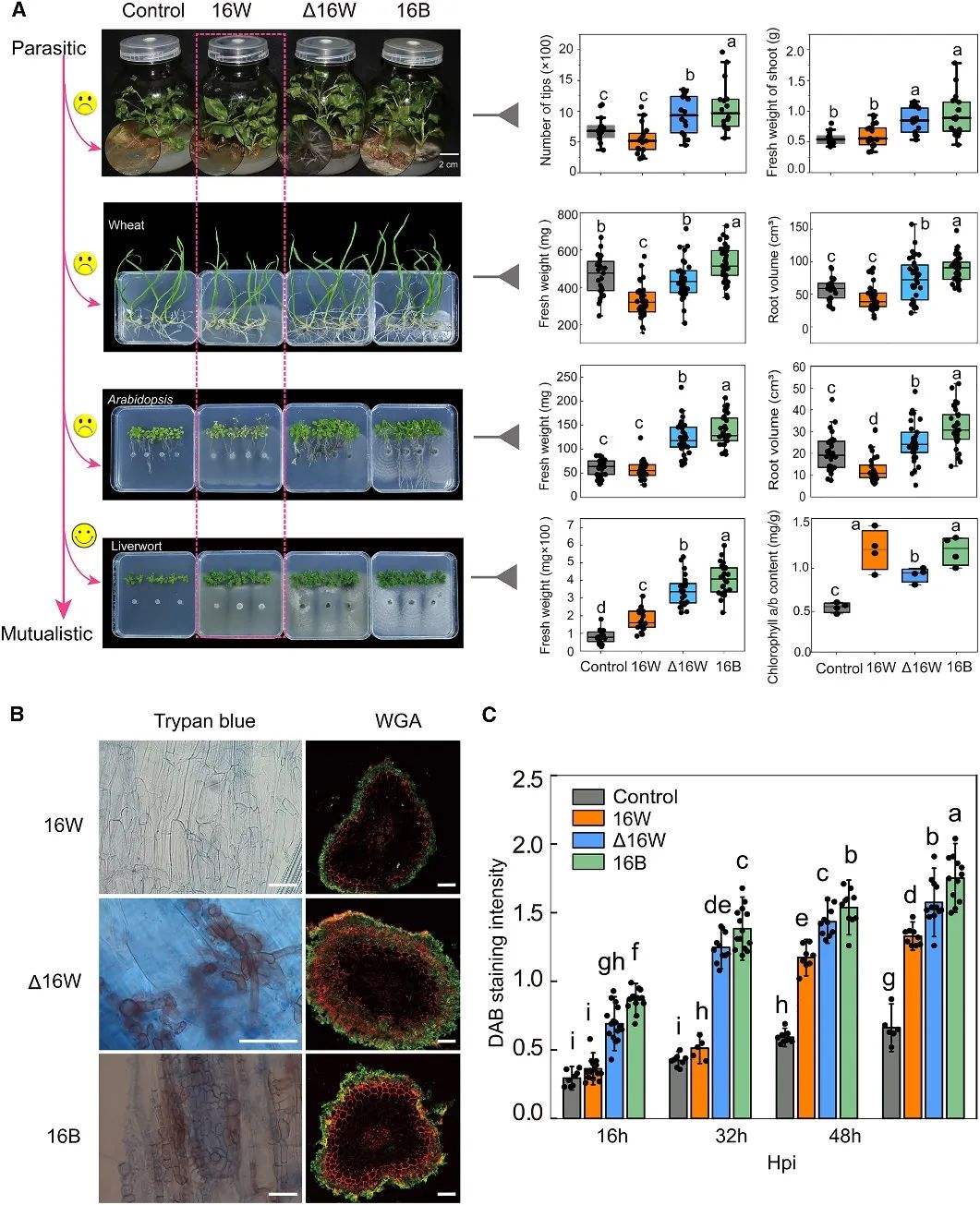
图3. S. rhizophilae与维管植物和非维管植物的相互作用结果
4、AC缺失与生活方式的转变有关并诱导全基因组转录重塑
接下来,为了解释AC缺失对真菌表型性状影响的潜在作用机制,作者对三个分离株的体外生长菌丝体进行了RNA-seq。大约五分之一的基因在三个成对比较中差异表达,反映了有和没有AC的分离株之间(16W vs. 16B)以及含AC的分离株和AC缺失的突变体之间(16W vs. D16W)的高度整体转录差异。
随后,作者重点关注了与生活方式和互惠性状相关的特定基因的表达模式,发现16B和D16W通常表现为效应子和植物细胞壁降解酶(PCWDEs)的协同和分离特异性上调,这两者对于成功的根部感染的开始和植物免疫反应的减弱都是至关重要的(图4A–4C)。
研究还分析了调节IAA和黑色素生成的基因的转录水平(图4D-F)。与16W相比,D16W中参与DHN-黑色素生物合成和Trp依赖性IAA生物合成的大多数基因的表达水平增加了3倍,这可能解释了D16W中有较高黑色素生成。此外,D16W中参与IAA生物合成的基因表达也显著增加。这些数据强调了AC缺失促进从寄生生活方式向互惠生活方式转变的机制。
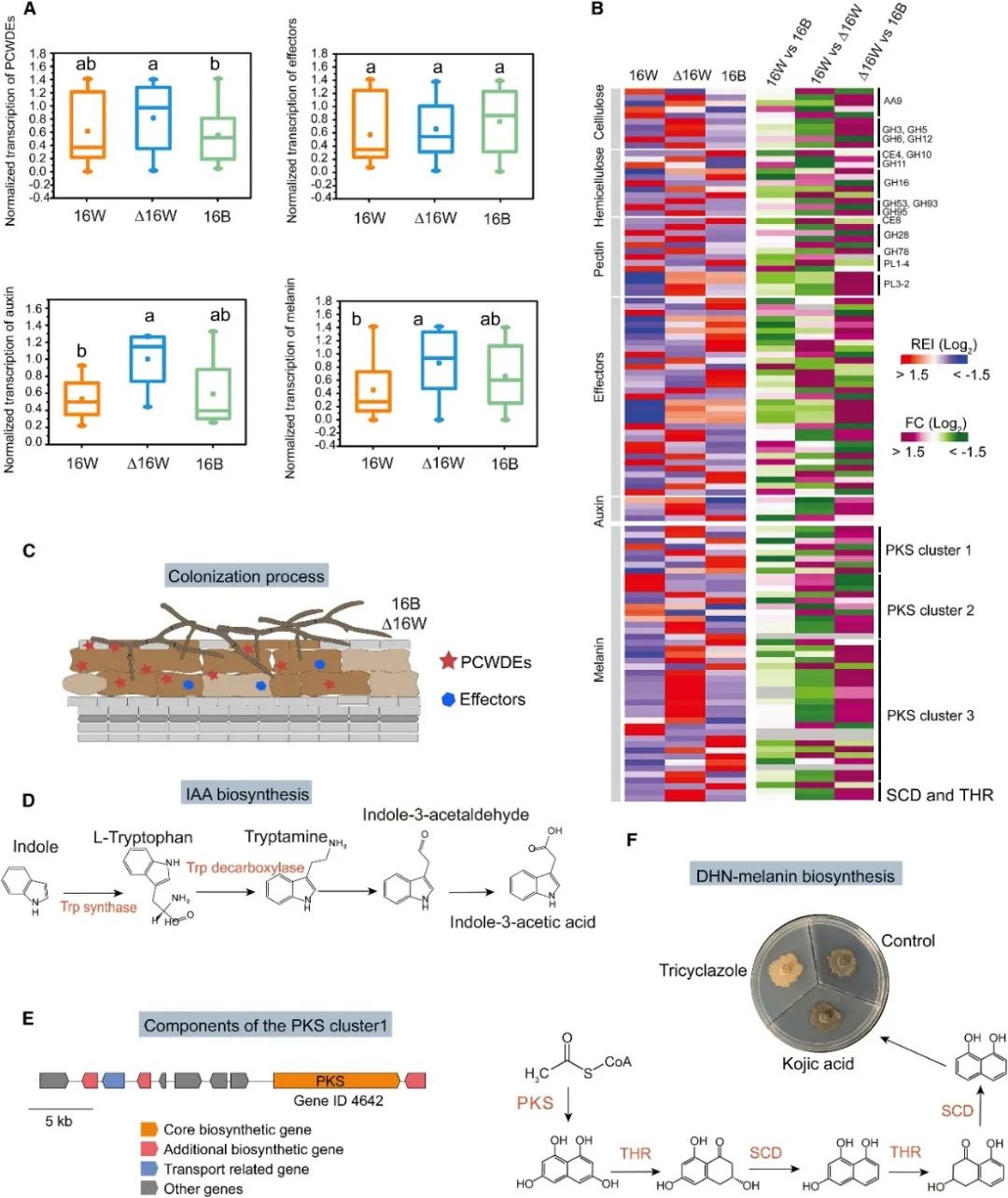
图4. AC调节与PCWDEs和效应子以及IAA和黑色素生物合成相关真菌基因的表达
5、AC调节染色质可及性的全基因组景观
染色质可及性是调节基因表达的一种表观遗传特征,作者怀疑AC缺失会改变染色质可及性景观。为此,作者利用与RNA-seq相同的样本进行了ATAC-seq。从16B和16W中分别鉴定出4041和5552个可及染色质区域。然而,在D16W中仅恢复了1578个可及染色质区域,证明AC缺失在全基因组水平上显著抑制了染色质开放(图5B)。
接下来,研究通过整合ATAC-seq数据和RNA-seq数据,研究了染色质可及性变化和基因表达改变之间的联系。在差异表达基因(DEGs)和差异可及区域(DARs)之间观察到微弱但显著的正相关,具体来说,大多数DARs与DEGs无关(图5C)。然而,几个具有表达水平增加的感兴趣基因仍经历了从开放到封闭或从封闭到开放构象的转变。例如,16B中三个最高上调的基因,肽酶(基因ID: 6182),PKS(基因ID: 4642)和效应子(基因ID: 10016),与16W相比,与染色质可及性的最大增加有关(图5D)。编码Trp脱羧酶的基因(基因ID: 7158)在D16W中有更高的表达,但与16B相比表现出更封闭的染色质状态。因此,似乎主要的DEGs不仅与染色质可及性的增加或减少有关,而且还受其他因素的影响,如特定的基因调控模块或途径。
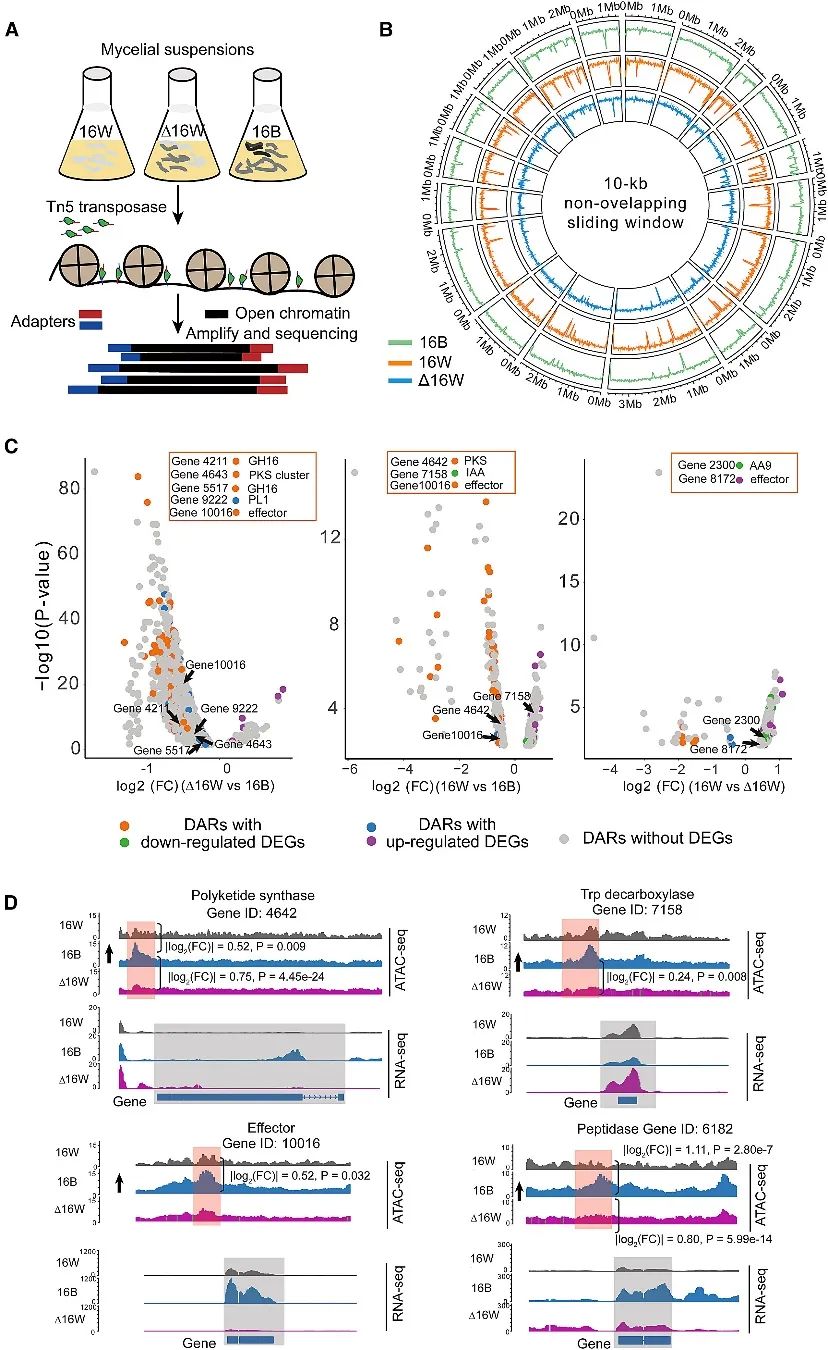
图5. AC对全基因组染色质可及性以及DARs和DEGs之间相关性的显著影响
6、AC编码的转录因子的潜在足迹鉴定
除了包含潜在的效应子和次级代谢物簇,ACs还编码转录因子(TFs),这些转录因子在基因调控中发挥重要作用。作者假设AC和核心染色体(CCs)之间的近距离串扰是由来自AC的TF调节的。因此,需要确定候选的AC常驻TFs及其在CCs中的潜在结合基序。研究在AC上发现了三个TFs:IXR1、ECM22和GAL4(图6A),并在CCs中观察到GAL4和IXR1典型的TF结合足迹(图6B)。GO富集分析显示,IXR1结合基因在信号转导和细胞通讯中富集(图6C)。
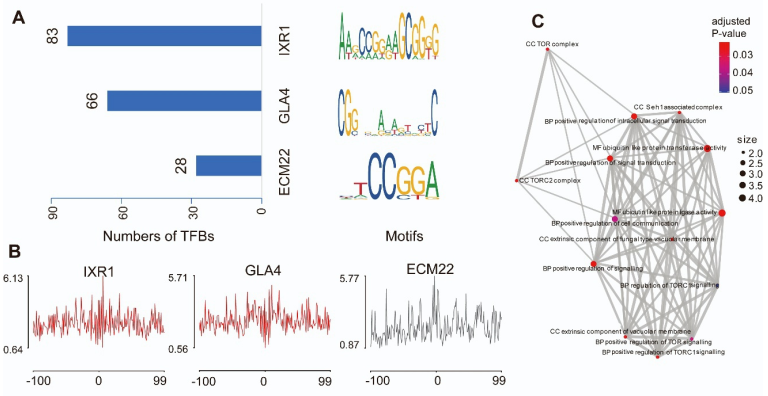
图6. AC中3个转录因子基序及TF结合足迹分析
# 总 结 #
总之,这项研究在一个树根相关的子囊菌中描述了一个新的AC。AC有助于在各种非生物胁迫下最大限度地提高真菌的适应性,并可能调节复杂的根-真菌相互作用。换句话说,AC可以将真菌的依赖宿主的生活方式定义为共生或寄生。图7显示了互惠作用中AC介导变化的工作模型。未来的研究将需要调查ACs在生态关键的非菌根根团-深色有隔内生菌(DSEs)的起源、多样性和功能中的角色。
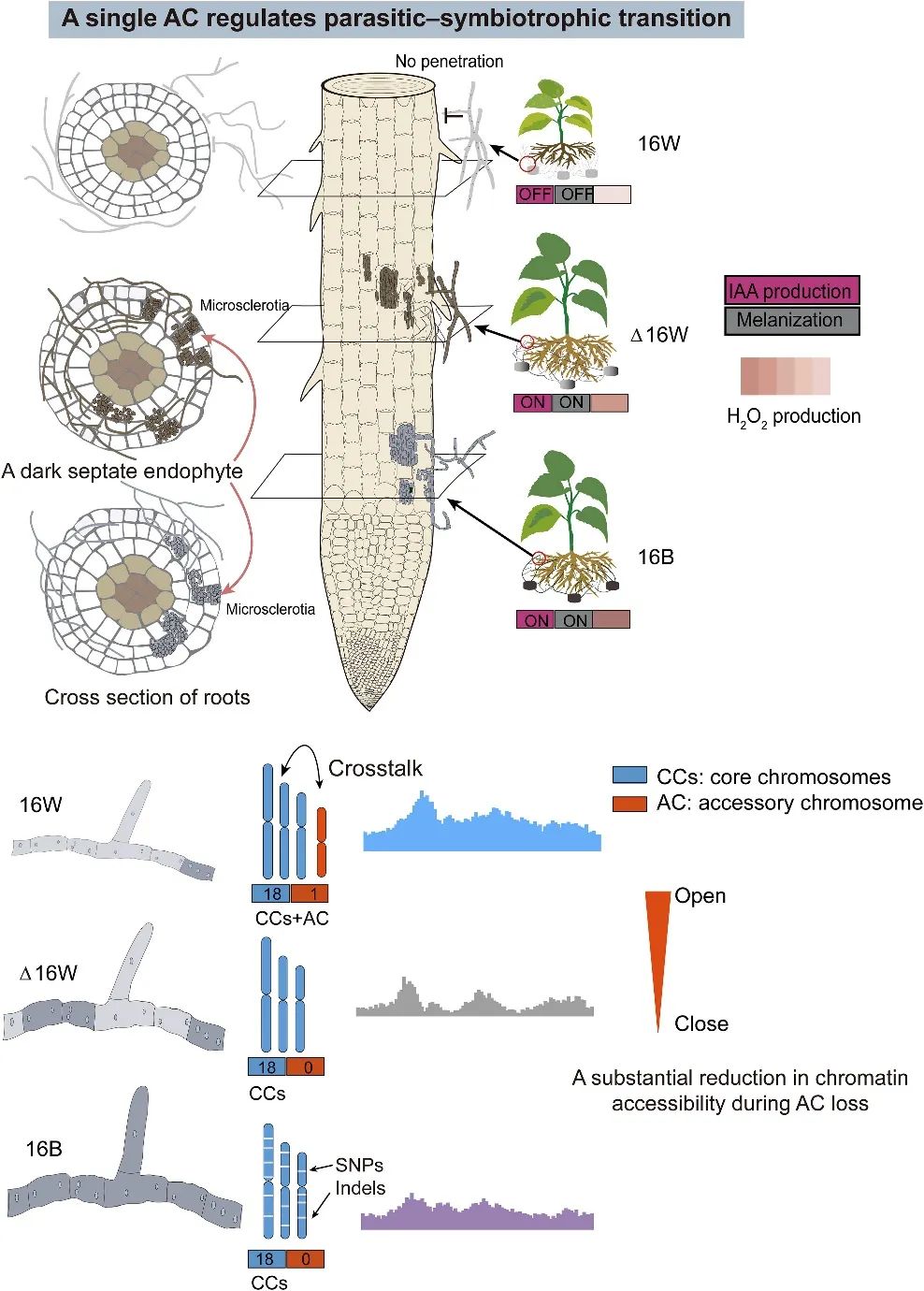
图7. AC介导的动态杨树-真菌相互作用示意图
# 关于我们 #
爱基百客专注于提供领先表观组学服务。公司先后引入ChIP、CUT&Tag、WGBS、ATAC-seq、全转录组、10x Genomics、DNBSEQ-T7等实验平台,不断提升公司的科研服务能力。至今合作的科研客户超2000家,涵盖国内知名科研院所、高校以及相关生物企业,科研成果曾多次在Cancer Cell、Nature Communications、J HEMATOL ONCOL、Plant Cell 等国际高水平学术期刊发表,受到了客户广泛好评,是国内成长最迅速的高通量测序科研服务企业之一。