日本橙皮书是一份关于医疗用医药品质量情报的汇总报告,由日本厚生劳动省发布。它主要涵盖了药品的品质再评价信息,特别是针对特定历史阶段的产品,笔者总结信息如下:
①日本橙皮书数据库包含了一系列药品的详细信息,如药效组栏、有效成分栏、剂型栏、特性栏、含量栏等。这些信息有助于医生和药剂师做出更准确的处方决策。
②日本橙皮书数据库还按照药品的评价阶段进行分类,包括确定再评价阶段、开始预试验阶段、指令开展再评价阶段、溶出试验方案的公示阶段以及确定溶出试验方案阶段。
③日本橙皮书数据库还记录了药品的溶出试验所用参比制剂的信息,包括原研药和仿制药。参比制剂的选择对于仿制药的生物等效性和品质评估至关重要。
日本橙皮书数据库可以通过药融云平台免费查询

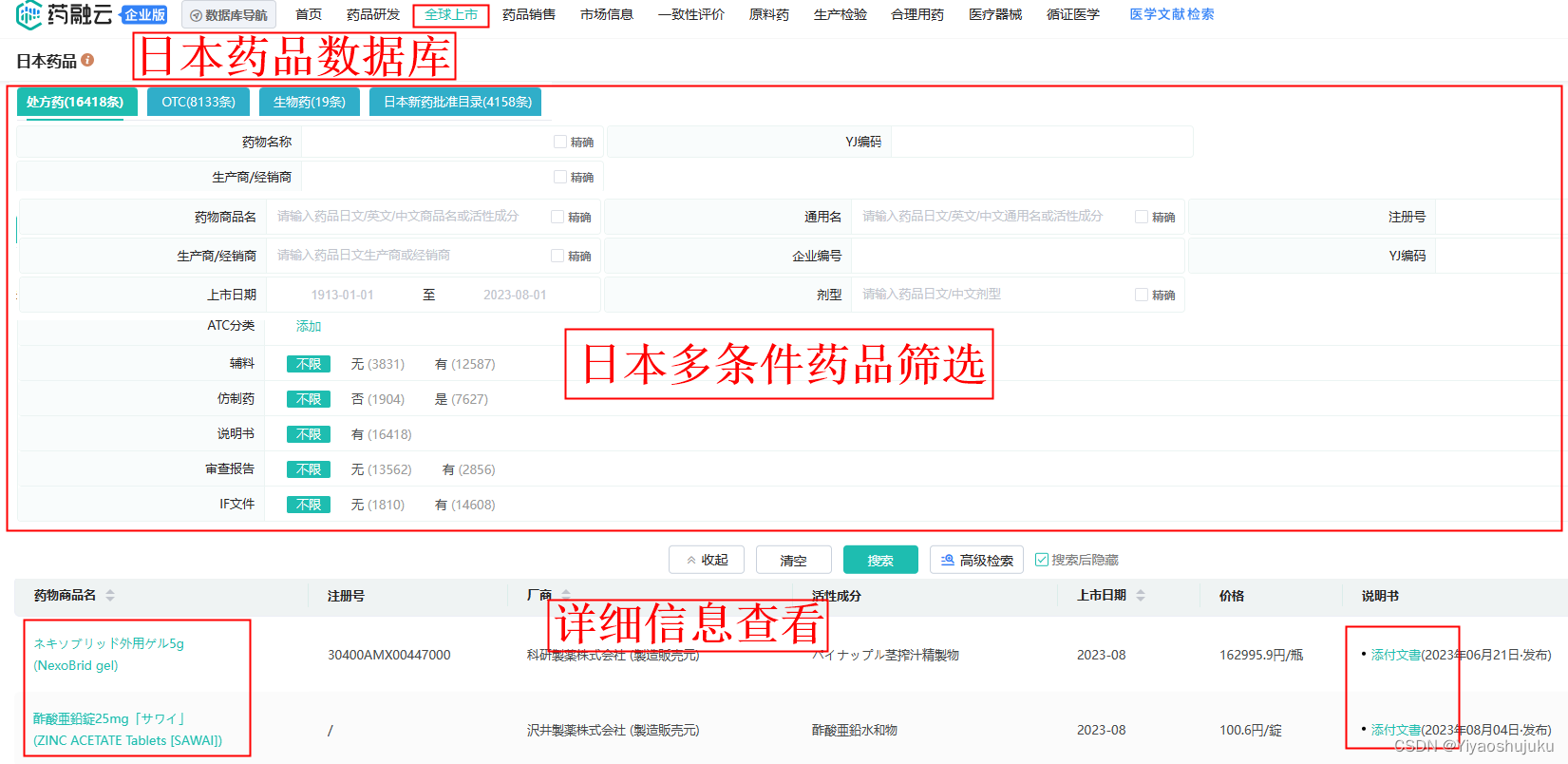
日本橙皮书收录的均为固体口服制剂信息,主要包含药物的原料理化性质、处方工艺、溶出方法、BE等信息。所以在日本橙皮书数据库中,我们只能查询到固体口服制剂的药物信息,其他制剂如注射剂是无法在日本橙皮书数据库中查询到药物信息的,可以通过如下’日本药品数据库’中查阅
日本橙皮书收载的详细内容
以下内容为《医疗用医药品质量情报集》2011版。
日本橙皮书主要的收载事项为12类,如下:
(1)药效组栏:记载再评价对象的药品所属药效群分类的编号。
(2)有效成分栏:记载药品有效成分名称,属于复方制剂的记载各复方的有效成分名称。
(3)剂型栏:按照片剂、胶囊、颗粒剂等剂型进行记载。
(4)特性栏:按照普通(普通制剂)、肠溶(肠溶制剂)、缓释(缓释制剂)、口腔(口腔内崩解制剂)等进行记载。
(5)含量栏:按照每粒含量或每1g含量进行记载。
(6)评价阶段栏:标示该药品所属的评价阶段。评价阶段分为5个:确定该药品开展再评价阶段;开始预试验阶段;指令开展再评价阶段;溶出试验方案的公示阶段;确定溶出试验方案阶段。
(7)标准栏:记载溶出试验所用参比制剂,有“*”或“+”或空白的情形。“*”代表参比制剂为开展了临床试验研究的原研药;“+”的情形代表参比制剂为已与原研药生物等效且设定了合理的溶出试验的不同剂型或不同规格的仿制药。空白的情形为在品质再评价结束后,出现参比制剂停止生产等情况。如果参比制剂是多家同时独自开发的原研制剂时,以“*”表示参比制剂之后再以a、b……等表示。
(8)商品名栏。
(9)制造销售者栏。
(10)规格栏。
(11)药价栏。
(12)No.栏:例如标记为“1”,表示在“医疗用医药品品质情报集No.1”内收录。