茉莉酸类化合物(JAs)是植物中普遍存在的一类植物激素,在非生物胁迫响应中发挥重要作用。12-氧-植物二烯酸(OPDA)可通过α-亚麻酸(ALA)代谢途径合成JA,是一种重要的JA前体分子。APETARA2/乙烯响应因子(AP2/ERF)转录因子是植物中最大的转录因子家族之一,对于调控植物发育、病原体防御和胁迫响应至关重要。一些ERF家族成员能够响应植物激素和非生物胁迫信号,然而,关于单子叶植物(如:玉米、水稻)JA合成与功能的研究较少。
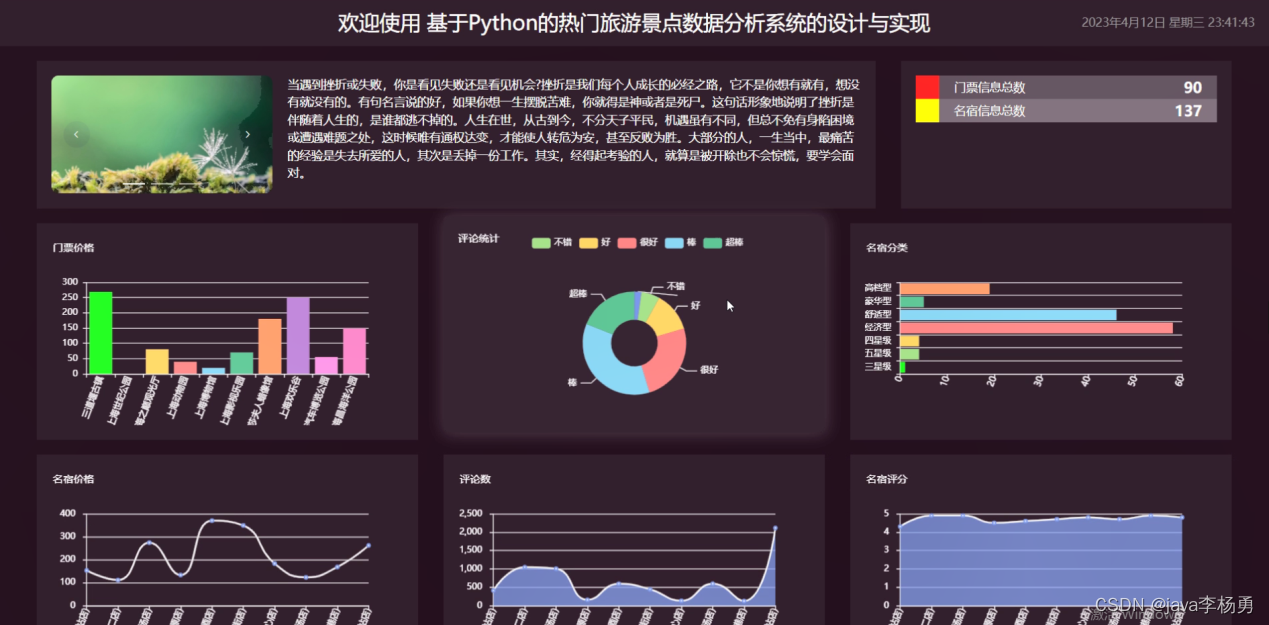
2023年6月16日,济南大学生物科技与技术学院李慧教授团队的研究成果,发表在植物学领域的TOP期刊Plant, Cell & Environment,文章题目为“ZmEREB57 regulates OPDA synthesis and enhances salt stress tolerance through two distinct signalling pathways in Zea mays”。该期刊的影响因子为7.947。该研究使用DNA亲和纯化测序(DAP-seq)技术鉴定了玉米中一个AP2/ERF转录因子的结合基序以及靶基因。揭示了ZmEREB57通过两个不同的信号途径调控玉米OPDA合成增强耐盐性的分子机制,为耐盐性植物新品种的培育提供了重要的遗传资源。

本研究通过转录组分析筛选了与盐胁迫相关的差异表达基因(DEGs)。其中,Zm00001eb193060在盐胁迫条件下显著上调表达,该基因编码乙烯响应元件结合因子57 (ZmEREB57),是一个AP2/ERF转录因子家族成员,定位于细胞核,并具有转录激活活性。定量PCR实验表明,ZmEREB57可被多种类型的非生物胁迫诱导表达。
为进一步鉴定ZmEREB57的生物学功能,构建了ZmEREB57的过表达株系(OE1和OE2)和突变体株系(zmereb57-1和 zmereb57-2)。与野生型(WT)相比,2个zmereb57株系对盐胁迫更加敏感,表现为明显的叶片枯萎和褪绿,叶片含水量和叶绿素含量显著下降;而2个OE株系表现出更好的耐盐性。这表明ZmEREB57参与了玉米的盐胁迫响应。此外,过表达拟南芥株系 (At-OE1、At-OE2、At-OE3)和突变体株系(atora47,ZmEREB57在拟南芥中的同源基因)的实验结果与在玉米中类似,而且回补实验还表明过表达ZmEREB57可以部分恢复atora47突变体的表型。以上结果表明,过表达ZmEREB57增强了玉米和拟南芥对盐胁迫的耐受性。

WT、zmereb57和ZmEREB57-OE株系的耐盐表型
通过DAP-seq分析,鉴定了ZmEREB57的特异性核心结合序列CCGNCC (属于O-box样基序)和606个潜在的靶基因。其中,丙二烯氧化物环化酶2(ZmAOC2)显示出强烈的富集峰。酵母单杂交(Y1H)、荧光素酶报告实验、凝胶阻滞实验(EMSA)进一步验证了ZmEREB57直接与ZmAOC2的启动子结合。在盐处理条件下,ZmEREB57的过表达促进了ZmAOC2的表达。
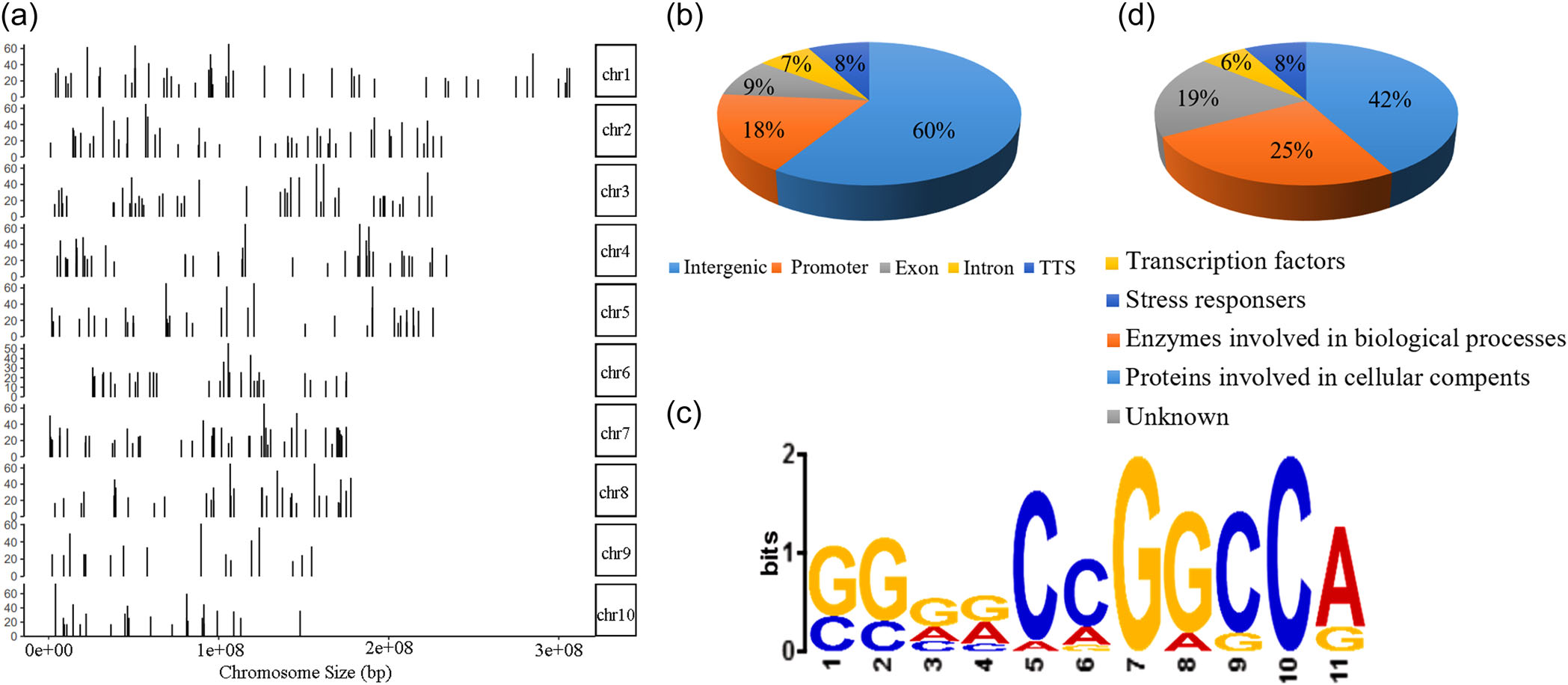
DAP-seq技术鉴定ZmEREB57的结合基序和靶基因

ZmEREB57直接与ZmAOC2的启动子结合并激活其表达
AOC定位于叶绿体,可催化13-过氧化氢亚麻酸形成OPDA,而后在过氧化物酶体中将其转化为JA。zmaoc2突变体实验表明,在对照处理组中zmaoc2株系的OPDA和JA含量均低于WT株系(B73),在盐处理后zmaoc2株系与WT株系之间的OPDA和JA含量差异更大。这说明ZmAOC2参与了玉米OPDA和JA的合成。而且在盐处理条件下,ZmEREB57-OE株系的OPDA和JA含量增加最多,其次是WT,最后是zmereb57株系。这表明ZmEREB57通过调控ZmAOC2的表达来影响内源性OPDA和JA的积累。外源OPDA处理后,WT和zmereb57植株中OPDA和JA水平均有显著升高;外源JA处理后,植株中OPDA水平仅略有升高,JA水平显著升高。此外,还发现外源OPDA或JA的应用可以通过增加内源OPDA和JA水平来帮助恢复zmereb57突变体的耐盐表型。
为进一步探讨OPDA/JA通路调控的基因在玉米盐胁迫下的表达模式,对盐胁迫处理以及OPDA或JA处理的WT植株进行了RNA-seq分析。分别筛选不同处理条件下的DEGs,并进行KEGG和GO富集分析,发现主要富集在与胁迫相关的各种生物途径中。随后,还对若干与盐胁迫相关的DEGs开展了RT-PCR验证。结果表明OPDA或JA处理引发的玉米转录组变化,参与了植物对盐胁迫的响应。
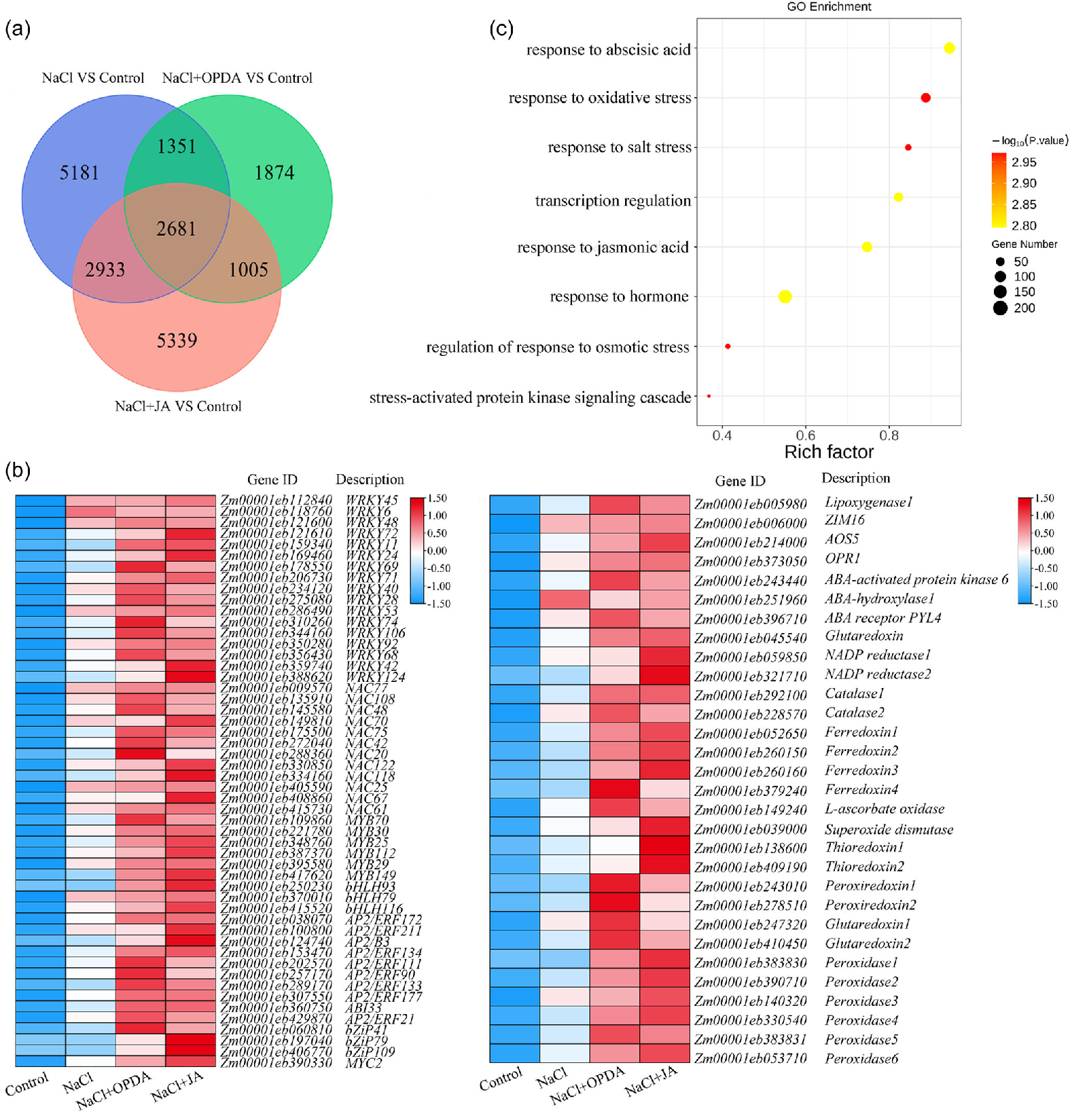
玉米对盐和植物激素处理的整体转录组分析
值得注意的是,OPDA或JA处理后,玉米中的基因表达模式存在显著差异。1351个基因(O&NRGs)对OPDA和NaCl有特异性反应,但对JA没有反应;2933个基因(J&NRGs)对JA和NaCl有特异性反应,但对OPDA没有反应。对O&NRGs和J&NRGs展开进一步的KEGG分析,主要富集到植物激素信号转导和MAPK信号通路等与非生物胁迫响应有关的途径中。因此,推测OPDA具有独立的盐胁迫响应机制。于是采用2个玉米JA合成突变体:zmaoc2(不能合成OPDA和JA)和zmopr3(JA生物合成缺陷)来验证这一假设。zmaoc2和zmopr3株系均表现出更强烈的盐胁迫敏感性。在盐处理下添加外源OPDA时,zmaoc2和zmopr3的表型与WT相似。在盐处理下添加外源JA时,仅zmopr3的表型与WT相似,而zmaoc2比zmopr3和WT对盐胁迫更加敏感。
后续,选择3个O&NRGs基因(ZAT10、ERF9、DREB1)和1个 J&NRGs 基因(VSP9a)进行分析,探究盐胁迫下OPDA的响应机制。在对照条件下,4个基因在WT、zmaoc2 和zmopr3中的表达没有明显差别;在盐处理条件下,4个基因在zmaoc2中表达水平显著低于WT中;在盐胁迫下添加OPDA时,增强了WT、zmaoc2 和zmopr3中ZAT10、ERF9和DREB1的表达;在盐胁迫下添加OPDA和JA时,WT和zmaoc2中VSP9a明显上调表达,而添加OPDA时仅仅是轻微的诱导表达。这说明OPDA可以通过一种不依赖于JAs的机制,作为玉米盐胁迫响应的信号中介。
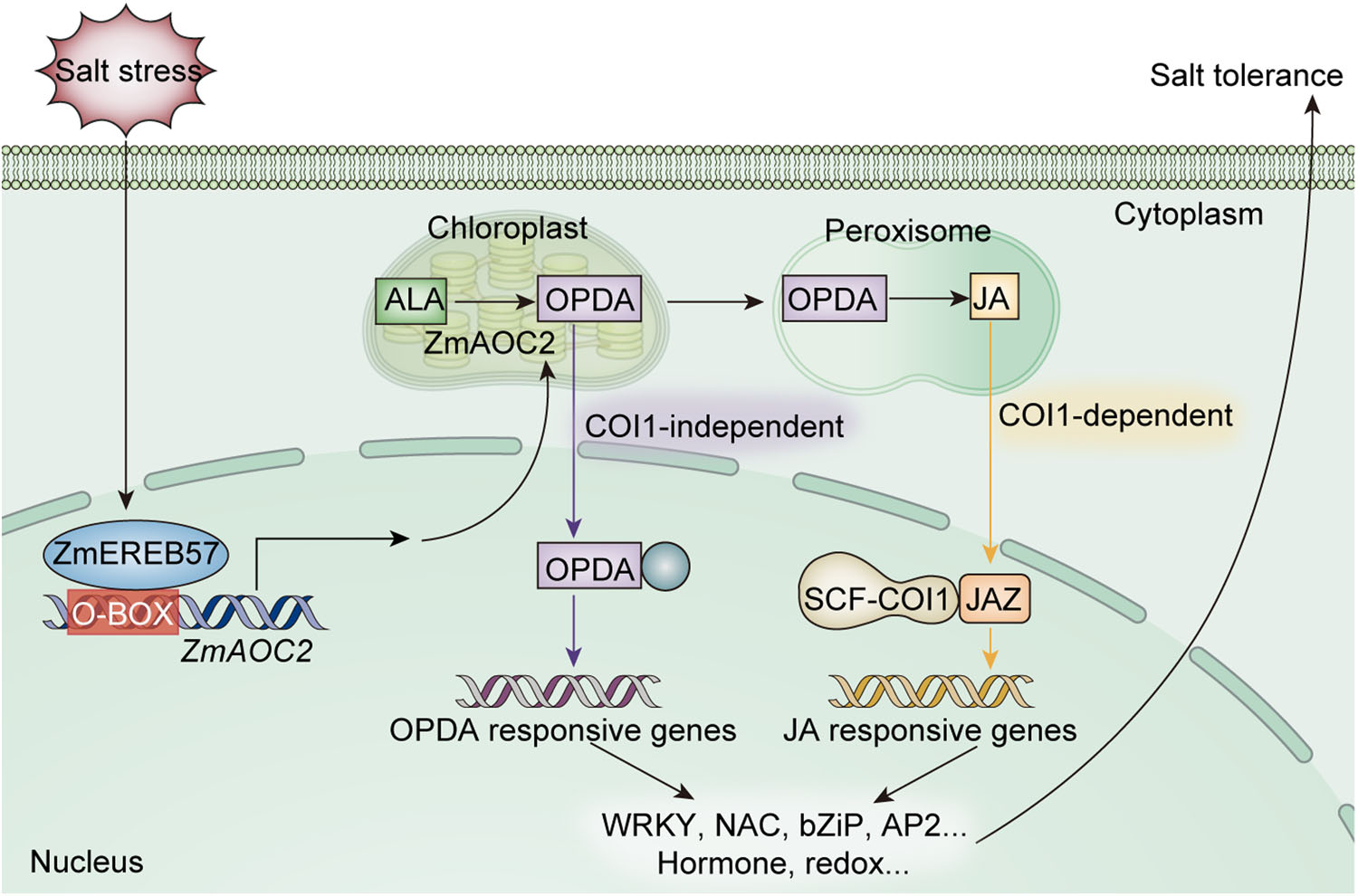
ZmEREB57在盐胁迫响应中的调控机制模型
小结:本研究揭示了ZmEREB57正向调节玉米耐盐性的分子机制。盐胁迫诱导了ZmEREB57的表达,ZmEREB57通过与ZmAOC2启动子中的O-box样元件结合,激活其表达。进而通过两个独立的信号途径调控OPDA和JA的生物合成(OPDA可以直接通过不依赖COI-1的途径,或者间接地通过依赖JA-COI1的途径调控胁迫相关基因的表达),增强玉米对盐胁迫的耐受性。该研究为玉米、拟南芥和其他植物的耐盐性新品种培育提供了重要的遗传资源。
参考文献:Zhu J, Wei X, Yin C, Zhou H, Yan J, He W, Yan J, Li H. ZmEREB57 regulates OPDA synthesis and enhances salt stress tolerance through two distinct signalling pathways in Zea mays. Plant Cell Environ. 2023 Jun 16. doi: 10.1111/pce.14644.
DAP-seq高通量地检测转录因子在基因组上的结合位点,鉴定下游靶基因。蓝景科信拥有100+物种,1000+转录因子的DAP-seq实验经验。

![[MySQL]1292 - Incorrect date value: ‘0000-00-00‘ for column ‘xxx‘ at row 1](https://img-blog.csdnimg.cn/10bdbdf7c77e45348efa65b4e0b79d0d.png)