文章标题:Mapping the early life gut microbiome in neonates with critical congenital heart disease: multiomics insights and implications for host metabolic and immunological health
发表期刊:Microbiome
影响因子:16.837
作者单位:中国医学科学院阜外医院和上海交通大学附属上海儿童医学中心
百趣提供服务:非靶向代谢组学,短链脂肪酸

代谢组学分享-综合机制概念图
生命早期定植的肠道微生物群对宿主整个生命过程中的代谢和免疫稳态影响深远。严重先天性心脏病(critical congenital heart disease, CCHD)的新生儿存在营养不良和免疫失衡的重大风险,但这与肠道微生物的关联仍不清楚。本研究对45名患有重症先天性心脏病(CCHD)新生儿和50名健康对照(Healthy control group, HC)的粪便样本进行深度宏基因组测序和代谢组学分析,发现CCHD新生儿肠道菌群失调,表现为双歧杆菌耗竭、肠球菌过度生长,并与代谢紊乱高度相关;双歧杆菌和肠球菌的遗传变异导致CCHD代谢紊乱;以长尾噬菌体为代表的温和噬菌体病毒组通过改变菌群的适应性塑造肠道细菌组成;肠球菌的过度生长通过代谢物介导CCHD的肠道屏障损伤和炎症反应,并与全身炎症和手术预后不良相关。研究表明重建最佳的肠道菌群对维持CCHD患儿的代谢和免疫平衡或有重要意义。
研究结果
1代谢组学分享-基线特征
本研究纳入了45例诊断为CCHD的足月新生儿和50例按年龄和性别相匹配的健康对照组,在出生体重、分娩方式和母乳喂养状态等方面均无明显差异。
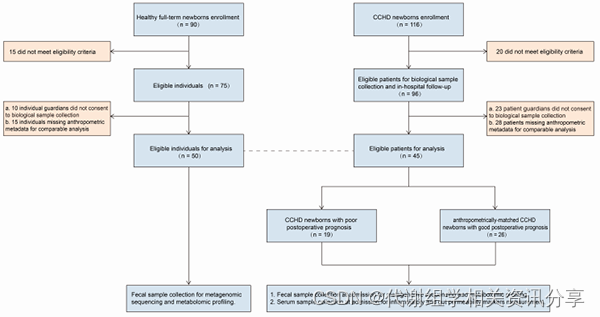
图1. 研究队列登记的流程图
表1. 研究队列特征统计

2代谢组学分享-肠道细菌的差异
作者对两组的肠道细菌组成和多样性进行了分析(宏基因组),发现与HC相比CCHD组的α-多样性显著增加xq(图2A)。主坐标分析(PCoA)也表明两组之间存在明显的分离。肠型分析发现了基于肠球菌属(肠型1)和双歧杆菌属(肠型2)的两个集群(图2C-E)。HC组以双歧杆菌为主,而CCHD组以肠球菌为主。


图2. CCHD患者和HC的肠道细菌特征
3代谢组学分享-温和噬菌体与CCHD早期生命细菌扰动有关
肠道病毒的α-多样性与科水平的PCoA也显示了两组间有明显的差异。其中,长尾噬菌体被认为具有介导细菌之间的基因转移并与宿主共同进化的能力。作者从CCHD组中提取了肠球菌衍生的噬菌体序列,并使用Pfam数据库注释了基因功能。56%的注释阅读框被归类为转座酶、噬菌体整合酶和与转录调控和分解代谢相关的酶基因(包括转录调控因子、甲基化酶、水解酶、肽酶和糖苷酶;图3E),表明温和噬菌体可以广泛影响其细菌宿主的遗传组成和代谢特征。相关性网络(图3J)展示了粪肠球菌与噬菌体之间存在正相关关系。

图3. 细菌-噬菌体关联分析
4代谢组学分享-肠道微生物组与粪便代谢组之间的系统相互作用
非靶向代谢组学共鉴定了748种代谢物。与HC组相比,CCHD组有36种代谢物的上调和84种代谢物下调,主要涉及硫胺素代谢,亚油酸(LA)代谢,不饱和脂肪酸的生物合成,半乳糖代谢、苯丙氨酸代谢、酪氨酸代谢、花生四烯酸代谢和胆汁酸生物合成(图4)。Spearman相关性网络图表明双歧杆菌属与氨基酸和碳水化合物代谢的粪便代谢物正相关(图5)。

图4. 肠道微生物特征以及与粪便代谢物的关联

图5. 肠道细菌与粪便代谢物的共现网络图
5代谢组学分享-微生物丰度、功能、基因组结构变化与宿主代谢综合网络分析
该分析发现与双歧杆菌和肠球菌关联的“互斥”特征(图6C)。大多数肠球菌与花生四烯酸代谢物水平呈正相关,而肠球菌与多不饱和脂肪酸(polyunsaturated fatty acid, PUFA)水平同时存在负相关。所有这些代谢物都是参与炎症级联的活性化合物,而ω-3和ω-6 PUFAs能够减轻炎症和氧化应激。另外,大多数双歧杆菌种类的丰度与芳香族乳酸呈正相关(图6C)。综上所述,这些结果表明新生儿CCHD肠道微生物组成异常(肠球菌增多和双歧杆菌减少,微生物功能和基因组成的改变),显著影响早期生命的免疫发育和代谢。

图6. CCHD患者中失调的肠道微生物群与肠道屏障损伤和全身炎症相关
6代谢组学分享-肠球菌的过度生长与炎症反应和预后不良有关
作者检测了HC组与手术预后良好和较差的患者(分别称为CCHD-G和CCHD-P)亚组之间的肠道微生物组成。在CCHD-P和CCHD-G之间共鉴定出19种鉴别细菌,其中14种富集于CCHD-P中,主要属于肠球菌属(图4B),推测肠球菌的过度生长是驱动CCHD-P和CCHD-G分离的一个关键微生物。炎症指标表明预后不良的新生儿在手术前已存在炎症和肠道屏障损伤。肠球菌丰度与血清中多种促炎细胞因子和肠道通透性的生物标志物水平之间存在很强的正相关性(图6F),ROC分析表明(图7)粪肠球菌丰度可以是一个独立的预测新生儿手术预后的CCHD。

图7. ROC曲线显示了研究队列中预后分层预测模型的鉴别准确性
7代谢组学分享-微生物与代谢物关联将肠球菌与免疫-炎症失衡联系起来
两个亚组之间的总体代谢特征具有显著差异,在CCHD-P组中,与氨基酸、维生素和不饱和脂肪酸相关的代谢通路均被抑制。细菌和代谢物之间的相互作用很大程度上归因于负相关关系中CCHD-P组富集的肠球菌物种和代谢物参与脂质和维生素代谢。综合结果表明,肠球菌的过度生长和遗传变异与益生菌相关代谢物的消耗,特别是芳香乳酸、LA衍生物和维生素B的消耗高度相关(图9),这提示了一种积极的炎症反应。

图8. CCHD-P和CCHD-G中鉴定的不同细菌种类与粪便代谢物的共现网络图
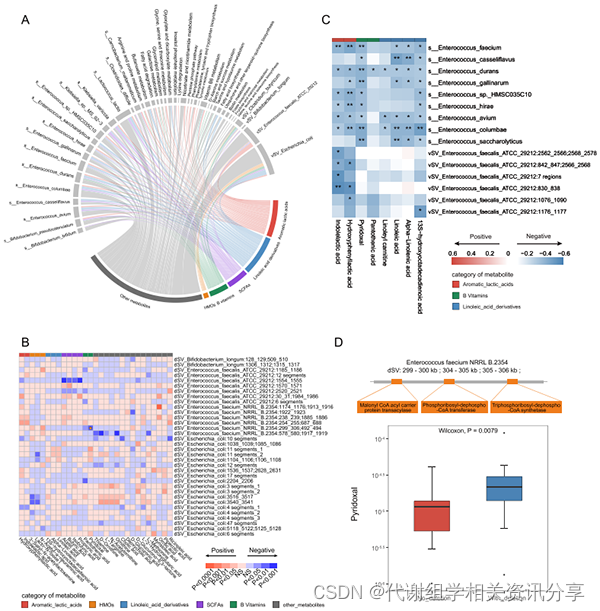
图9. 亚组之间(CCHD-P与CCHD-G)的肠道微生物特征与粪便代谢物的综合关联
8代谢组学分享-微生物群通过代谢物促进宿主的炎症反应和肠道屏障的损伤
作者进一步评估了代谢物是否能介导微生物对CCHD新生儿炎症反应和肠道屏障损伤。结果表明粪肠球菌可能通过降低LA衍生物(粪便13-HODE和α-二甲基酚酸,图10C)损伤肠道屏障。此外,微生物脂肪酸降解途径也可能通过消耗粪便中花生四烯酸水平来降低肠道通透性。

图10. 肠道微生物组、代谢物与肠道通透性和炎症的血清生物标志物之间的调控关系
代谢组学分享-总结
重症先天性心脏病新生儿存在肠道微生态紊乱失调与代谢紊乱,并通过诱导宿主代谢稳态失衡,促进了患儿免疫炎症失衡与肠屏障功能损伤,进而影响患儿临床结局。研究结果提示:未来可通过制定靶向重症先天性心脏病新生儿肠道菌群的个性化干预策略,如补充特定益生菌等来恢复重症先天性心脏病患儿的代谢与免疫稳态,进而改善患儿临床结局。