
-
发表期刊:Frontiers in plant science
-
发表日期:2024年9月26日
-
影响因子:4.1
-
发表单位:湖北科技学院
研究背景
“玉露沾衣冷,金风拂面凉。桂花香满袖,秋色入诗囊。”桂花,中国十大名花之一,具有独特的香气,被广泛应用于食品添加剂或护肤品中。然而,桂花花期短,最佳采收时间为2-3天,极大地限制了其观赏价值和经济价值。桂花是乙烯敏感花,花的衰老由乙烯应答转录因子(OfERFs)介导。此外,DNA低甲基化也被证明通过乙烯应答途径参与了OfERFs介导的花衰老过程。然而,尚缺乏对桂花OfAP2/ERFs的全基因组见解,其对花衰老的具体调控网络也不清楚。湖北科技学院国家林业草原桂花工程技术研究中心陈洪国教授领衔的桂花研究团队在Friontiers in plant science上发表论文,系统鉴定了‘柳叶金桂’全基因组中的OfAP2/ERF基因,同时利用比较转录组揭示了5’Aza和ETH处理下的OfAP2/ERFs变化及它们可能影响的下游基因和途径,最终发现一个OfERF017通过介导有机酸代谢调控桂花的花衰老。武汉爱基百客生物(Igenebook)作为合作单位,深度参与了此研究工作。
研究路线
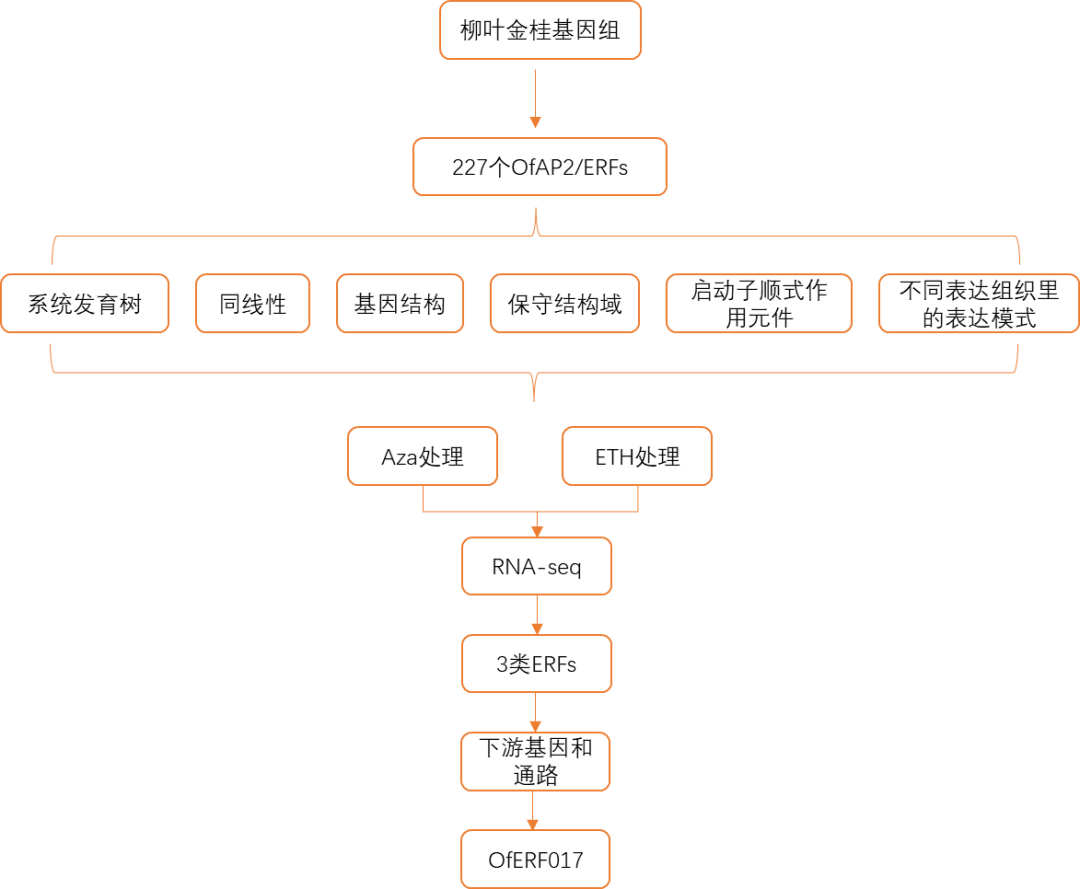
研究结果
01、鉴定桂花中的OfAP2/ERFs
此研究利用基因注释和AP2结构域(PF00847)扫描,从‘柳叶金桂’基因组中鉴定了227个OfAP2/ERF基因。其中,212个成员成功锚定在23条染色体上。从它们的分布来看,部分OfERF基因位置相近(图1),暗示该基因家族中可能发生过串联重复事件。
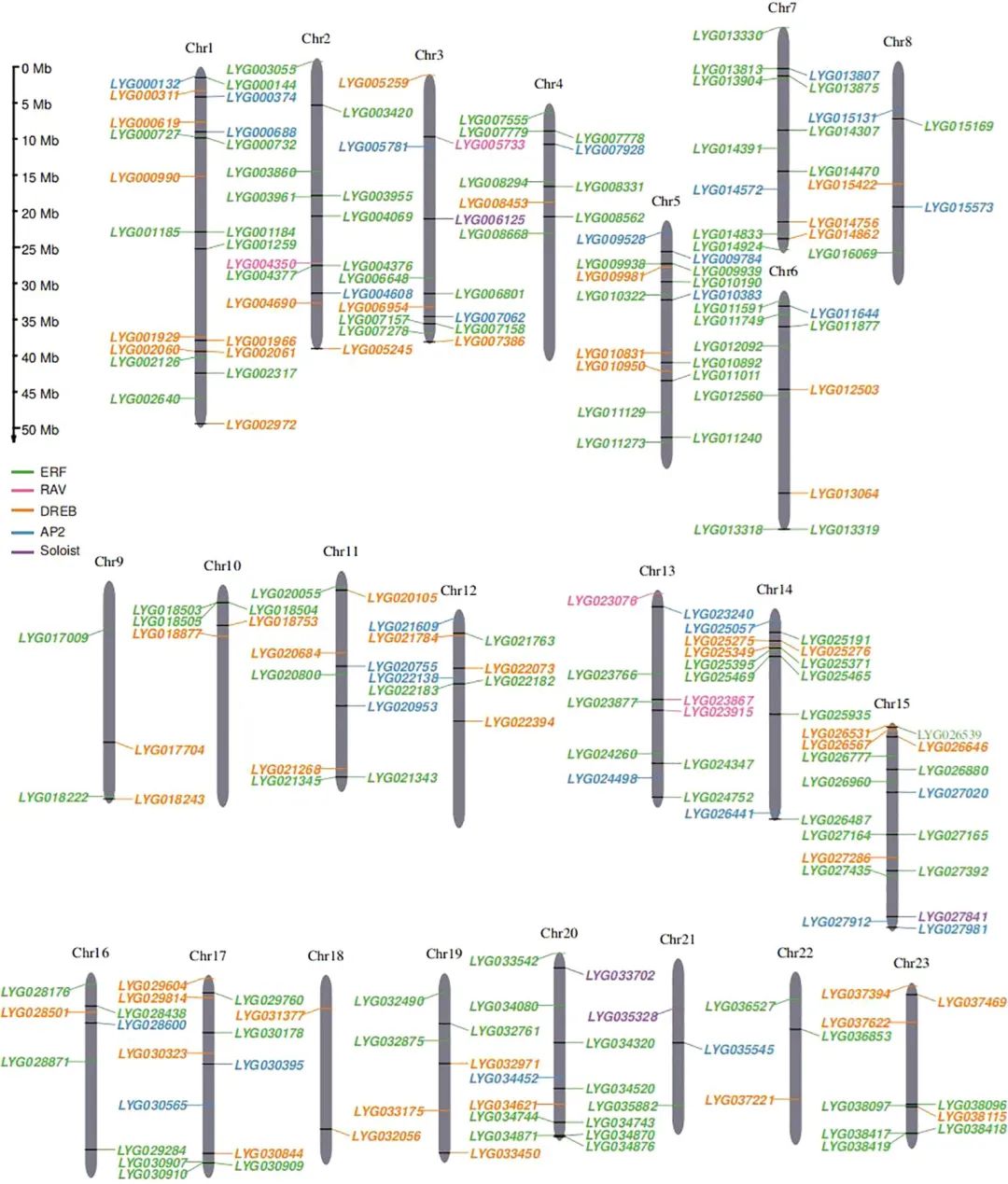
图1. OfAP2/ERFs在桂花23条染色体上的分布
系统发育树分析显示桂花中每个OfAP2/ERFs都可以在拟南芥中找到同源的AtAP2/ERFs(图2A),它们可进一步分为AP2(35)、DREB(57)、ERF(125)、RAV(6)和Soloist(4)5个亚家族(图2B)。此外,桂花种内及与拟南芥种间均存在大量的基因复制事件,说明桂花AP2/ERFs经历过基因扩张。
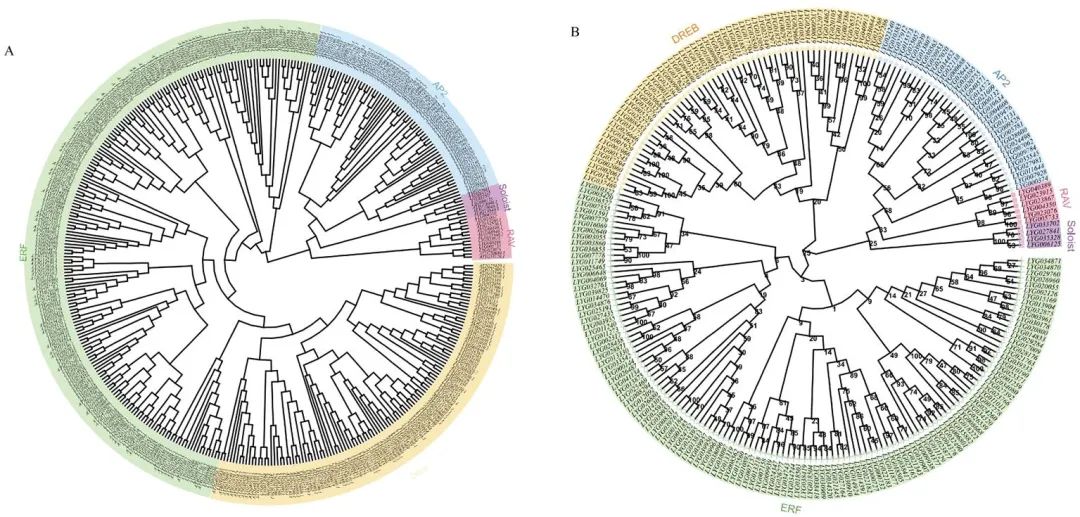
图2. 桂花和拟南芥AP2/ERFs的系统发育树
此外,研究还对OfAP2/ERFs进行了基因结构和启动子顺式作用元件的分析,不同亚家族成员表现不同。具体而言,在基因结构上面,AP2和Soloist亚家族的平均内含子较多,分别达到5.3和5.8个。然而,其他亚家族的平均内含子仅为0-2个,尤其是DREB亚家族,很多成员上甚至没有内含子。鉴于内含子的基因具有快速转录和对环境的反应性,这些结果说明DREBs具有对外部威胁的高效率反应。
在启动子顺式作用元件方面,虽然各亚家族成员都具有生长和发育、光、激素和应激响应这四类顺式作用元件。ERF和DREB亚家族在所有四个主要类别中具有最高的元件比例,而RAV和Soloists则较少。其中,ERF亚家族基因在光响应元件中所占比例最高,达55.57%,其次是DREB(34.75%)。这些发现表明OfAP2/ERFs可能在多种途径中发挥作用。
02、OfAP2/ERFs在组织和处理下的表达模式
基因在各种组织里的表达模式可以为预测基因功能提供线索。基于RNA-seq数据里FPKM>1的原则,研究从花(S1-S6)中鉴定到了最多数量的表达OfAP2/ERFs(124),其次是根、茎和叶,说明OfAP2/ERFs可能在花中起重要作用(图3A)。经过PPI网络构建和筛选后,71个成员留在了网络中,其中LYG027841、LYG033702、LYG035328、LYG006125、LYG007062、LYG004350、LYG002640、LYG003055、LYG007779和LYG034743处于中心位置,表明它们在开花过程中起关键作用(图3B)。
由于OfAP2/ERFs在桂花开花和衰老过程中响应内源乙烯和DNA甲基化,为了进一步确认这种响应模式的相似和差异性,研究对10mM Aza和50mg/L ETH处理的桂花进行了RNA-seq。这两种处理都可以造成桂花早衰并释放内源乙烯。与此一致,PCA分析显示,与乙烯生物合成有关的基因及OfAP2/ERFs在样本之间表现出明显的处理方式和时间上的分离(图3C)。与对照相比,15和24个OfAP2/ERFs在ETH处理后的d1和d2天上调,相应的下调基因是2和5个。然而,Aza处理d1和d2天诱导和抑制的基因分别为28、22、13和8个。鉴于外源乙烯主要在d2天诱导OfAP2/ERFs,该处理时间下受Aza和ETH影响的基因被进一步用作venn分析(图3D)。
结果显示,在ETH和Aza处理下,7个OfAP2/ERF成员的表达模式是一致的,它们被定义为Aza介导的乙烯依赖反应因子(K1-ERFs)。4个OfAP2/ERFs在ETH和Aza处理下表现出相反的变化,而19个OfAP2/ERFs仅受Aza处理的影响,这23个基因被定义为Aza依赖性反应因子(K2-ERFs)。此外,18个OfAP2/ERFs仅受ETH处理的影响,并被定义为乙烯依赖性反应因子(K3-ERFs)。热图清晰地显示了这三种OfAP2/ERFs的表达模式和变异关系(图3E)。
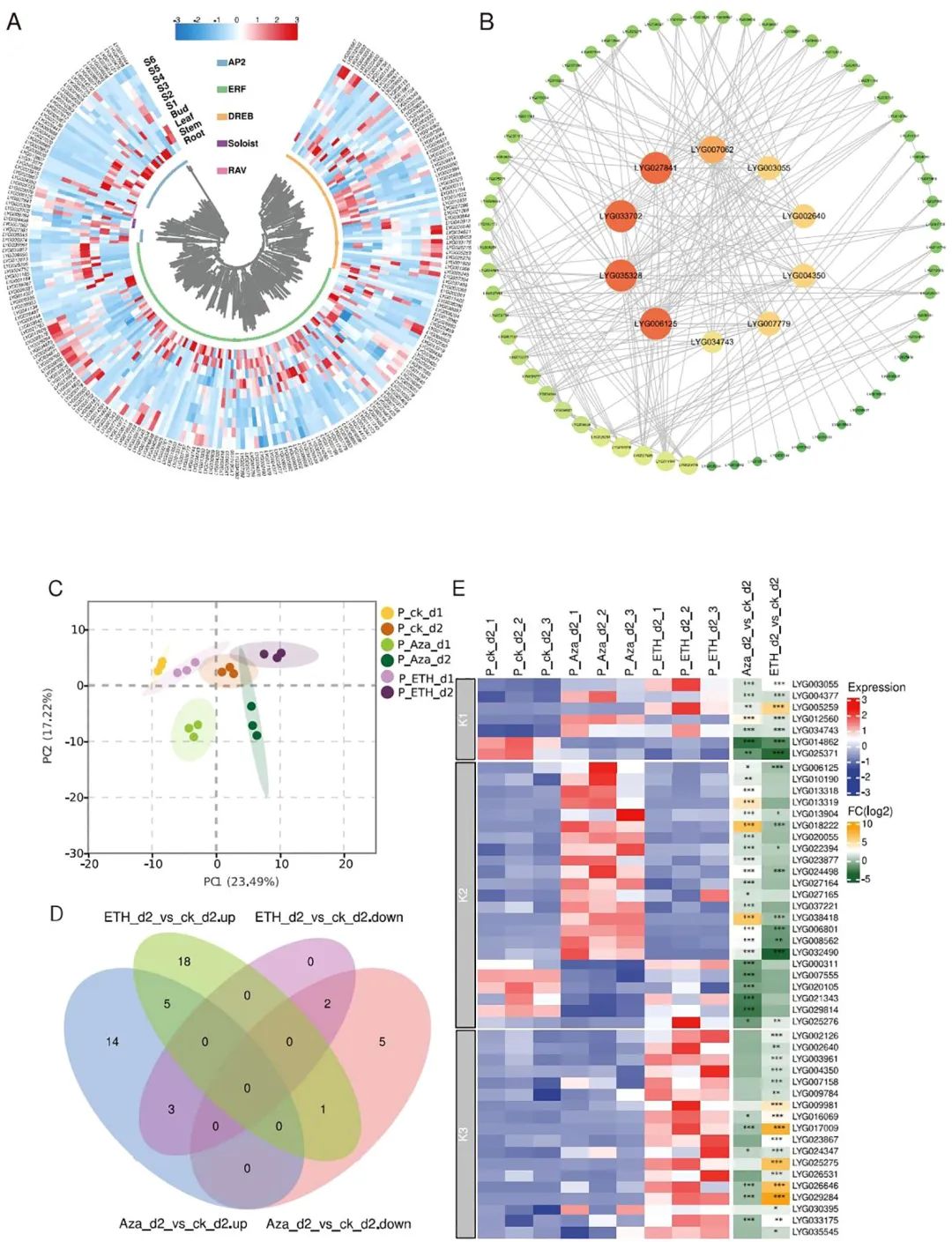
图3. OfAP2/ERFs的表达谱及蛋白质-蛋白质相互作用
03、三种类型OfAP2/ERFs的下游基因分析
在鉴定出3种不同类型的OfAP2/ERFs后,研究进一步分析了它们的下游靶基因。已知ERF蛋白通过识别启动子中的GCC盒或DRE/CRT顺式元件与靶基因结合。研究从’柳叶金桂’基因组中扫描到了6626个启动子中含GCC 盒的基因和23561个含DRE/CRT的基因,共享4388个基因(图4A),它们被用于进一步分析。利用基因共表达关系,研究分别为三类ERFs筛选到了829、2161和1090个下游基因(图4B)。
有趣的是,这些下游基因具有相当比例的重叠(693/2316),同时K2-ERFs的下游独特基因最多,暗示Aza和ETH在调控桂花花衰老中具有相似的途径且DNA低甲基化通过OfAP2/ERFs调节下游基因功能具有特殊调控途径。因此,研究还对这三类下游基因进行了功能富集分析。
GO富集表明所有下游基因都参与花粉识别、细胞识别、羧酸代谢过程、含氧酸代谢过程和有机酸代谢过程(图4C)。然而,K2-ERFs组的下游基因参与了更独特的生物过程,如翻译、酰胺和肽的生物合成和代谢过程,以及有机和细胞氮化合物的生物合成过程。
从KEGG富集情况来看,三类OfERFs的下游基因均参与半胱氨酸和蛋氨酸代谢、丙酸代谢和脂肪酸生物合成(图4D)。此外,K1-ERFs和K3-ERFs组的下游基因参与植物MAPK信号通路,已知该通路与乙烯信号转导有关。然而,K2-ERFs组的下游基因独立参与酰胺tRNA的生物合成和支链氨基酸(缬氨酸、亮氨酸和异亮氨酸,BcAAs)的生物合成。最近的一项研究表明,CHH超甲基化通过减少支链氨基酸的积累而诱导馨馨花瓣衰老。
总之,这些结果表明,Aza处理介导的DNA去甲基化一方面通过乙烯信号通路影响羧酸、含氧酸和有机酸的分解代谢以及脂肪酸的生物合成。另一方面,以独立乙烯信号通路影响氮素代谢、酰胺tRNA生物合成和BcAA生物合成,从而介导桂花开花和衰老。
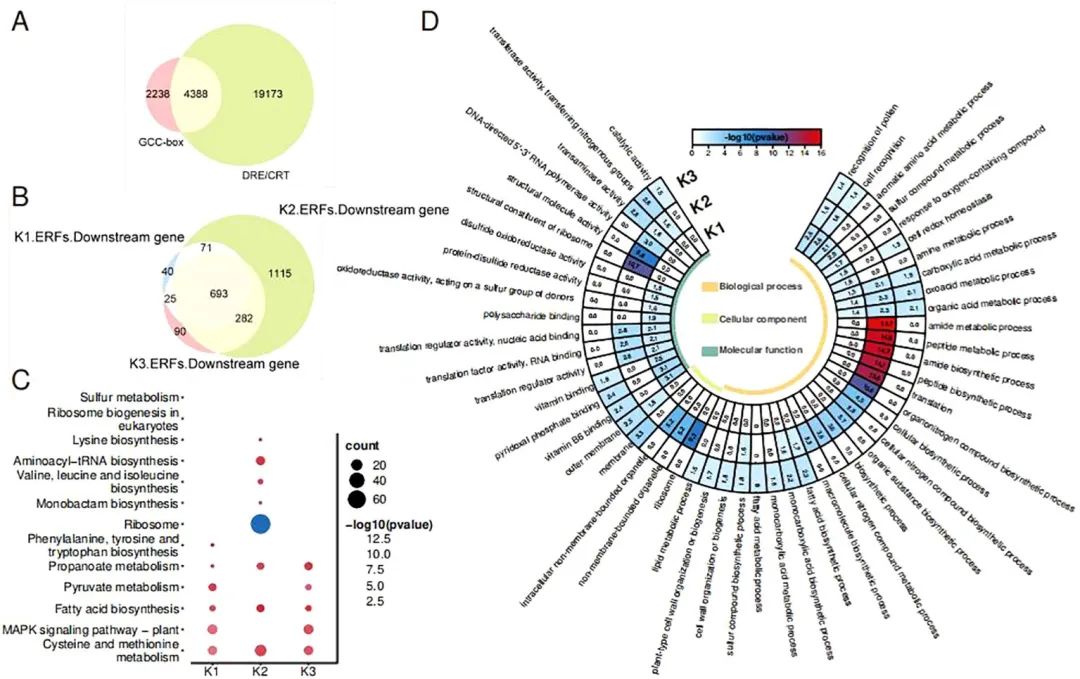
图4. OfAP2/ERFs的下游基因分析
04、有机酸代谢和支链氨基酸生物合成的转录调控网络
上述分析指出3类ERFs的下游基因都参与了有机酸代谢,研究为此构建了有机酸代谢的转录调控网络(图5A)。3类ERFs共调控46个有机酸代谢基因,其中15个基因被它们同时调控,说明它们的功能相似。在K1-ERFs调控的18个有机酸代谢基因中,16个也受K3-ERFs调控。此外,K2-ERFs还独立调控19个有机酸代谢基因。这些结果表明,ETH或Aza诱导的花衰老可能都是通过OfERFs介导的有机酸代谢途径实现的。
在整个转录调控网络中,LYG039238, LYG008720, LYG006602, LYG028609, LYG003992, LYG009757和LYG004527是最核心的几个有机酸代谢基因(图5A),三个在桂花衰老过程中表达量增加。其中,LYG008720和LYG003992还受到Aza和ETH处理诱导(图5B、C)。LYG034743, LYG014862, LYG005259, LYG006125, LYG020055, LYG000311, LYG007555, LYG023877, LYG003961, LYG007158和LYG025275是网络中的核心ERFs(图5A),它们中的大多数都在衰老过程中表达量增加。LYG005259, LYG020055和LYG025275分属于K1-ERFs、K2-ERFs和K3-ERFs。LYG005259受Aza和ETH处理诱导,LYG020055只受Aza处理诱导,而LYG025275只受ETH处理诱导(图5B、C)。
BcAAs的减少可能是花衰老的一个标志,此研究发现K2-ERFs共调控了6个参与BcAA生物合成的基因。有趣的是,其中5个基因在花衰老过程中下调(图5D),这可能导致花衰老过程中BcAAs含量下降。为了了解调节BcAA生物合成的ERFs,研究从K2 -ERFs的下游基因构建了一个转录调控网络(图5E)。整个网络分为两个子网络,一个子网络由LYG024841和5个ERFs组成,另一个子网络由6个ERFs和5个BcAA合酶基因组成。LYG030861和LYG021850是BcAA合酶的关键基因,而LYG006125和LYG007555是关键的ERF基因。LYG030861是拟南芥DHAD同源蛋白,在桂花脱落期(S6期)几乎不表达。LYG007555编码ERF109蛋白,该蛋白在花衰老过程中上调(图5D)。在拟南芥中,突变erf109导致ROS减少,延缓植物衰老。沉默白菜BrERF109可促进类黄酮生物合成,延缓叶片衰老。这些结果提示,LYG007555可能是花衰老的负调控因子,通过抑制LYG030861的表达和降低BcAAs含量来延缓花的衰老。
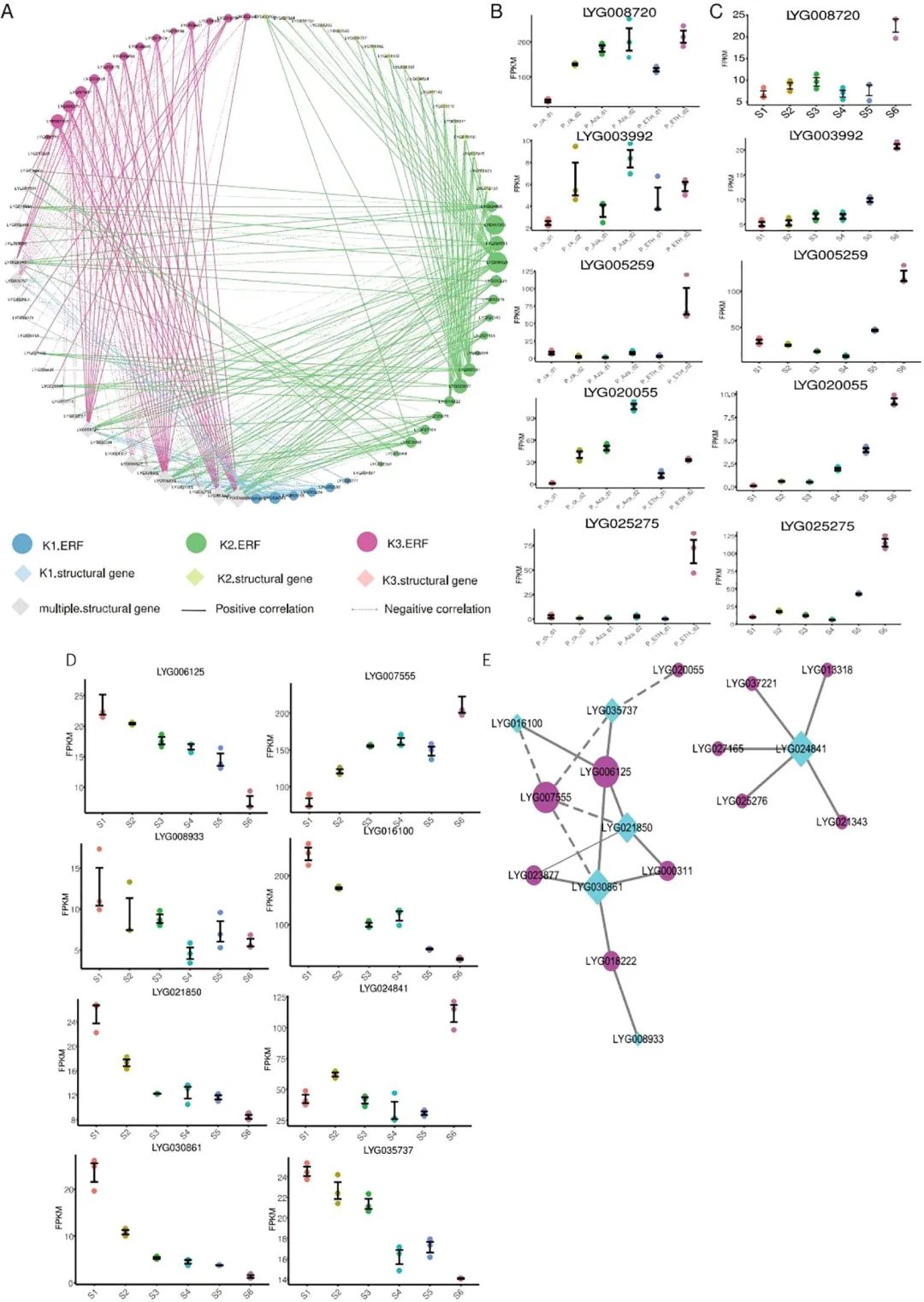
图5. 有机酸代谢与支链氨基酸生物合成相关基因分析
05、转基因桂花中OfERF017的功能鉴定
上述结果发现,OfERF017(LYG025275)参与了有机酸代谢网络,其表达量随着花的衰老而增加(图5A、C),与S1 -S6乙烯产量增加和总有机酸减少一致。因此,以OfERF017为例,研究其在有机酸分解代谢和花衰老中的作用。
qPCR结果显示,OfERF017主要在S5和S6中表达,并在S6中达到峰值(图6A)。在桂花花中瞬时过表达OfERF017会导致内源乙烯产量显著增加(图6B、C),并导致其衰老表型显著增加(图6D)。接种1 d后,OfERF017-OE出现部分花褐化现象,CK和P2300只有少量花褐化。到第三天,OfERF017-OE的所有花都呈现褐变,而WT和P2300的部分花仍保持黄色,没有腐烂(图6D)。这些结果表明,OfERF017促进了转基因花的衰老。
然后,研究对OfERF017-OE和P2300花进行了转录组分析,一共鉴定了2150个差异表达基因(DEGs),1455和695个DEGs分别在OfERF017-OE 中上调和下调(图6E)。GO富集显示,这些DEGs参与了“DNA模板转录”和“基因表达调控”,说明了OfERF017作为转录因子的功能(图6F)。此外,“丙酮酸代谢过程”、“单羧酸代谢过程”、“含氧酸代谢过程”和“有机酸代谢过程”也显著富集。有趣的是,在这些过程中,上调的DEGs数量大于下调的DEGs数量(图6F)。
此外,采用LC-MS/MS对OfERF017-OE和P2300中的有机酸进行检测。一共检测到65种有机酸,其总含量从P2300中的2.00E+08降到OfERF017-OE中的1.71E+08(图6G)。综上所述,研究结果表明,OfERF017对乙烯的响应是通过诱导有机酸代谢途径相关基因的高表达,导致有机酸水平降低,促进桂花的衰老。
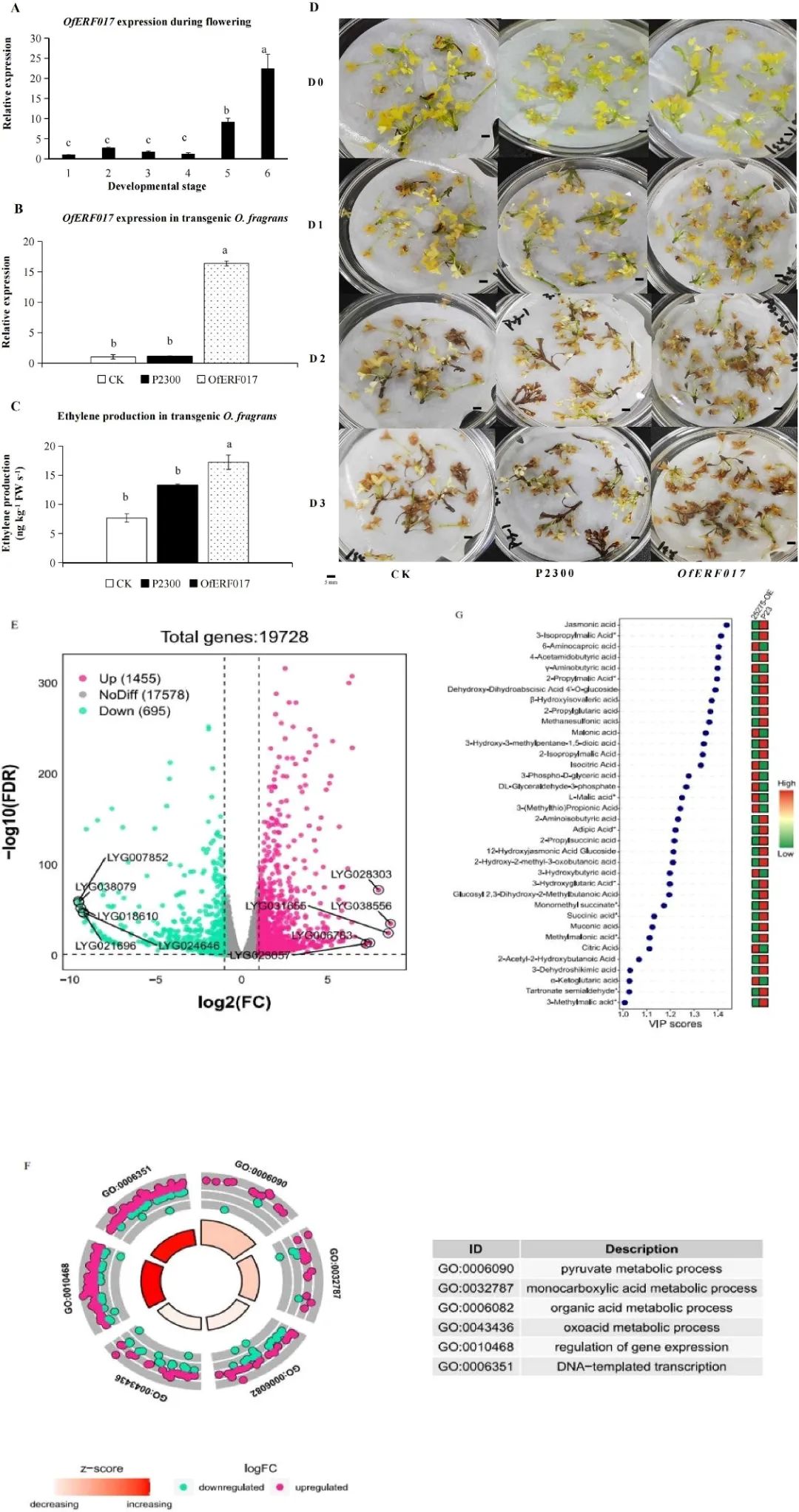
图6. OfERF017在转基因桂花中的功能鉴定
总 结
此研究是首次对桂花‘柳叶金桂’AP2/ERF超家族进行的综合分析。描述了其系统发育关系、基因结构、蛋白相互作用网络以及在不同组织和花期的表达模式。通过比较转录组分析,鉴定了受Aza和ETH处理影响的OfAP2/ERFs下游基因,它们参与相似和不同的生物过程和代谢通路,表明乙烯和DNA低甲基化在调节桂花花衰老中具有串扰和独特的调控机制。共表达分析显示,OfAP2/ERFs在BcAAs生物合成和有机酸代谢中发挥了核心作用,并选择了OfERF017做进一步的功能分析。过表达OfERF017增加了内源乙烯的产生,导致衰老表型提前,有机酸水平降低,促进了桂花的衰老。这些研究结果将为进一步阐明OfAP2/ERFs在桂花中的功能奠定基础。
湖北科技学院国家林业草原桂花工程技术研究中心\国家花卉工程技术研究中心桂花创新中心邹晶晶教授和武汉爱基百客生物科技有限公司科学事业部张俊博士为论文的共同第一作者,中心主任陈洪国教授、张规富教授和李泽卿副教授为共同通讯作者。研究得到国家自然科学基金(32271951、32101581和32372754)、湖北省中央引导地方科技发展专项(2022BGE263)、湖北省自然科学基金(2023AFB1063和2024AFB1057)、湖北科技学院创新团队项目(2022T02)和湖北科技学院博士学位基金(BK202419和BK202002)的资助。
关于我们
武汉爱基百客生物科技有限公司(简称爱基百客),位于武汉高农生物园,是一家专业提供表观组学科研服务、单细胞与空间组学测序分析和高通量测序分析的新型生物科技服务企业。公司先后引入ChIP、WGBS、ATAC-seq、DNBSEQ-T7、10x Genomics、SeekOne® DD、DNBelabC-TaiM4和Stereo-seq等实验平台,不断提升公司的科研服务能力。
运营至今合作的科研客户超2000家,涵盖国内知名科研院所、高校以及相关生物企业,科研成果曾多次在Science、Cancer Cell、Nature Communications、J HEMATOL ONCOL、Plant Cell 等国际高水平学术期刊发表,受到了客户广泛好评,是国内成长最迅速的高通量测序科研服务企业之一。



















