小罗碎碎念
今日顶刊:Nat Med
这篇文章是2024-09-20发表在《Nature Medicine》上的一篇研究型论文,标题为“High-throughput identification of repurposable neuroactive drugs with potent anti-glioblastoma activity”。
先打个提前量,发表在Nat Med 的文章,比NC的文章难读多了,所以大概率你看完一遍以后是懵的,但是!!药物筛选+单细胞测序,大概率是未来的一个趋势,与其以后被推着走,不如先自己往前迈一迈。
这篇文章虽然思路和设计比较复杂,但是也是从基础方法过渡来的,里面也用了我们熟知的Lasso回归,不过有意思的是药物筛选的阶段,居然用了机器学习里非常基础的一个概念——奥卡姆剃刀原则。

| 作者类型 | 作者姓名 | 单位名称(英文) | 单位名称(中文) |
|---|---|---|---|
| 第一作者 | Sohyon Lee | ETH Zurich | 苏黎世联邦理工学院 |
| 第一作者 | Tobias Weiss | University Hospital Zurich and University of Zurich | 苏黎世大学医院和苏黎世大学 |
| 通讯作者 | Michael Weller | Comprehensive Cancer Center Zurich, University Hospital Zurich | 苏黎世大学医院综合癌症中心 |
| 通讯作者 | Berend Snijder | ETH Zurich, Swiss Institute of Bioinformatics | 苏黎世联邦理工学院,瑞士生物信息学研究所 |
文章的主要作者是Sohyon Lee和Tobias Weiss,研究团队通过高通量筛选,发现了一些可以重新利用的神经活性药物,这些药物对治疗胶质母细胞瘤(glioblastoma)具有强大的活性。
胶质母细胞瘤是一种极具侵袭性的原发性脑癌,目前的治疗选择非常有限,预后极差。研究者们探索了胶质母细胞瘤的神经发育和神经生理学弱点,以寻找新的治疗方法。他们使用一种临床相关的、单细胞分辨率的平台,对27名患者的手术样本进行了超过2500次的体外药物反应分析,测试了132种药物。
研究发现,多种类别不同的神经活性药物显示出强大的抗胶质母细胞瘤效果,这些药物在不同的模型系统中得到了验证。通过可解释的分子机器学习分析药物-靶标网络,研究者们揭示了神经活性药物通过AP-1/BTG驱动的胶质母细胞瘤抑制作用。这使得研究者能够在silico(计算机模拟)中筛选超过100万个化合物,并且具有高患者验证准确性。
深入的多模态分析证实了Ca2+驱动的AP-1/BTG通路诱导是胶质母细胞瘤的一个神经肿瘤学弱点,抗抑郁药vortioxetine(一种神经活性药物)与当前的标准化疗药物在体内具有协同作用。这些发现为胶质母细胞瘤的治疗建立了一个基于其神经起源的可行框架。
文章还详细描述了研究方法,包括药物筛选、单细胞RNA测序、药物-靶标网络分析、电生理学分析、动物模型实验等。研究结果为胶质母细胞瘤的个性化治疗提供了新的策略和药物候选。
一、引言
胶质母细胞瘤是最致命的原发性脑癌,其治疗选择有限,由异质性的发育程序、遗传驱动因素和肿瘤微环境(TMEs)塑造(参考文献1-6)。
尽管对这种异质性的理解在增加,但唯一批准用于胶质母细胞瘤一线治疗的药物是烷化剂替莫唑胺(TMZ),它将中位生存期从12个月延长至15个月(参考文献7,8)。
靶向治疗在很大程度上未能成功,部分原因是血脑屏障(BBB)限制了肿瘤的可及性,存在治疗抵抗性的胶质母细胞瘤干细胞(GSCs),以及缺乏具有临床预测性的患者模型系统(参考文献9-11)。系统地解决这些治疗障碍是迫切的临床需求。
一个新兴的研究范式是考虑胶质母细胞瘤的神经生物学,包括类似于神经发育的干细胞特征(参考文献3,4,12-17),癌细胞与神经电路的突触整合(参考文献18-25),以及肿瘤微环境中特定神经递质或其他分泌途径的调节(参考文献18,26-31)。
胶质母细胞瘤的这些神经方面提供了可以通过重新利用设计用于穿越BBB并常规用于其他神经系统指征的“神经活性”药物(NADs)进行药理学靶向的临床上可操作的弱点。令人兴奋的近期研究报道了通过脑-胶质瘤界面进行的肿瘤外在调节,以及某些代谢和干细胞途径在胶质瘤中的作用,这些途径可以通过特定的NADs进行靶向(参考文献21-25,27,30)。
然而,对于绝大多数NADs,它们的抗肿瘤活性尚未在胶质母细胞瘤患者队列的前瞻性研究中进行测试,肿瘤内在的NAD靶点仍未完全绘制。因此,需要对神经治疗胶质母细胞瘤的脆弱性和个性化治疗机会进行系统的临床前评估。
二、结果
2-1:针对胶质母细胞瘤的临床一致性体外药物分析
为了识别胶质母细胞瘤的临床可操作治疗脆弱性,作者对IDH野生型胶质母细胞瘤患者样本、二维(2D)和三维(3D)患者来源细胞(PDC)培养、基于机器学习的药物-靶点网络以及原位小鼠模型进行了前瞻性多模式药物分析(图1a和补充表1和2)。
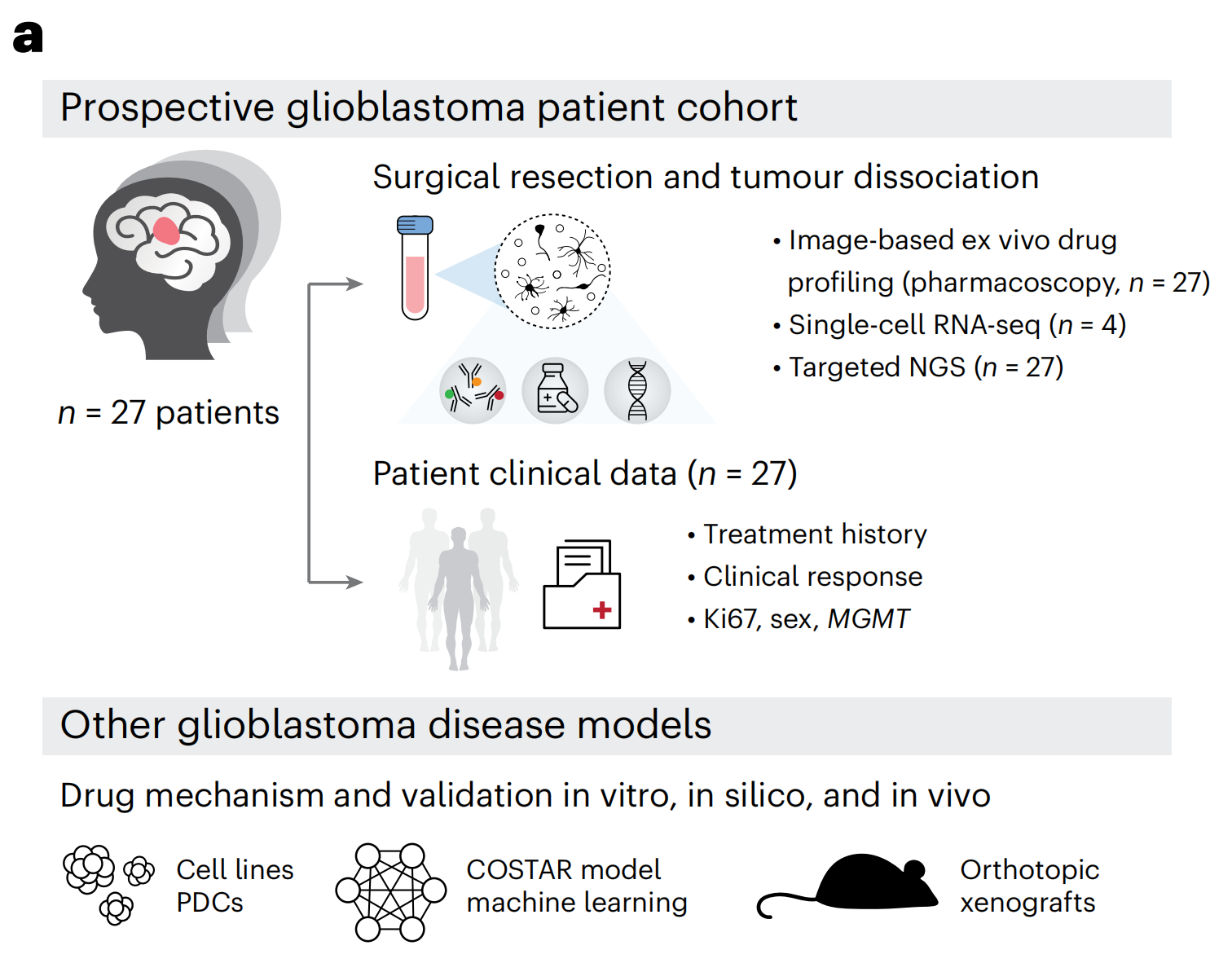
作者适应了药理成像(PCY),这是一种之前在血液恶性肿瘤的功能精准医学试验中验证的基于图像的体外药物筛选平台(参考文献32-35),用于患者胶质母细胞瘤组织的功能表征。
对于实体肿瘤和血液癌症,PCY通过基于免疫荧光(IF)染色的药物诱导的癌细胞相对于非恶性TME细胞的特异性减少来识别“靶上”药物反应。因此,作者首先着手定义并验证一个在患者样本中捕获大多数胶质母细胞瘤细胞的临床相关标记物谱。
胶质母细胞瘤细胞采用一系列恶性的细胞程序,重演神经分化,从神经祖细胞样干细胞(GSCs)到更成熟的星形细胞样细胞状态(参考文献3,4,9,14,15,36)。因此,神经祖细胞标记物(例如,巢蛋白)和星形细胞系标记物(例如,S100B和GFAP)被广泛用于表征患者肿瘤(参考文献19,21,22,24,37–39),其中Nestin+ GSCs代表一种治疗抵抗性的亚群,维持长期肿瘤生长(参考文献9–11,16)。
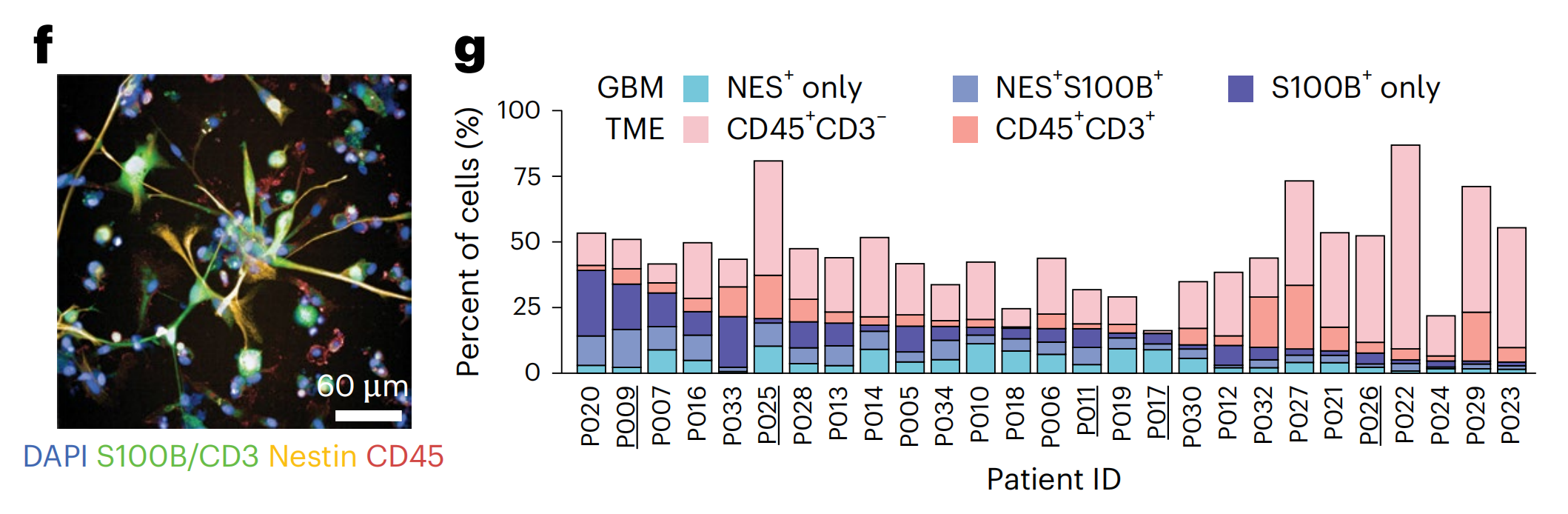
对跨越三个独立单细胞RNA测序(scRNA-seq)数据集和22名患者(包括本研究中的四名)的25,510个单细胞转录组进行分析,确认了由Nestin/S100B表达和免疫标记CD45缺失定义的胶质母细胞瘤细胞捕获了大多数恶性细胞(图1b,c和扩展数据图1a–d)。
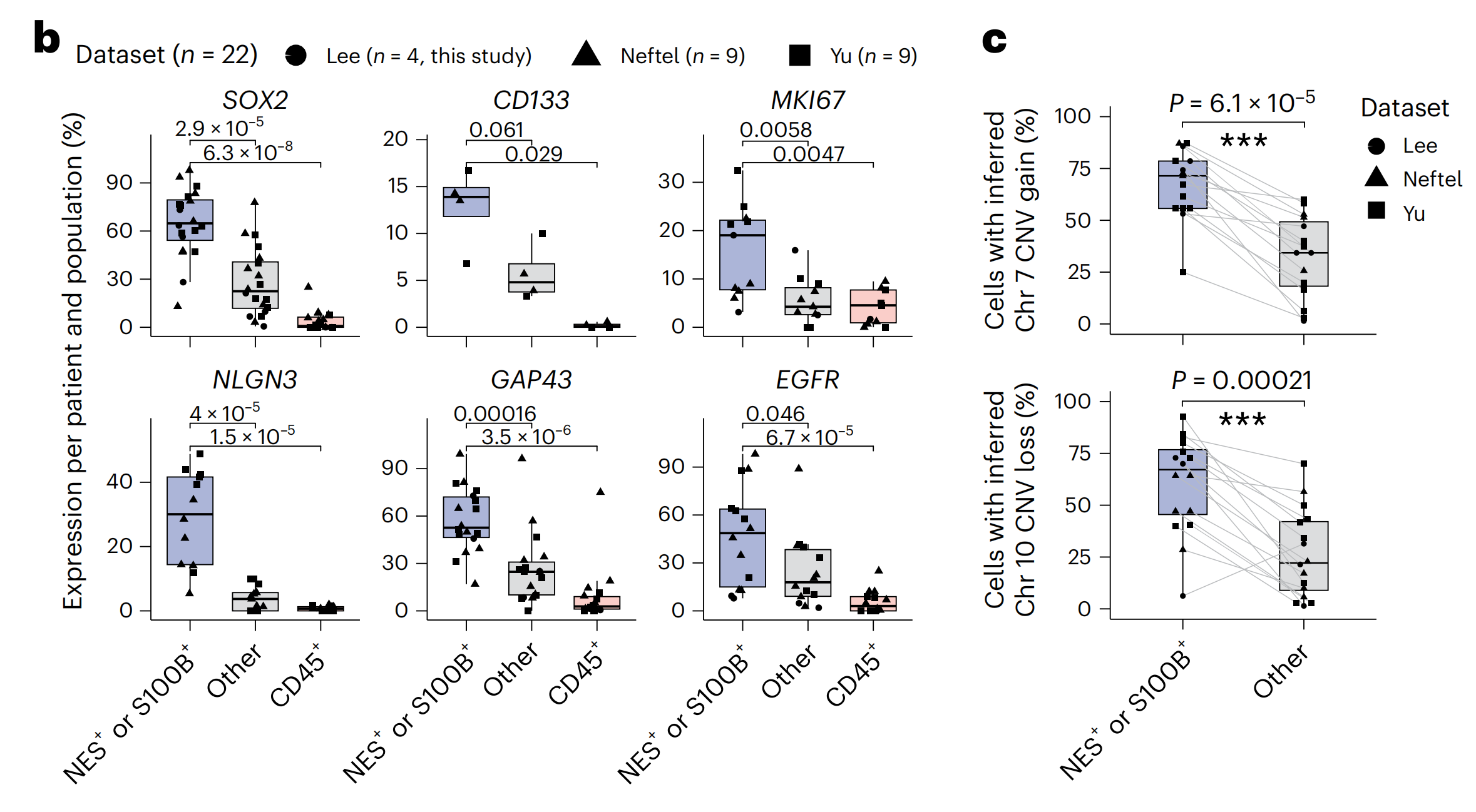
与CD45+免疫细胞和对于Nestin、S100B和CD45三重阴性的“其他”细胞相比,这些细胞显示了与恶性相关的标记物(例如,SOX2、CD133、EGFR和Ki67)的最高表达(图1b和扩展数据图1d)。
胶质母细胞瘤细胞还表达了与胶质母细胞瘤神经特性相关的标记物,如突触电路整合、神经元活动调节的旁分泌信号传导和肿瘤微管形成(图1b和扩展数据图1d)。患者样本的额外IF染色确认了Nestin+细胞对这些恶性和神经特性相关标记物的高表达(扩展数据图1e,f)。
此外,对胶质母细胞瘤标志性遗传改变的染色体拷贝数改变(CNA)分析确认了Nestin/S100B和CD45−标记定义捕获了在这些患者中检测到这些标志性CNA的大多数恶性细胞(图1c)。
最后,对三重阴性“其他”细胞的细胞类型特异性富集分析揭示了额外的TME细胞类型,包括CD45低肿瘤相关巨噬细胞/小胶质细胞、成纤维细胞和基质细胞(扩展数据图1g,h)。
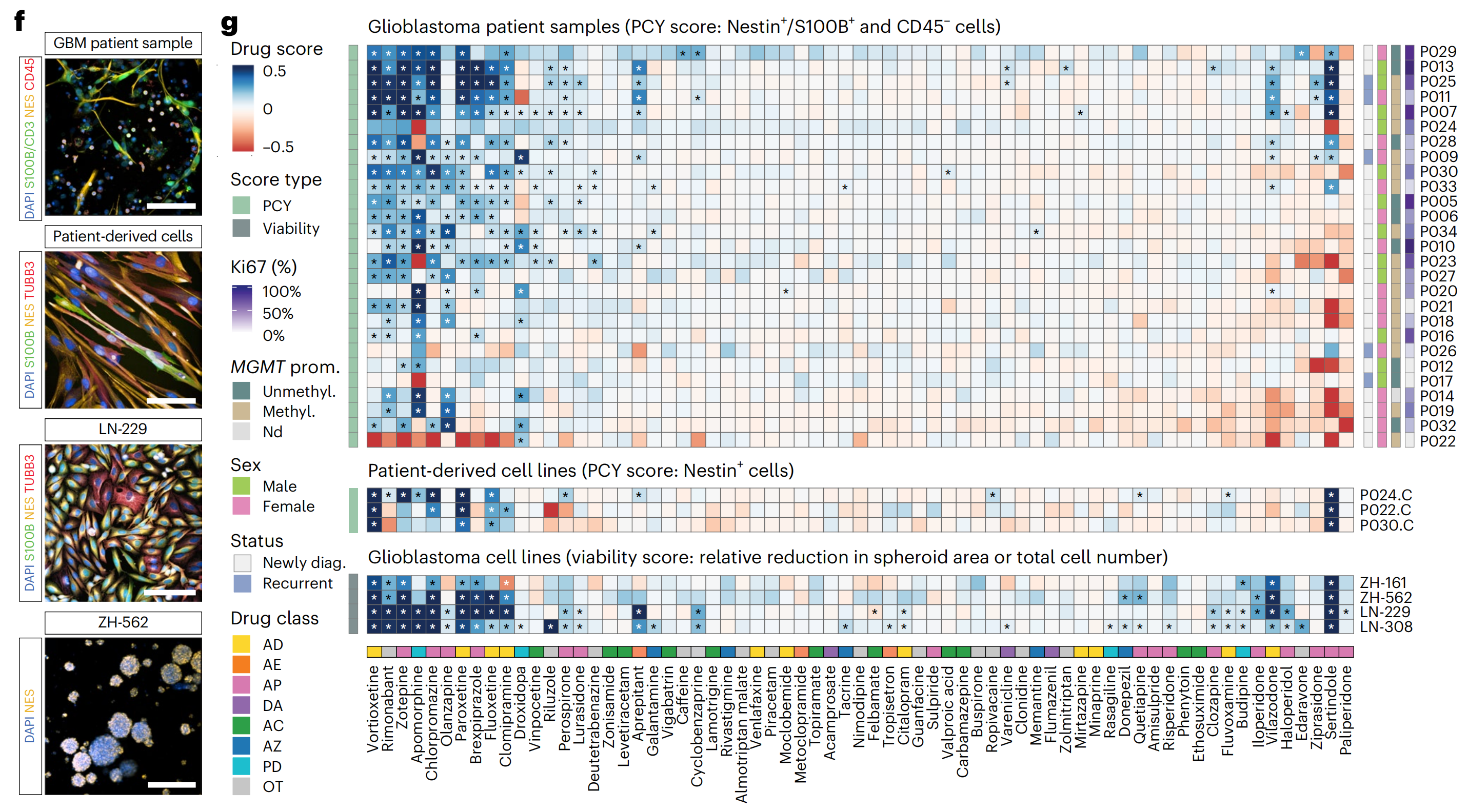
为了评估由这一标记物面板定义的胶质母细胞瘤药物反应分析的 临床一致性,作者通过PCY在27名IDH野生型胶质母细胞瘤患者(“前瞻性队列”;n = 27;图1d和补充表1和2)的手术材料中测量了对一线和二线胶质母细胞瘤化疗的体外反应。每个患者样本在手术当天分离,并直接与药物孵育48小时(图1e)。
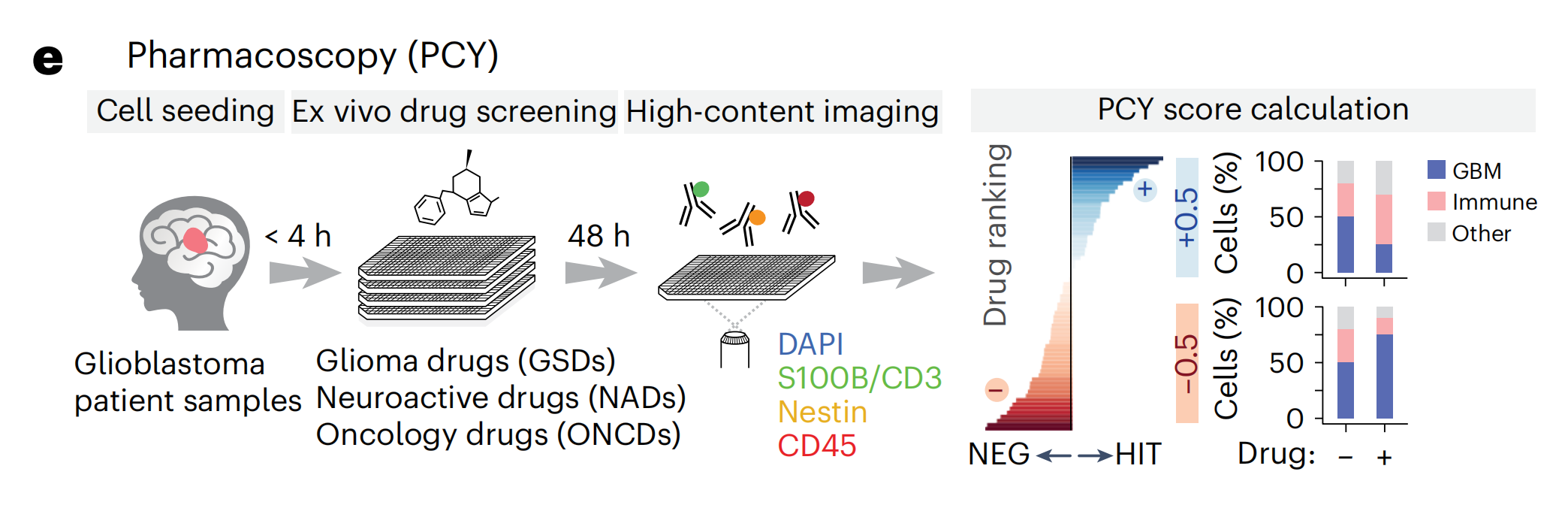
随后对标记物面板的IF染色和自动显微镜成像揭示了基线时的高度肿瘤内和肿瘤间异质性(图1f,g):在患者之间,胶质母细胞瘤细胞从4%到39%,免疫细胞从1%到82%,而“其他”细胞从13%到84%(图1g)。在没有药物治疗的情况下,平均而言,48小时内有不到10%的胶质母细胞瘤细胞发生凋亡(扩展数据图1i–k)。
接下来,作者量化了药物诱导的“靶上”肿瘤减少,其中PCY得分阳性表示胶质母细胞瘤细胞相对于TME细胞的更大减少。将作者的分析限制在接受TMZ作为其临床一线治疗一部分的新诊断患者,并且有临床结果记录的患者(27名患者中的16名),作者发现胶质母细胞瘤细胞对体外TMZ的高敏感性,而不是免疫或其他细胞,与患者结果的改善相关(图1h,i和扩展数据图1l,m)。
这一临床关联在回顾性队列(n = 18个生物样本库样本)中得到验证,其中胶质母细胞瘤细胞对体外TMZ的高敏感性预示了更长的无进展生存期(PFS)和总生存期(OS)(图1j)。相反,在两个队列中,根据之前报告的TMZ化疗放疗的中位PFS(6.9个月7)进行分层,结果显示生存期较长的患者具有更高的体外TMZ敏感性(图1k)。
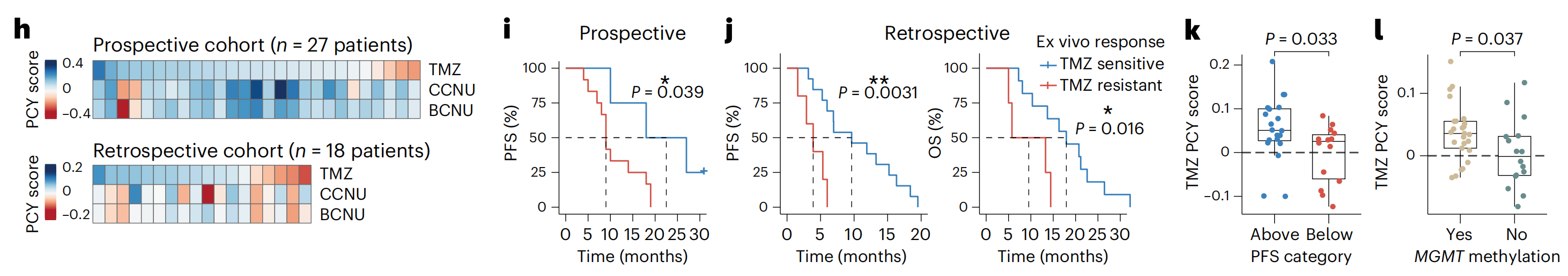
最后,甲基化的MGMT启动子状态与更高的体外TMZ敏感性相关,重现了这一已确立的预后因素(图1l)。总的来说,这些结果证明了PCY在胶质母细胞瘤治疗发现和患者分层中的实用性。
2-2:选定神经活性药物展现出强大的抗胶质母细胞瘤活性
为了寻找可重新用于胶质母细胞瘤治疗的药物候选物,作者通过PCY在患者样本中测试了神经活性和肿瘤学药物库(图2a–g,扩展数据图2a–g和补充表2)。
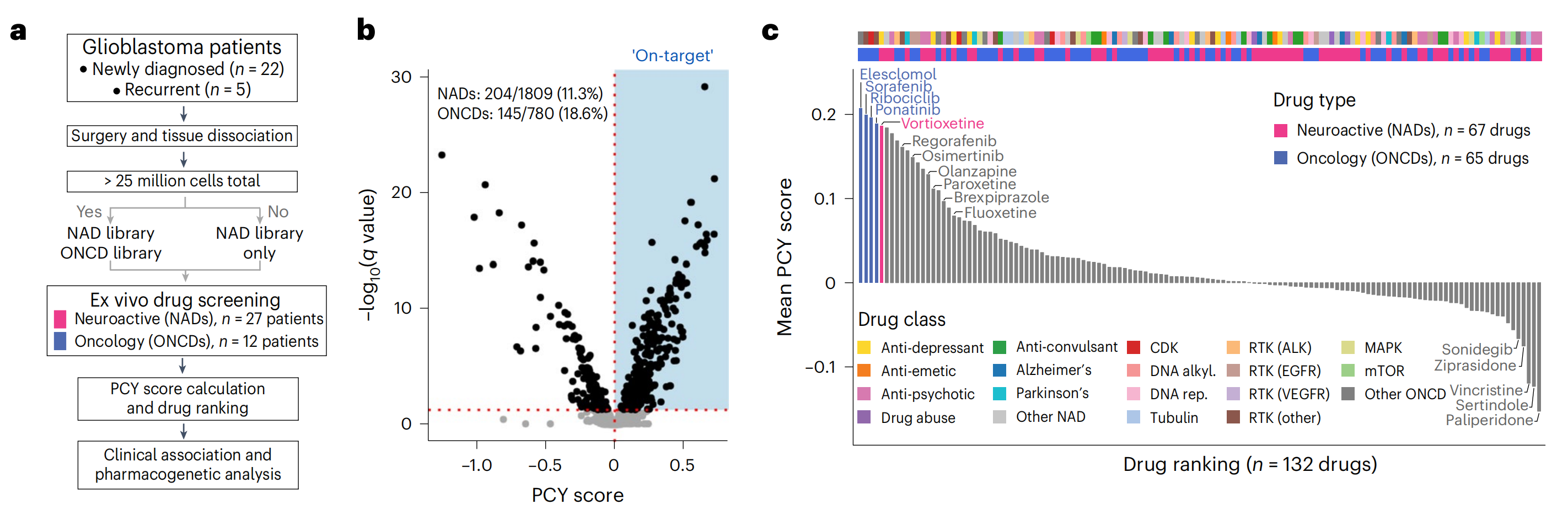
神经活性药物(NAD)库在前瞻性队列(n = 27)中筛选,包括批准用于治疗抑郁症、精神分裂症和阿尔茨海默病等神经系统疾病的药物(n = 67种药物;20 µM)。
相比之下,肿瘤学药物(ONCD)库在手术材料足够时进行筛选(n = 12),包括针对细胞周期依赖性激酶(CDK)和受体酪氨酸激酶(RTK)的癌症疗法(n = 65种药物;10 µM)。
与之前一样,作者在手术后的药物孵育48小时后测量了胶质母细胞瘤细胞的“靶上”减少,同时量化了免疫和“其他”细胞的药物反应(扩展数据图2b)。
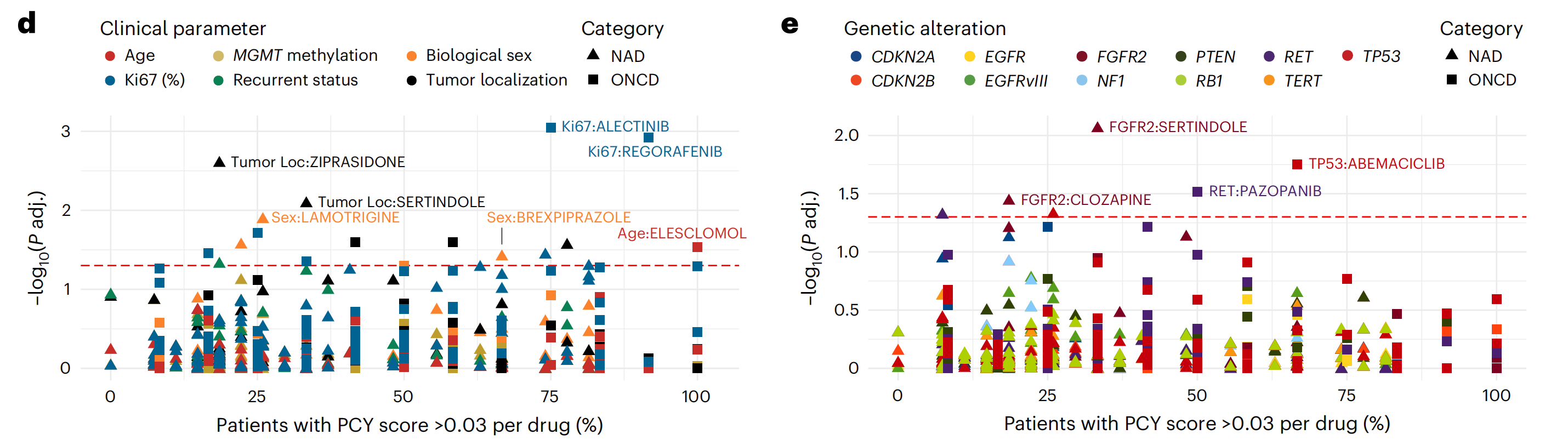
在整个队列中,作者识别出13.5%的体外药物反应具有靶上效应(349种药物中的2,589种;PCY评分 > 0且错误发现率(FDR)调整后的q < 0.05;图2b)。排名前四的药物是针对胶质瘤病因不同方面的肿瘤学药物:氧化应激诱导剂elesclomol(排名132种药物中的第1位),酪氨酸激酶抑制剂sorafenib(排名第2)和ponatinib(排名第4)以及CDK抑制剂ribociclib(排名第3)。
几种顶级ONCD候选药物据报道具有血脑屏障渗透性,包括elesclomol、EGFR抑制剂osimertinib(排名第11)和酪氨酸激酶抑制剂regorafenib(排名第9)。探索ONCD反应与患者临床和药遗传学关联发现,年龄较大的患者对elesclomol的体外敏感性更高,TP53突变的患者对CDK4/6抑制剂abemaciclib的敏感性更高,RET拷贝数缺失的患者对RTK抑制剂pazopanib的敏感性更高(扩展数据图2c–e)。
因此,这种探索性分析可以高效地生成个性化胶质母细胞瘤治疗机会的假设,值得在更大的队列中进行进一步评估。
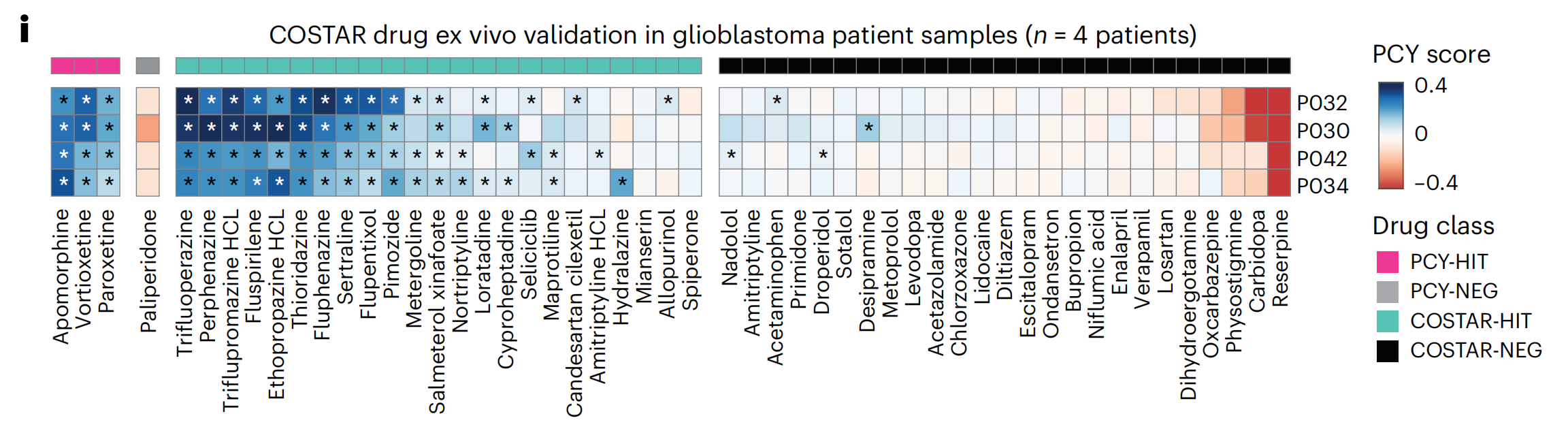
NAD在整个队列中产生了相似比例的显著靶上反应(11.3%;图2b),有15种NAD在患者中展现出了强大的抗胶质母细胞瘤活性(称为“顶级NAD”或“PCY命中NAD”;平均PCY评分 > 0.03;图2b,g和补充表2)。排名最高的NAD是抗抑郁药vortioxetine(总体排名第5;图2c,g和扩展数据图2h),在27名患者中有18名(66.7%)显示出显著的体外疗效。
其他具有临床吸引力的NAD包括选择性5-羟色胺再摄取抑制剂(SSRI)类别的抗抑郁药paroxetine(排名第15,44.4%的患者)和fluoxetine(排名第19,40.7%的患者),以及抗精神病药brexpiprazole(排名第17,48.1%的患者)(图2c,g)。
然而,并非所有识别的顶级NAD都具有临床吸引力,考虑到大麻素受体阻断剂rimonabant(排名第6)和抗精神病药zotepine(排名第7)报告的副作用,但它们可能提供机制上的见解。这些基于PCY的NAD反应使用不同的方法检测凋亡细胞(扩展数据图2i–k和方法)得到重现,并且对肿瘤含量、实验时间点和培养条件具有稳健性(补充图1)。
探索它们的临床和药遗传学关联发现,男性对brexpiprazole的体外敏感性更高(图2d和扩展数据图2f),而FGFR2拷贝数缺失的患者对sertindole的敏感性更高(图2e和扩展数据图2g)。
作者在额外的胶质母细胞瘤疾病模型中测试了NAD库,包括PDC(n = 3株;图2f,g)和常用的2D和3D胶质母细胞瘤细胞系(n = 4株;图2f,g)。顶级NAD有效地减少了PDC中Nestin+细胞的比例和代谢活性,减少了粘附细胞系(LN-229和LN-308)的总细胞数,以及胶质母细胞瘤起始细胞系(ZH-161和ZH-562)的球体大小,并确认了浓度-反应关系(图2g,扩展数据图3a–d和补充图2)。
抗抑郁药vortioxetine、paroxetine和fluoxetine的疗效异常一致,其中vortioxetine在所有测试的模型系统中均排名第一(图2g)。
因此,通过在胶质母细胞瘤患者手术材料及模型系统中的全面筛选,作者识别出一系列可重新利用的NAD,它们具有强大的抗胶质母细胞瘤疗效。这些顶级NAD在模型系统中的一致性,即使在没有TME和突触电路的情况下,表明存在一个或多个肿瘤内在的神经脆弱性。
2-3:不同的功能依赖性依赖于NAD靶点
具有抗胶质母细胞瘤疗效的NAD代表了一系列不同的药物类别,表明其经典的作用模式并不能解释它们的疗效(图3a)。
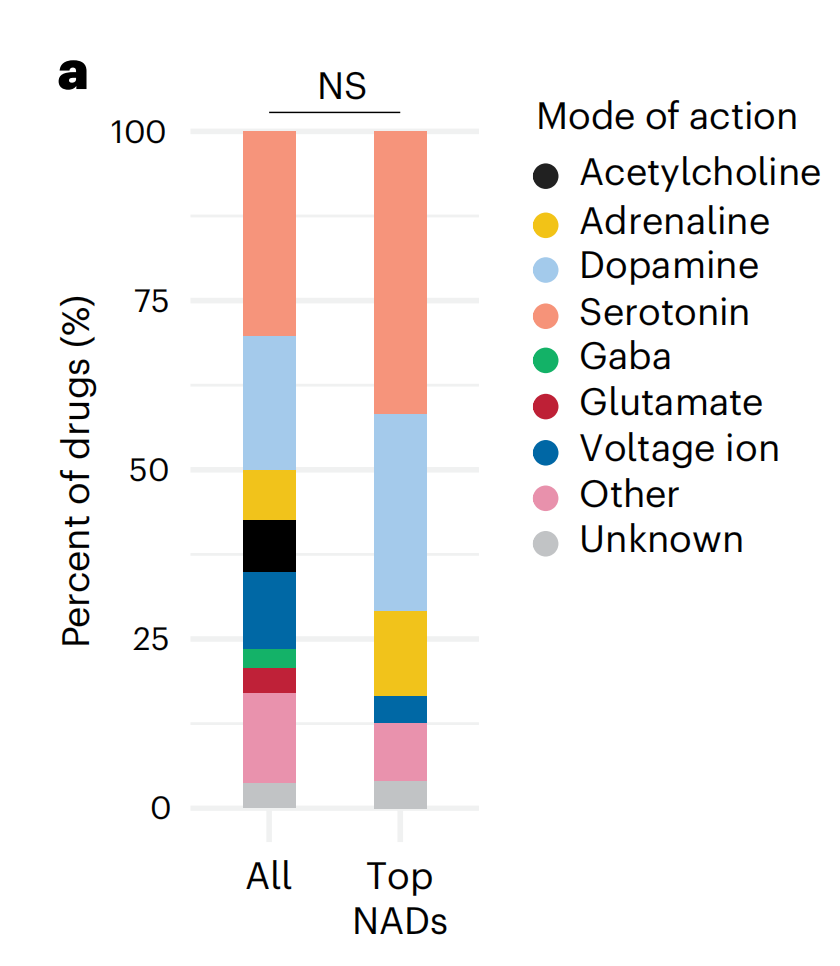
例如,在作者测试的五羟色胺和多巴胺途径调节剂中,只有11种抗抑郁药中的4种(36%)和16种抗精神病药中的6种(38%)在患者样本中显示出抗胶质母细胞瘤活性(扩展数据图4a)。然而,这样的药物分类简化了NAD的多药理学药物-靶点特征。
大多数NAD作用于多个主要靶基因(PTGs),包括离子通道和G蛋白偶联受体(GPCRs),这些基因的表达仍然是胶质母细胞瘤异质性的一个很大程度上未探索的维度。
为了评估NAD PTG表达特征,作者考察了三个胶质母细胞瘤单细胞RNA测序(scRNA-seq)数据集(图3b,c和扩展数据图4b,c)4,40。在报道与NAD有生物化学交互作用的PTGs(基于Drug Targets Commons(DTC)41)中,钾通道、谷氨酸受体和大麻素受体的表达在胶质母细胞瘤细胞中得到了富集,而其他靶点类别则显示出更广泛的表达模式(扩展数据图4b)。
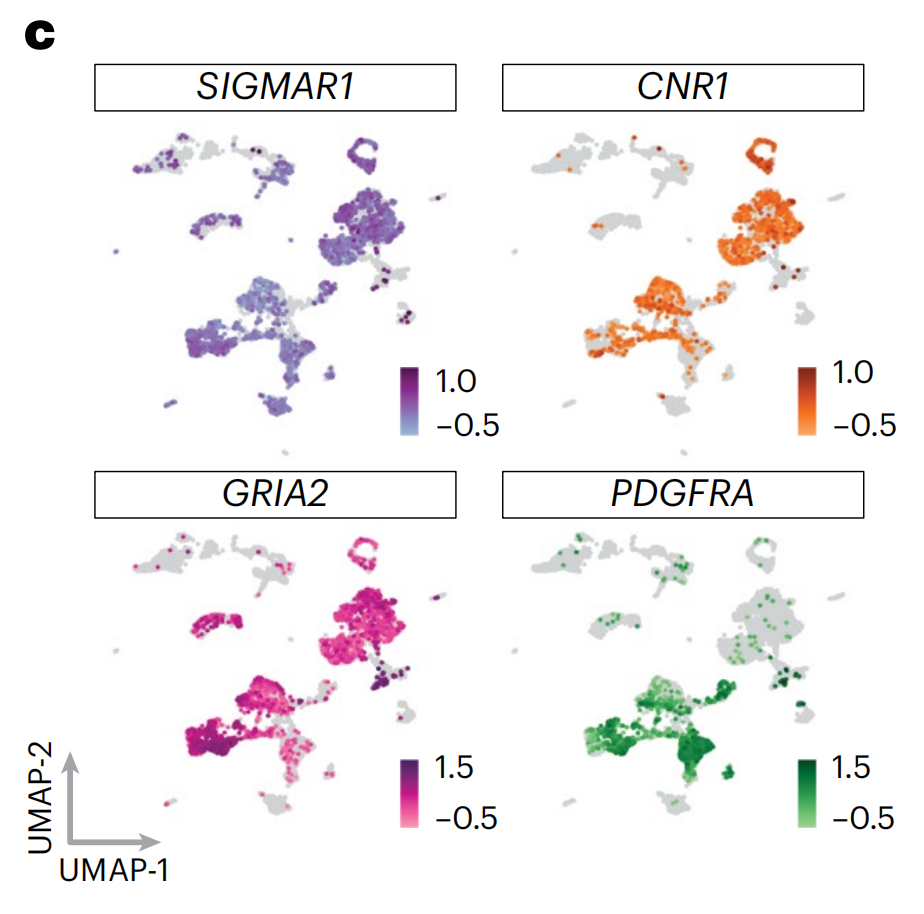
为了表征PTG表达的异质性,作者计算了神经特异性和患者特异性评分(图3b,扩展数据图4c,补充表3和方法),其中较高的神经特异性表明在神经祖细胞中的相对富集(范围从-1到1),而较高的患者特异性(范围从0到1)则表示更特异的患者表达。
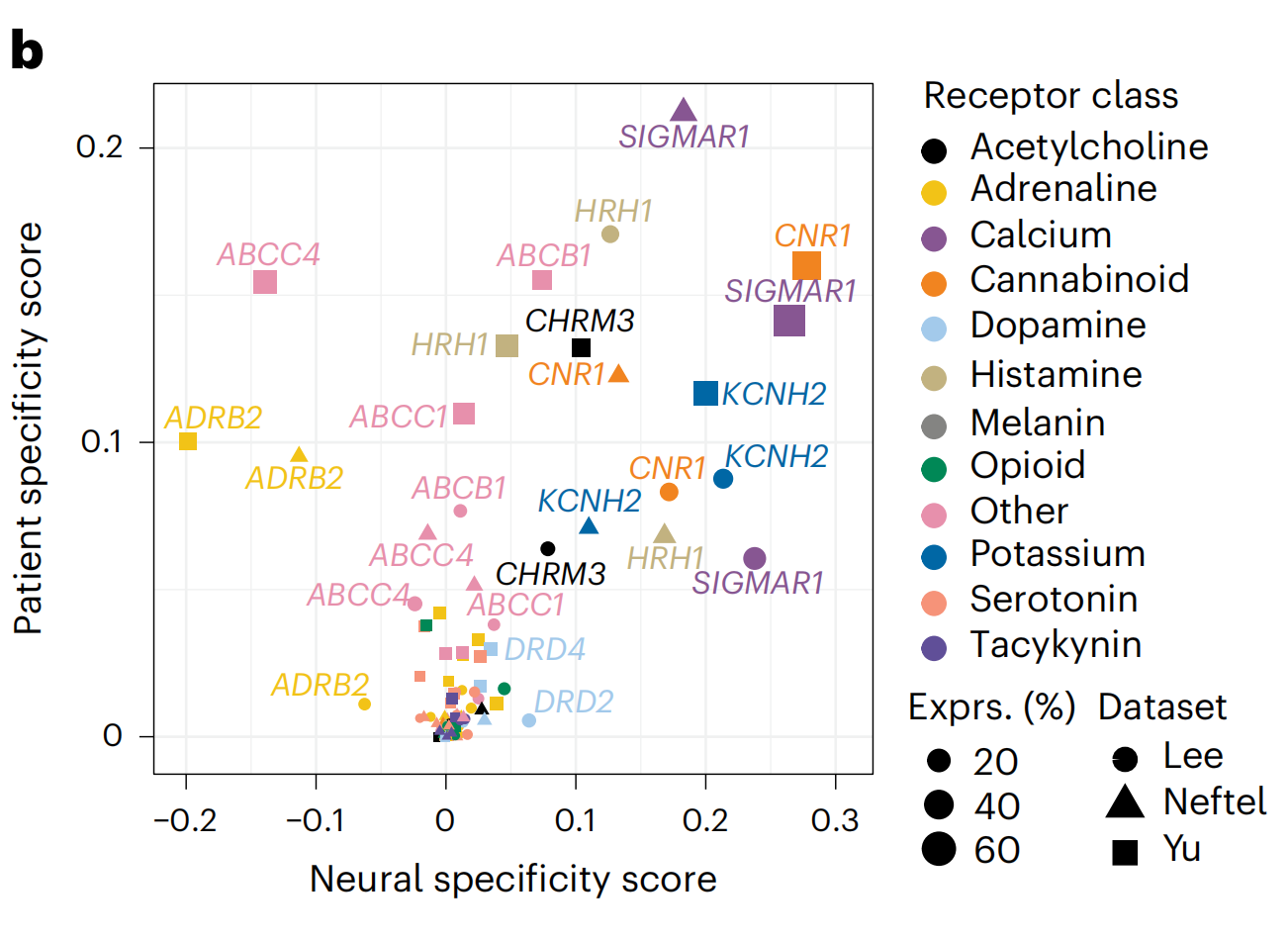
编码高神经特异性离子通道和受体的基因转录本包括钙信号调节器SIGMAR1和大麻素受体CNR1。尽管它们的检测水平相似,但它们的病人特异性却远低于致癌性RTKs EGFR和PDGFRA(图3c和补充表3),这突出了NAD靶点在胶质母细胞瘤中一致的泛病人表达。
作者通过在LN-229胶质母细胞瘤细胞中进行反向遗传筛选(n = 59个基因;图3d,扩展数据图4d和补充表4)来测试这些NAD PTG的依赖性,这些细胞具有与患者样本相似的PTG表达和NAD敏感性(图2g和3d)。
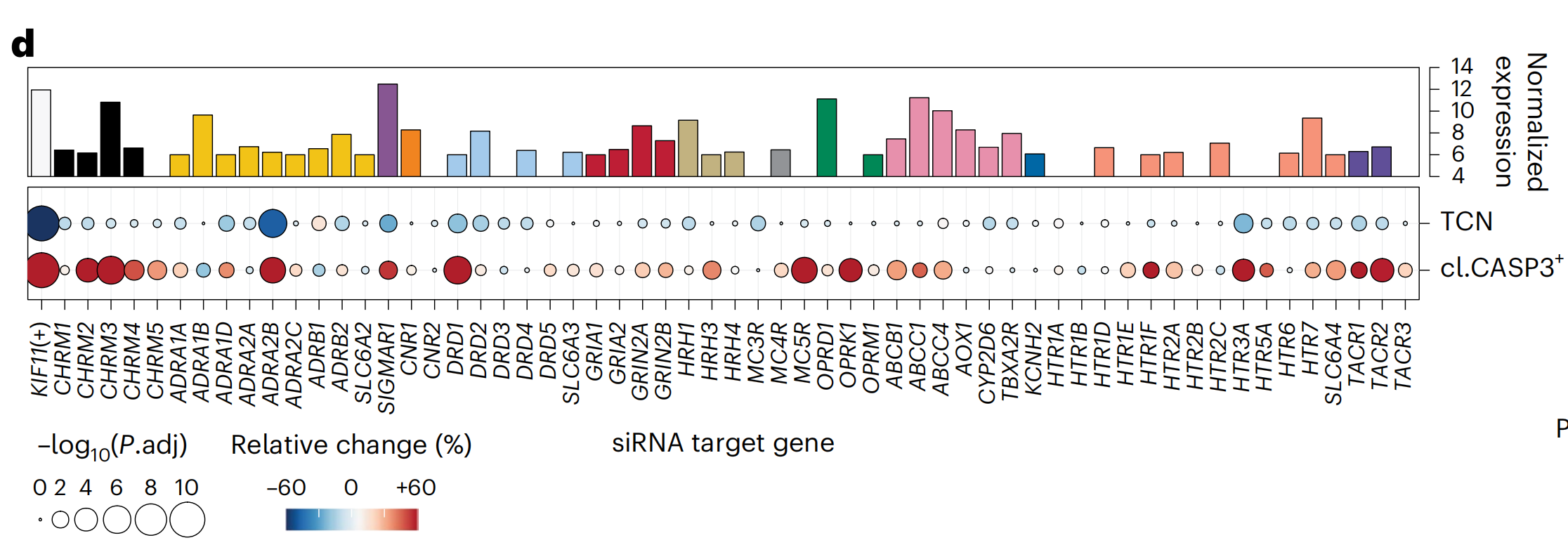
敲低九个PTG显著降低了细胞活力(图3d和扩展数据图4d),其中DRD1、DRD2、HTR3A和TACR1的表达水平较低也与The Cancer Genome Atlas(TCGA)胶质母细胞瘤队列中更好的患者生存相关(扩展数据图4e)。然而,这些PTG依赖性主要是由没有抗胶质母细胞瘤活性的NAD通过PCY靶向的。
例如,只有16种DRD1靶向的NAD中的5种,以及11种HTR3A靶向的NAD中的1种,是通过PCY筛选出的(图3e)。
因此,尽管可能存在神经脆弱性,但这些遗传PTG依赖性不太可能解释作者顶级NAD的抗胶质母细胞瘤活性。
2-4:药物-靶点网络汇聚预测NAD的疗效
尽管它们的化学结构和主要靶点多样性,顶级NAD可能汇聚于共同的下游信号通路。为了测试这一点,作者开发了一个可解释的机器学习方法,名为“收敛于二级药物靶点分析的正则化回归”(COSTAR)。COSTAR旨在识别最大化预测患者药物疗效的最小药物-靶点连接特征(方法)。
作者将药物-靶点搜索空间扩展到包括DTC(Drug Targets Commons)中任何生物活性注释的PTGs(扩展的主要靶基因;图4a)及其通过蛋白质-蛋白质相互作用(STRING数据库;图4a)的二级靶基因(STGs)。
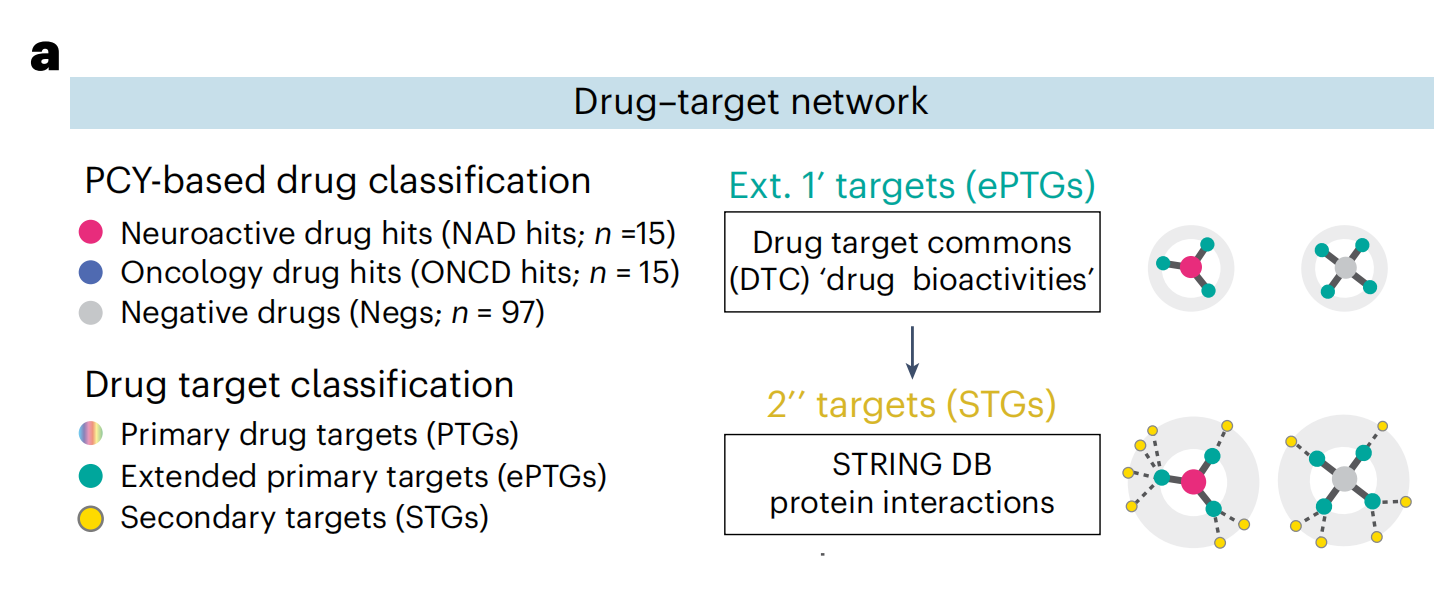
这导致了一个药物-靶点连接图,即“COSTAR星座”,包括作者NAD和ONCD库中所有DTC注释的药物(n = 127种药物)与975个ePTGs,10,573个STGs和114,517个边(图4b)。
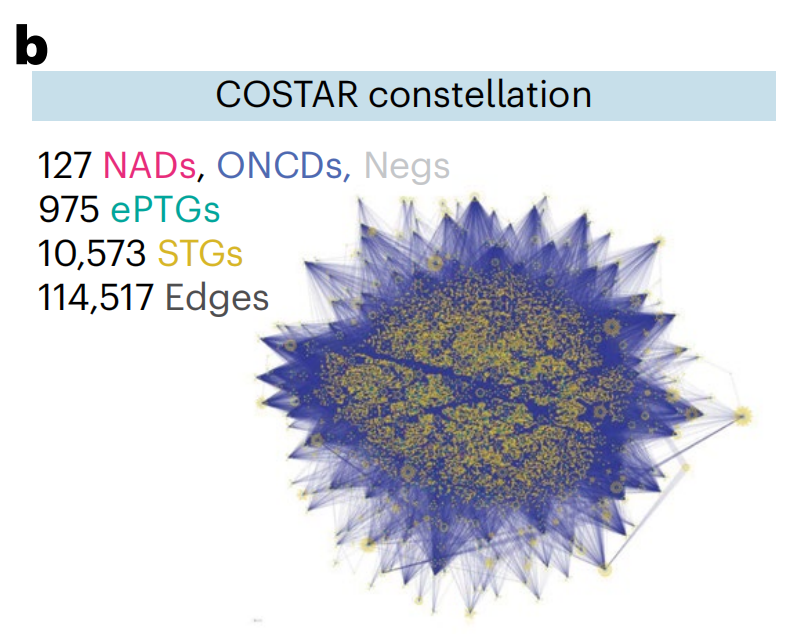
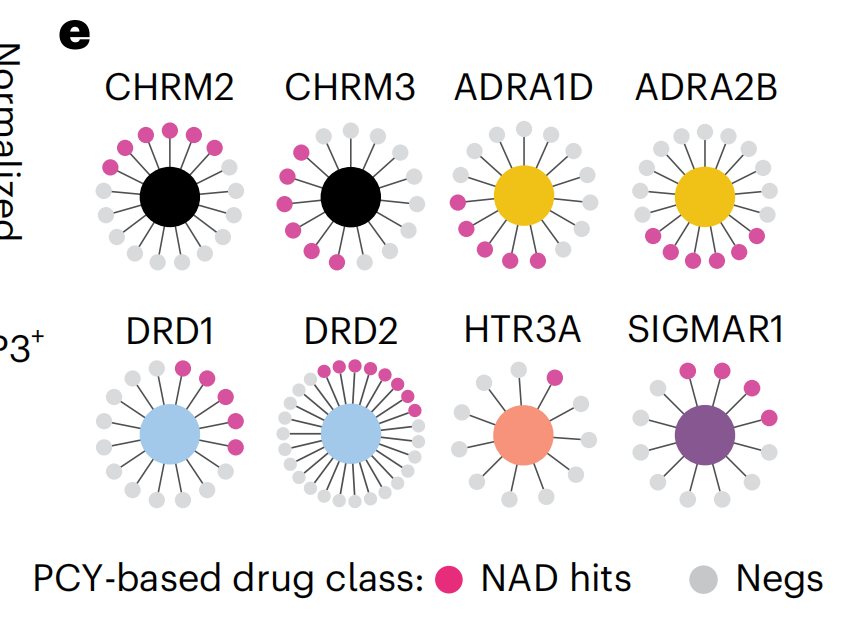
使用逻辑LASSO回归,作者训练了一个模型,该模型识别了最小的一组STGs,这些STGs在交叉验证设置中最大化区分PCY-hit药物(n = 30;来自两个药物库的前15种)和PCY-negative药物(n = 97种)(图4c和扩展数据图5a)。
因此,COSTAR汇聚了最小连接特征,该特征预测体外抗胶质母细胞瘤药物疗效(图4a–e和扩展数据图5a–c)。COSTAR确定的签名将127种药物分类准确率为92.1%,正确预测了30种PCY-hit药物中的20种和97种PCY-negative药物中的96种(图4d)。
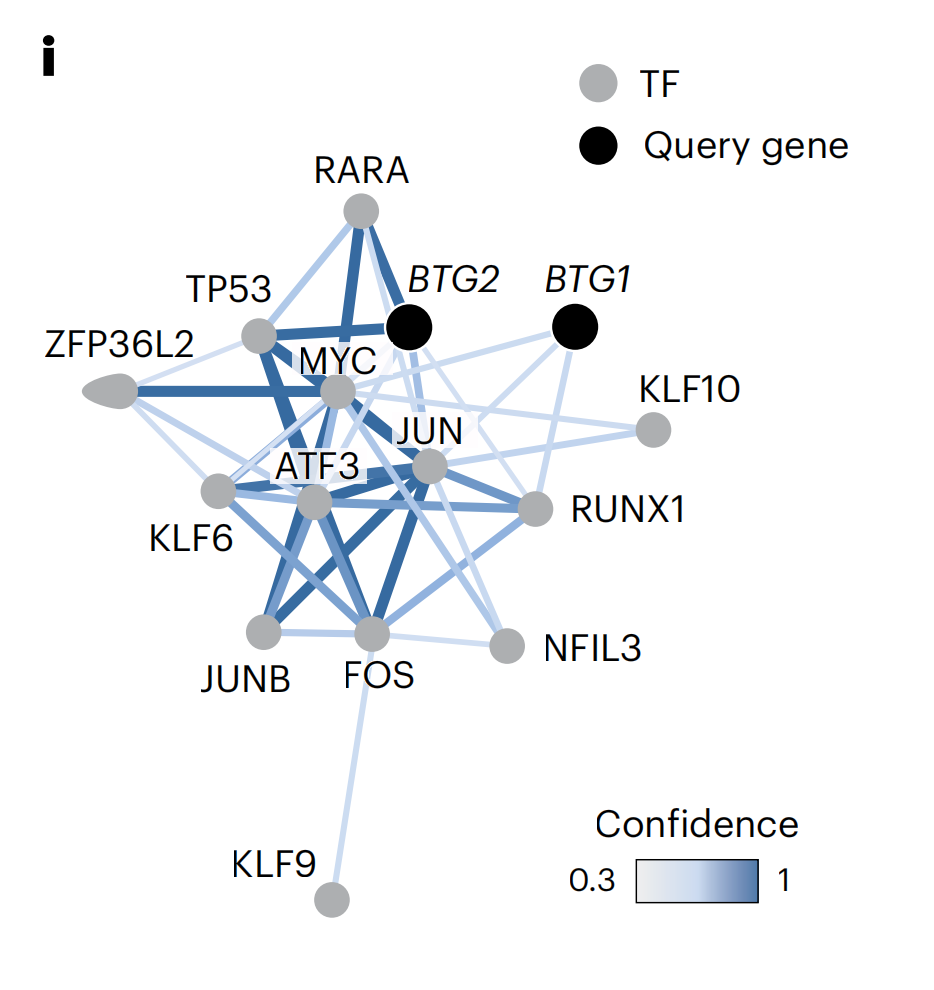
COSTAR连接特征将PCY-hit NADs与二级靶点BTG2联系起来,主要通过JUN和TP53 ePTGs(图4e和扩展数据图5b,c)。BTG2和TP53都是肿瘤抑制因子,控制细胞周期和分化,而JUN是AP-1转录因子家族的成员,在神经背景下,通过神经活动或损伤等刺激调节基因表达和凋亡42。
相反,大多数PCY-hit ONCDs都与二级靶点AP1S2相关,后者是一种参与扣囊蛋白衣组装的蛋白质,通过周期素G相关激酶GAK(图4e和扩展数据图5b,c)。总的来说,这揭示了AP-1 TFs和细胞周期调控作为预测NAD体外抗胶质母细胞瘤活性的独特标志。
COSTAR可以计算任何注释化合物的命中概率,通过将其药物-靶点特征与学习到的连接特征匹配。
为了评估COSTAR签名的预测能力并发现额外的NAD候选物,作者在虚拟环境中筛选了1,120,823个DTC注释的化合物,并在实验上验证了23个得分最高的化合物和25个得分最低的化合物(COSTAR-HIT和COSTAR-NEG,分别;图4f和补充数据2)。
其中,只有COSTAR-HIT与二级靶点BTG2相关,主要通过JUN(图4g,h)。作者在四个胶质母细胞瘤患者样本中测试了所有48种化合物,并观察到COSTAR预测与PCY评分之间有出色的吻合度(平均曲线下面积(AUC)=0.94;图4i,j)。
确认的COSTAR-HIT再次代表了不同的NAD类别,包括抗精神病药三氟哌嗪、抗帕金森病药异丙嗪和抗抑郁药舍曲林(图4i)。
这些结果证实了AP-1/BTG途径汇聚作为预测NAD体外抗胶质母细胞瘤活性的治疗标志。
2-5:药物诱导的神经生理学改变启动了抗增殖程序
COSTAR签名表明PCY-hit NADs的活动下存在一个共同的基因调控网络(GRN)。
为了证实这一点,作者测量了LN-229细胞对19种选择性药物在6小时和22小时的转录响应,通过DRUG-seq43(图5a–d,扩展数据图6a–g和补充表2)。
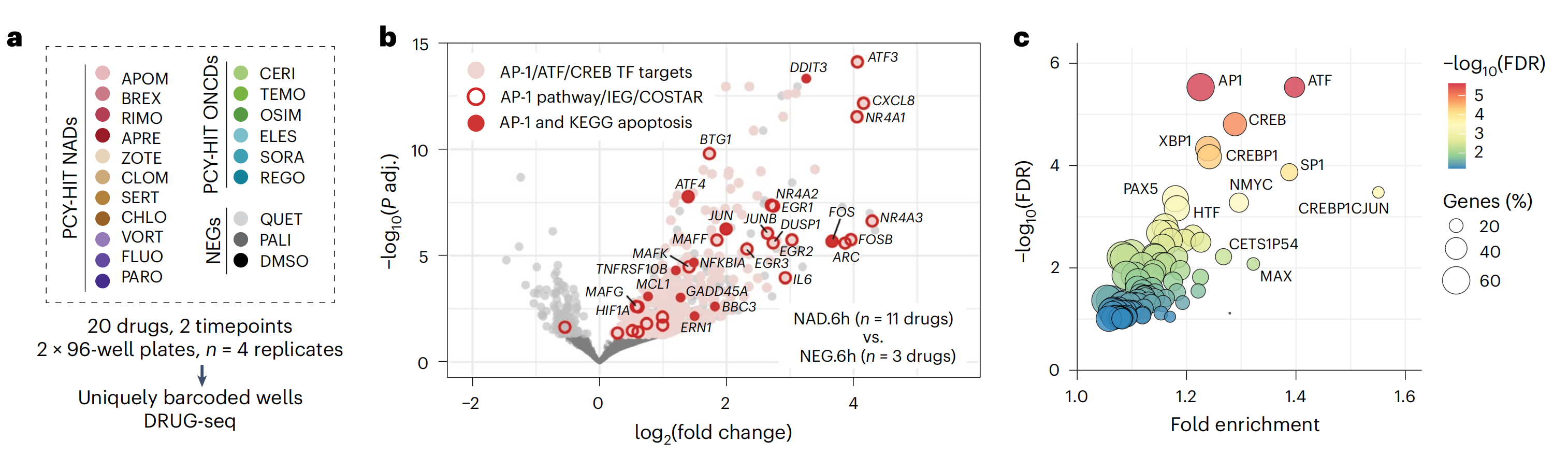
与COSTAR一致,差异基因表达分析揭示了由多种PCY-hit NADs诱导的共同AP-1和BTG签名(图5b,d和扩展数据图6c)。这涉及对八个AP-1转录因子(TFs)的快速和持续上调,包括即时早期基因(IEGs)JUN和c-FOS,这些基因已知可介导神经活动和凋亡42,44–46,以及应激诱导的AP-1 TFs ATF3和ATF4(图5b,d和扩展数据图6c)。
相反,下调的AP-1因子包括ATF5和ATF6B,这些因子分别促进胶质母细胞瘤细胞的生存和辐射抗性47,48,而与辐射反应相关的FOSL1在胶质母细胞瘤中没有上调(扩展数据图6e)。此外,上调的IEGs NR4A1, EGR1和ARC以及MAPK途径的富集进一步暗示了神经活动样信号(图5b和扩展数据图6d)。BTG1,BTG2的同源物,是上调最显著的前20个基因之一(图5b,d和扩展数据图6c),而BTG2在vortioxetine的刺激下特别上调(图5d)。
相反,测试的ONCDs,包括一线化疗药物TMZ,并未引发这种全局的AP-1/BTG响应(图5d和扩展数据图6c)。NAD诱导基因的转录因子结合位点(TFBS)富集分析在6小时揭示了AP-1, ATF和CREB,这是一个钙激活的AP-1转录调节器,在50%的上调基因中显著富集(图5b,c和扩展数据图6f)。在22小时,AP-1因子的表达得以维持,而叉头TF家族的motifs,已知可调节AP-1(参考51)之后的长时程细胞分化,在上调基因中富集(扩展数据图6f)。
AP-1激活和IEG表达通常在神经祖细胞中由钙依赖性信号引发44,50,52,53。因此,作者通过高通量的FLIPR assay测量了外钙流入和内质网(ER)钙库释放(n = 17–18种药物;补充表2)。
尽管测试的PCY-negative NADs和PCY-hit ONCDs均未触发钙流入,但八种PCY-hit NADs中的五种,包括抗抑郁药vortioxetine, paroxetine和fluoxetine,引发了立即且强烈的外钙流入,不涉及ER钙库释放(图5e,f和扩展数据图7a)。这些结果在PDC培养(P050.C;扩展数据图7b)中得以重现。
作者通过在四个PDC培养和两个细胞系上进行活细胞钙成像来描绘vortioxetine,最强的临床前候选药物,引起的单细胞钙动力学(n = 3,561个细胞;补充视频1)。在所有情况下,vortioxetine都强烈诱导钙流入(扩展数据图7c),而PDC培养显示出与最近体内观察到的相似的基线钙振荡(图5g和扩展数据图7d,e)21,23,24。vortioxetine增加了振荡胶质母细胞瘤细胞的百分比(图5g,h)并且对于基线振荡细胞,增加了它们的最大峰值振幅(在3/4的PDC线中)和平均峰值振幅(在2/4的PDC线中)(扩展数据图7f)。
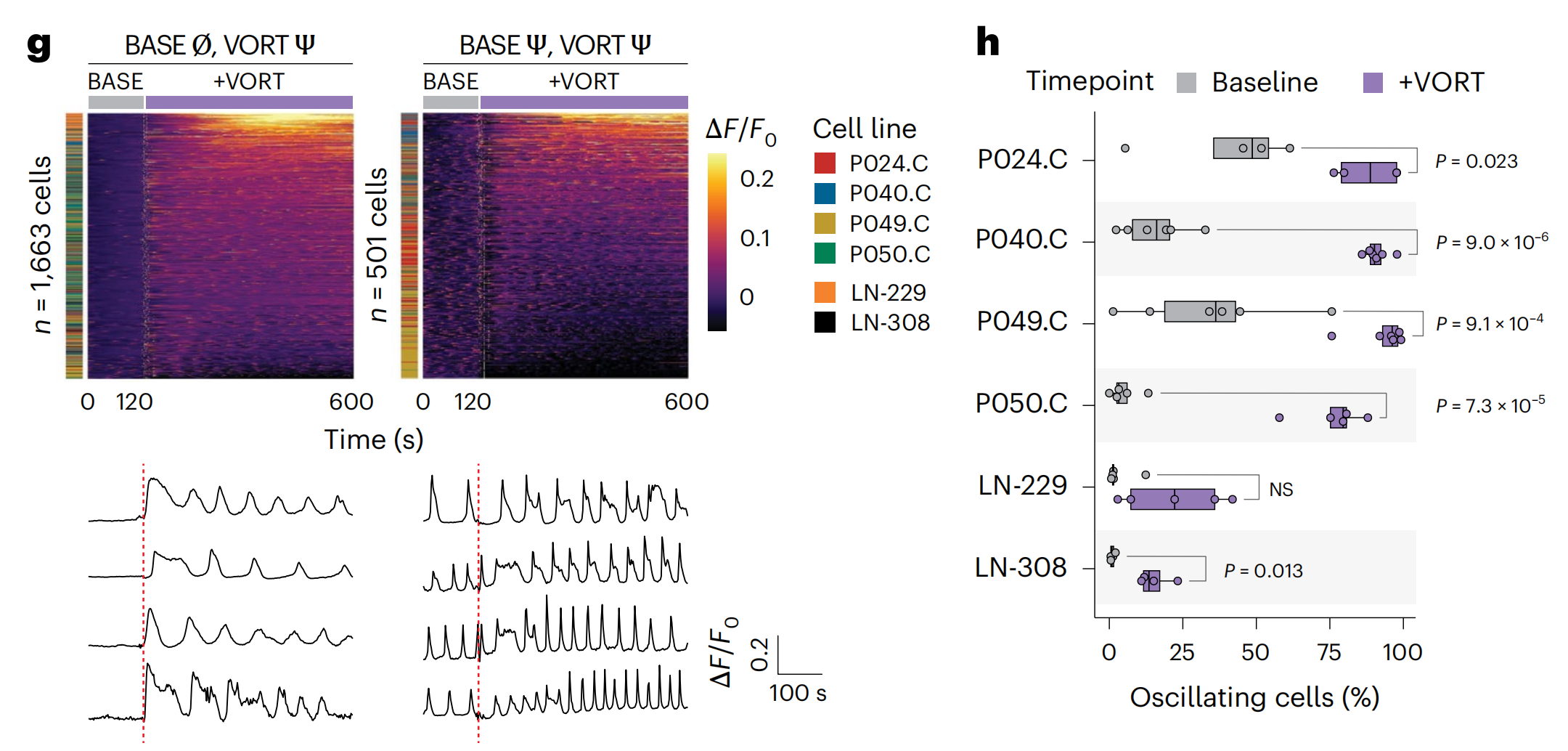
LN-229和LN-308线上的vortioxetine响应的电生理特征揭示了LN-229特有的静息膜电位的去极化(扩展数据图7g)以及在两线中电流-电压特性(I-V曲线)的显著变化(扩展数据图7i,j)。这些结果表明,NADs,特别是vortioxetine,迅速改变了胶质母细胞瘤的神经生理学,随后引发了IEG/AP-1的上调。
在AP-1上调之后,基因组范围的转录调控网络(PathwayNet)54映射识别出AP-1 TF家族成员直接介导BTG1/2肿瘤抑制基因的表达(图5i)。
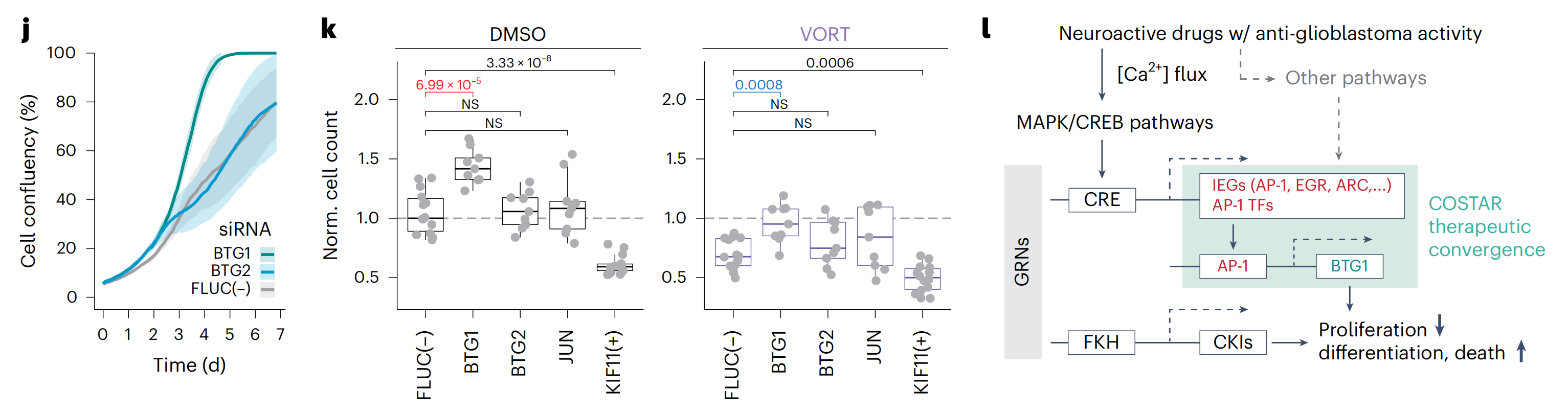
此外,COSTAR签名诱导程度与NADs体外抗胶质母细胞瘤疗效之间的强相关性提供了这种GRN因果作用的间接证据(R = 0.72, P = 1.4 × 10−5; 扩展数据图6g)。因此,作者进行了BTG1/2和JUN的失功能实验(图5j,k和扩展数据图7j),在确认敲低效率(扩展数据图7j)后进行。特别是BTG1敲低加速了LN-229细胞的生长,通过活细胞和终点成像测量(图5j,k和补充视频2)。
此外,vortioxetine治疗后基因沉默显示BTG1敲低减弱了vortioxetine的抗胶质母细胞瘤疗效(图5k)。因此,vortioxetine启动了一个包括AP-1/BTG驱动的肿瘤抑制的抗增殖程序(图5l)。
2-6:跨分子调控层稳健的AP-1诱导
为了表征vortioxetine的分子响应,作者在LN-229细胞中进行了深度转录组、蛋白质组和磷酸化蛋白质组分析,时间点为3-6(扩展数据图8a–f)。
vortioxetine治疗后迅速发生的NH-2端JUN磷酸化是几个差异磷酸化途径的中心,包括应激反应途径、mRNA处理和通过clathrin介导的内吞作用(扩展数据图8f)。一致地,多个AP-1 TFs、BTG1和相关途径,包括MAPK信号、ER应激和DNA损伤反应,在所有时间点上均上调了RNA和蛋白质水平(扩展数据图8a,c,e)。
相反,vortioxetine治疗下调了包括EGFR、NTRK2和PDGFRA在内的致癌性RTK(扩展数据图8a)。
接下来,作者在体外vortioxetine或DMSO处理3小时后对患者细胞进行了scRNA-seq,揭示了1,736个单细胞转录组中的四个细胞簇(患者P024;图6a,b和扩展数据图9a,b)。
簇1-3代表表达Nestin、Ki67、EGFR和VEGFA的胶质母细胞瘤细胞,其中簇1显示出最侵略性的签名和最高的推断细胞周期G2M阶段的比例(扩展数据图9c)。
分析vortioxetine处理引起的转录响应显示,推断的G2M阶段细胞减少(扩展数据图9c)并在患者细胞中确认了AP-1 TFs和效应基因的胶质母细胞瘤特异性诱导(图6b)。
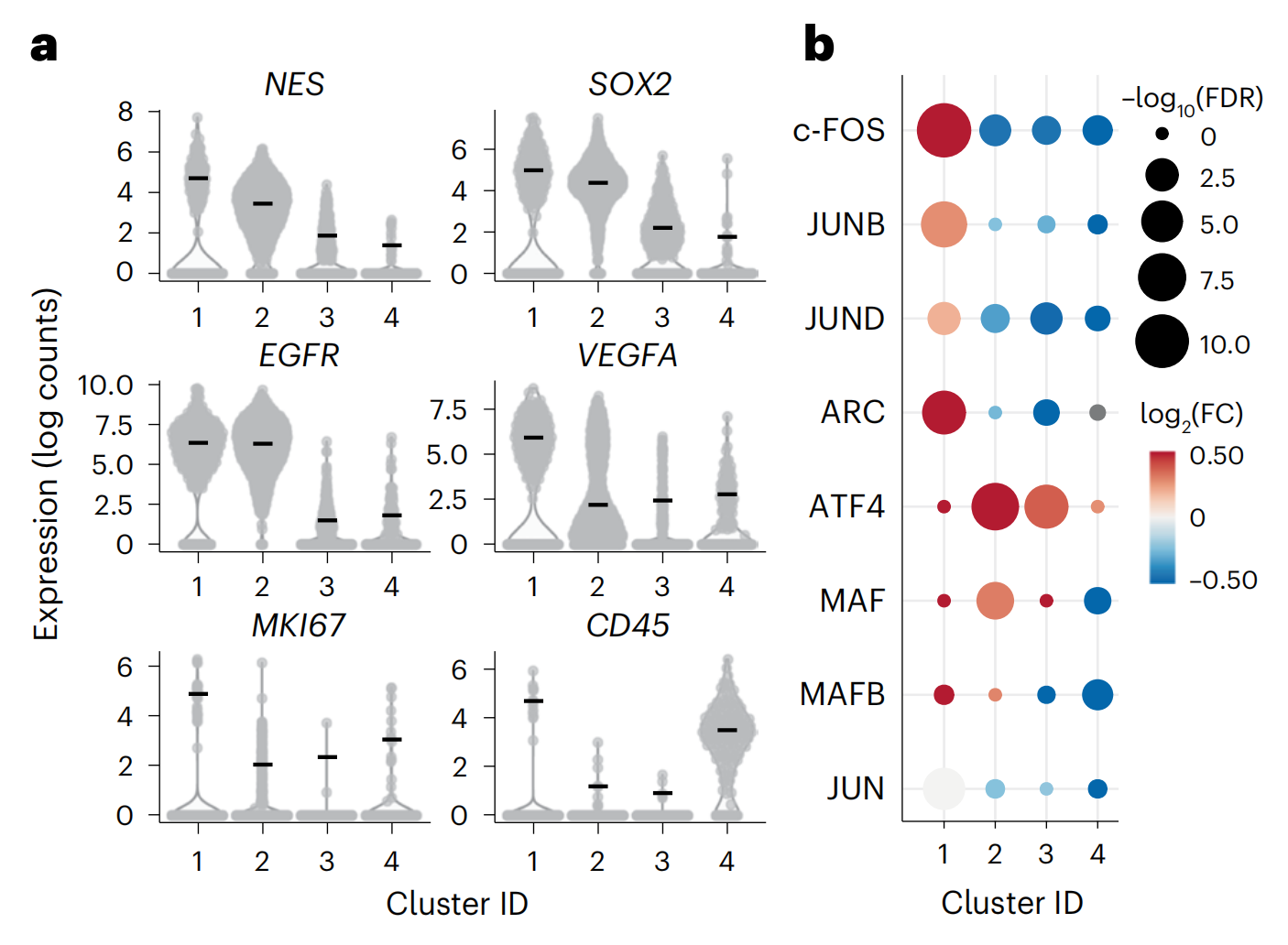
对患者样本中AP-1蛋白水平的vortioxetine响应进行了表征,发现患者反应的异质性与AP-1上调的程度相关(通过c-FOS、JUND、ATF4和AP-1效应因子HOMER1;图6c,d)。与scRNA-seq分析一致,AP-1诱导对胶质母细胞瘤细胞是特异的,而免疫细胞不表现出AP-1诱导,且基础AP-1表达较低(扩展数据图9d)。
因此,这种跨患者的单细胞分析确定了AP-1诱导作为vortioxetine疗效的预测指标,并验证了NADs在多种模式和患者异质性上对AP-1/BTG驱动的肿瘤抑制的胶质母细胞瘤特异性治疗汇聚。
2-7:抗抑郁药vortioxetine是最强的临床前候选药物
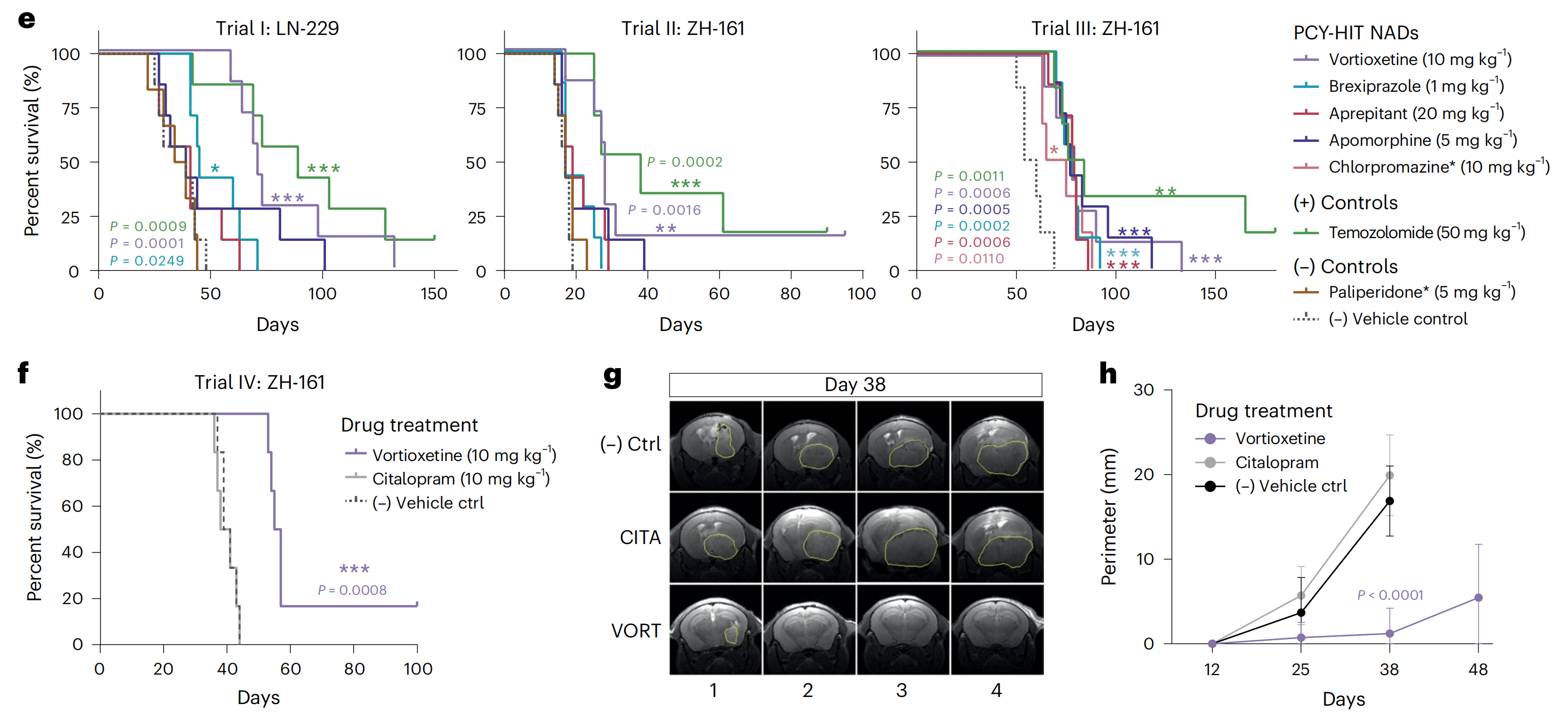
最后,为了评估作者顶级的NADs在体内的抗胶质母细胞瘤疗效,作者在两个不同的原位人异种胶质母细胞瘤小鼠模型(LN-229和ZH-161)中测试了跨越不同药物类别的PCY-hit NADs,进行了四个独立的前临床试验(试验I–IV;图6e–h和扩展数据图10a,b)。
标准护理TMZ被包括为阳性对照,而PCY-negative NADs paliperidone或citalopram和车辆被作为阴性对照。治疗剂量是基于文献和临床证据预先确定的。
vortioxetine在体内(在4/4的试验中)始终是最有效的PCY-hit NAD,显示出显著的生存优势,类似于TMZ(图6e,f)。此外,vortioxetine治疗显著降低了ZH-161移植小鼠在15天后通过磁共振成像(MRI)测量的肿瘤体积(试验II;扩展数据图10a,b),并且在体外显示了多方面的抗肿瘤效果:它降低了胶质母细胞瘤的生长、侵袭性和克隆生存能力,跨越2D和3D胶质母细胞瘤细胞系(扩展数据图10c–f)。
Brexpiprazole在体内(在2/3的试验中)是第二好的PCY-hit NAD,而其他NADs在单次试验中提供了显著的生存优势(图6e)。与作者体外PCY结果一致,阴性对照paliperidone(在2/2的试验中;图6e)和citalopram(单次试验;图6f)没有显示出生存优势。在直接剂量比较中,只有vortioxetine降低了Ki67水平,减少了肿瘤负担并增加了生存(图6f–h和扩展数据图10g,h)。
作者患者体外和小鼠体内的结果的一致性表明了PCY基础的NAD发现的高度可翻译性,并确认了vortioxetine作为最有前景的临床候选药物。为了准备其临床转化,作者进一步测试了vortioxetine与标准护理胶质母细胞瘤化疗药物TMZ或lomustine(CCNU)的组合在体内的疗效(试验V:ZH-161;图6i)。
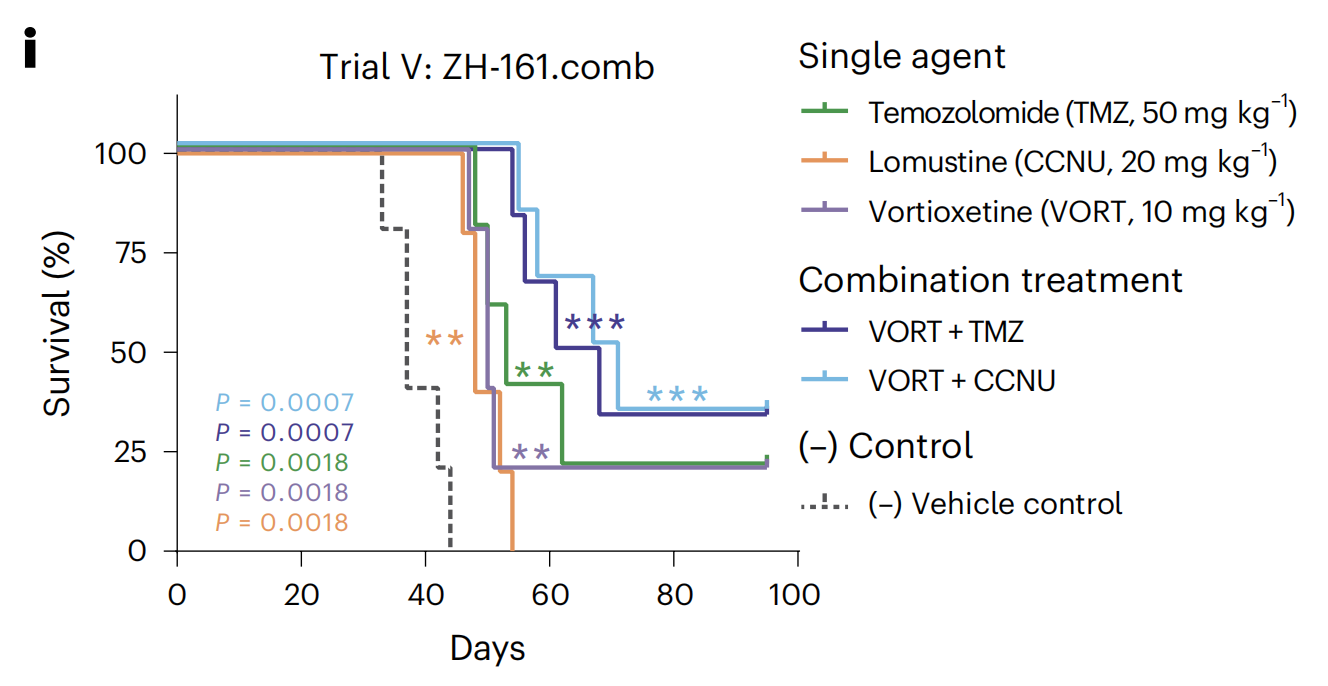
所有三种单药均显著延长了生存期,vortioxetine在五场试验中均得到了确认(图6e,f,i)。与TMZ或CCNU单药相比,vortioxetine与任何药物的组合提供了额外的20-30%的中位生存期增加,其中四只小鼠(25%)显示了长期生存(图6i)。
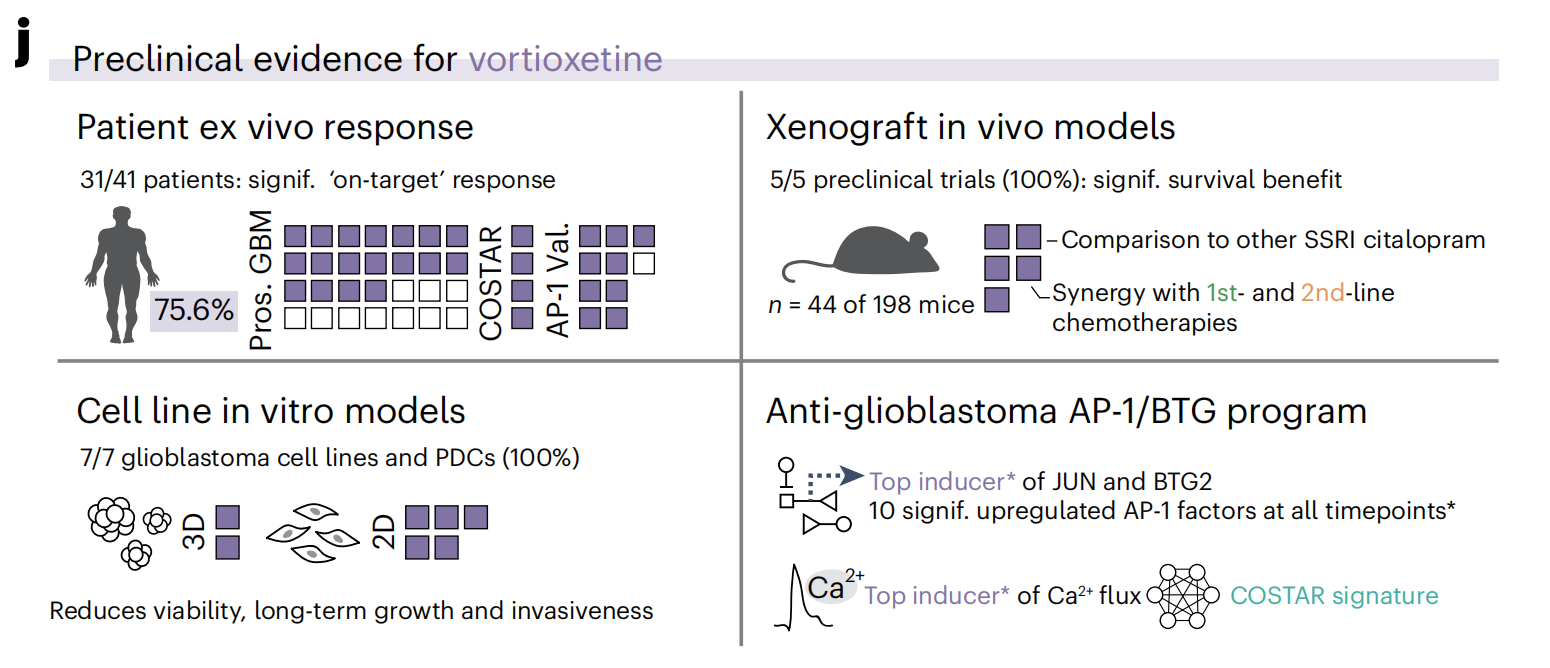
这些神经/化疗组合疗法增加的生存优势支持了神经活性AP-1/BTG肿瘤抑制与当前标准护理针对基因组完整性的靶向之间的机制互补性。最后,作者发现Ki67水平低且EGFR无改变的患者的体外vortioxetine治疗效果最差(扩展数据图10i),为这个强力的临床前候选药物提供了患者分层策略(图6j)。
三、讨论
在本研究中,作者展示了跨越患者样本的治疗性单细胞图谱,揭示了胶质母细胞瘤的分子NAD景观。
这一发现是由PCY在手术后不久对异质性患者队列进行的高通量功能评估所驱动的。与PCY先前成功用于指导血液癌症患者的治疗和功能精准医学社区日益增长的努力32,33,35,55,56一致,作者的结果表明,PCY可以作为一个药物发现和个性化治疗选择的平台,用于治疗困难的实体肿瘤。
作者前瞻性地测试了可重新利用的药物,扩大了对NADs57–59、患者来源的植入物27,38,39,60–62和分子预测因子响应的调查,以加速胶质母细胞瘤治疗候选物的临床转化。近实时的药物测试进一步解决了回顾性队列研究中偶然使用NADs的局限性,这些研究可能会受到处方时间和多种药物分组的影响。
扩大到更大的队列,并考虑胶质母细胞瘤病因的其他重要方面,包括代谢状态30,63、空间肿瘤组织64,65和神经元-胶质瘤界面18,21–23,25,将进一步巩固作者对患者异质性和治疗响应的理解。
尽管存在许多可能的神经脆弱性,作者的可解释的机器学习(COSTAR)识别了一个预测抗胶质母细胞瘤疗效的汇聚药物-靶点连接特征。
COSTAR有效地应用了奥卡姆剃刀原理,对集体生物化学药物-蛋白质-蛋白质相互作用网络进行了简化,提供了一个可能适用于其他癌症和药物发现努力的构想框架。使用COSTAR,作者通过深度多组学分析和功能遗传学,发现了NAD特异性的汇聚,通过AP-1活性介导BTG介导的肿瘤抑制。然而,导致AP-1上调的化学性质仍有待确定,多药理学机制可能对单个NAD的整合效应作出贡献。
以往的研究表明,神经元输入在调节胶质母细胞瘤生长的大脑-肿瘤界面中起着作用,突出了TME在调节肿瘤神经行为中的影响18,21–23,25。在本研究中,作者发现胶质母细胞瘤存在肿瘤内在的神经脆弱性,提供了一个治疗窗口,允许直接靶向肿瘤神经生理学,独立于神经元输入。
在癌症中,AP-1因子最初被发现的是一种原癌基因,尽管越来越多的研究表明AP-1因子的上下文依赖性抗肿瘤功能。相比之下,对于神经元和其他神经祖细胞,IEG表达的AP-1因子通常是神经活动或损伤的标志42,44–46。
在胶质母细胞瘤细胞背景下,作者现在报告说,不同的NADs——特别是抗抑郁药vortioxetine——靶向这种神经活动样信号,触发强烈的神经生理和转录响应,导致胶质母细胞瘤细胞迅速死亡。vortioxetine的效力在不同模式下得到了独立证明,在75%的患者中观察到了靶上体外疗效(图6j)。
未来,vortioxetine与标准护理化疗药物的组合应在受控的临床试验中进行测试,可能由分子或功能性的患者分层指导。根据癌症的细胞历史和谱系,以及其不稳定的转化状态,对胶质母细胞瘤进行定制治疗,为这种毁灭性疾病提供了希望。