DNA修饰和甲基化是理解基因调控机制的关键。以往,我们的经验表明,使用三代测序从未经扩增的长DNA模板中同时读取序列信息和碱基修饰,需要投入大量的DNA样本来构建文库。
今天,小编带大家看一篇2024年发表于《Nature Genetics》的文章,这一技术结合了PacBio HiFi测序和Tn5转座酶,展示了其在低投入DNA条件下进行高灵敏度、多模式单分子测序的卓越能力。

研究背景
第三代单分子测序技术具有精确性和多模态性的优点。然而,PacBio测序技术在PCR free的文库制备时,面临一个关键挑战:需要较高的起始DNA量。通过使用Tn5转座酶对测序模板DNA片段进行转座(即标签化),能够显著降低对输入DNA量的需求,并简化了整个工作流程。
主要结果
1. SMRT-Tag技术的原理及其优异表现
选择了一种三突变体Tn5酶(以下简称 Tn5),它允许对片段大小进行浓度依赖性控制。用定制的寡核苷酸加载Tn5,其由发夹 PacBio 接头和组装转座体所需的嵌合末端序列组成。研究利用Tn5转座酶在一定温度下对DNA进行片段化来制备低起始量的单分子PacBio测序文库。单分子实时测序通过SMRT-Tag方法,可以检测基因组变异和CpG甲基化。
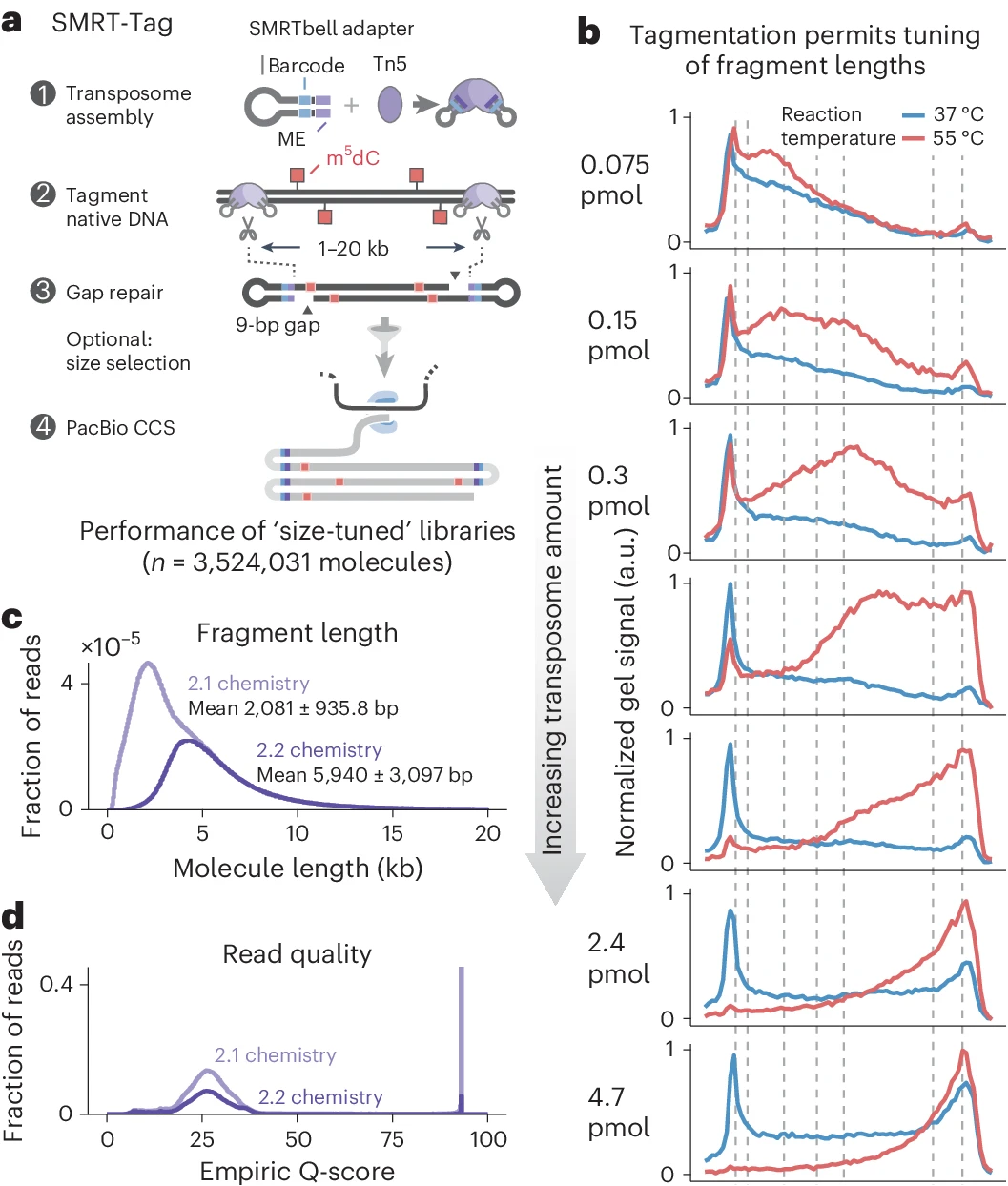
图1 片段化使可调和灵敏的单分子实时测序成为可能
PacBio HiFi测序(SMRT-Tag)可从低至40 ng gDNA(约7,000个人类细胞)中检测出遗传变异和CpG甲基化,其准确性与常规全基因组和亚硫酸盐测序相当。与传统方法相比,SMRT-Tag方法降低了90-99%的起始DNA用量。
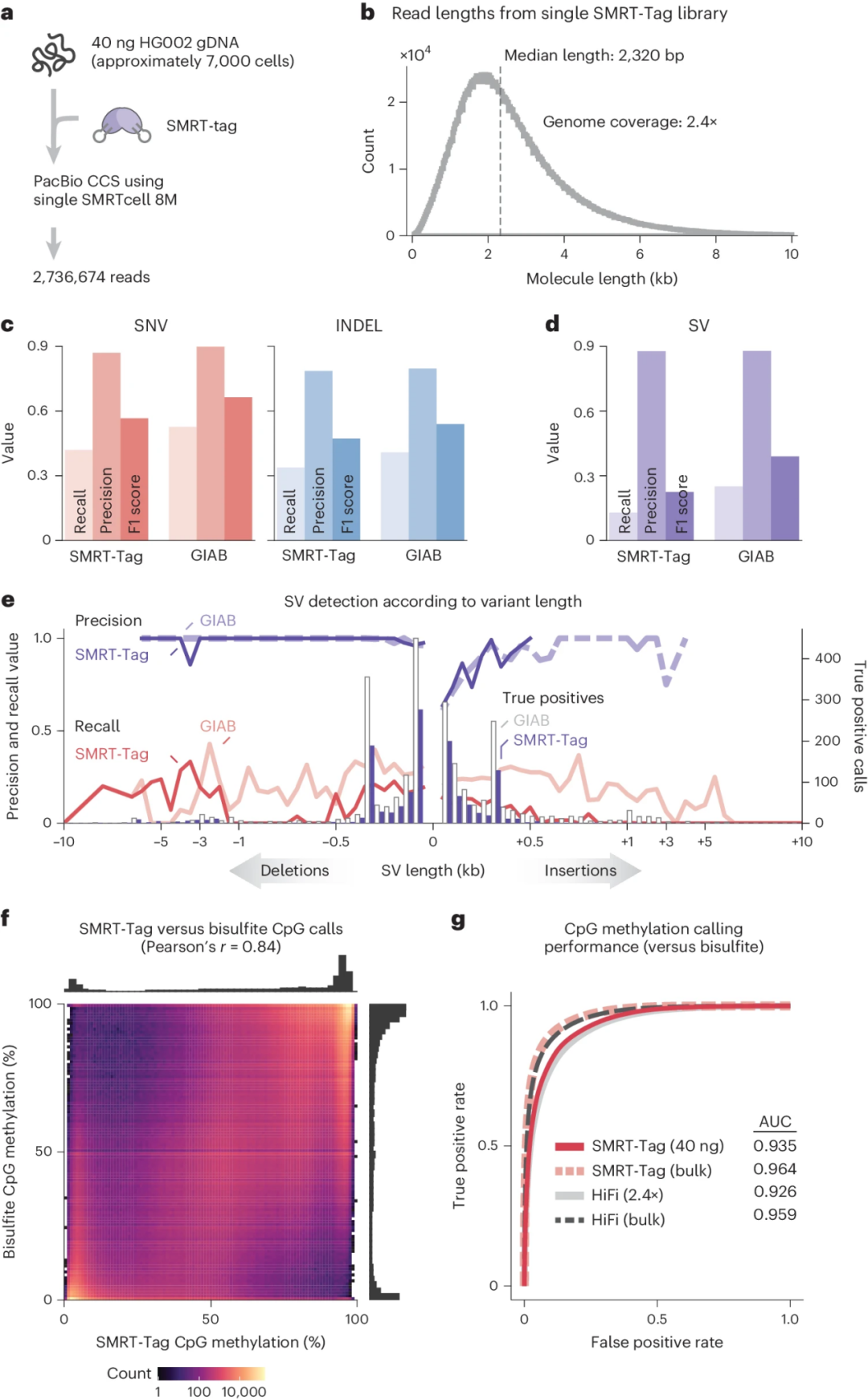
图2 SMRT-Tag能够对低起始量样品进行准确的基因分型和表观基因分型
2. SAMOSA-Tag技术的原理及其优异表现
单分子腺苷甲基化核小体测序通过SAMOSA-Tag方法,利用外源性腺苷甲基化作为第三信号通道探测染色质可及性。使用非特异性EcoGII m6dAase对细胞核进行甲基化并用发夹加载的转座体原位标记。DNA 被纯化、间隙修复和测序,获得m6dA标记的代表纤维可及性和计算定义的非甲基化“足迹”捕获的蛋白质- DNA相互作用。
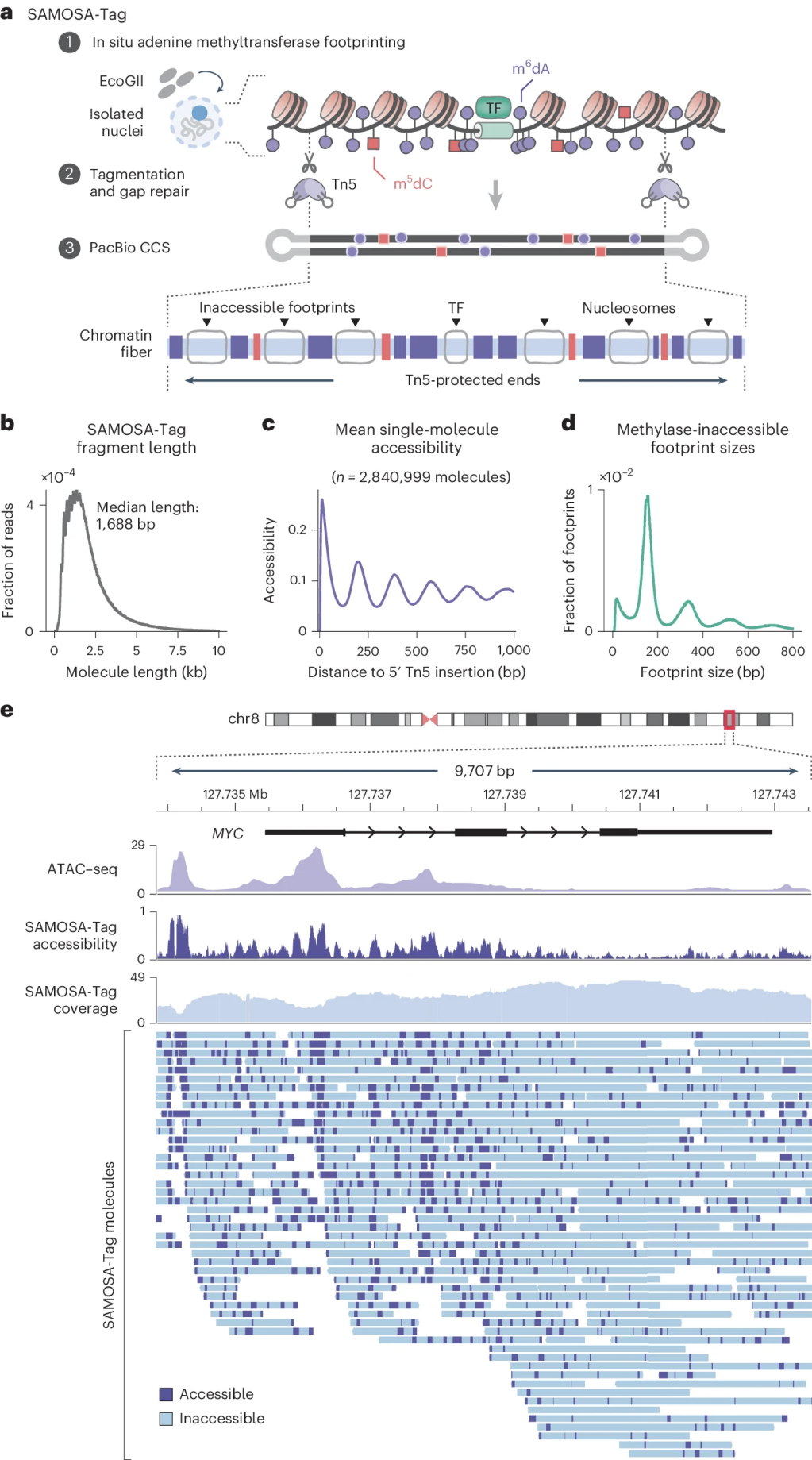
图3 SAMOSA-Tag:通过标记腺嘌呤甲基化细胞核进行单分子染色质分析
SAMOSA-Tag生成了DNA序列,CpG甲基化和单分子染色质可及性数据。小鼠ES细胞与之前对人类细胞中活性启动子和异染色质的体内观察结果一致,提示这些结构域内保守的单纤维染色质结构。
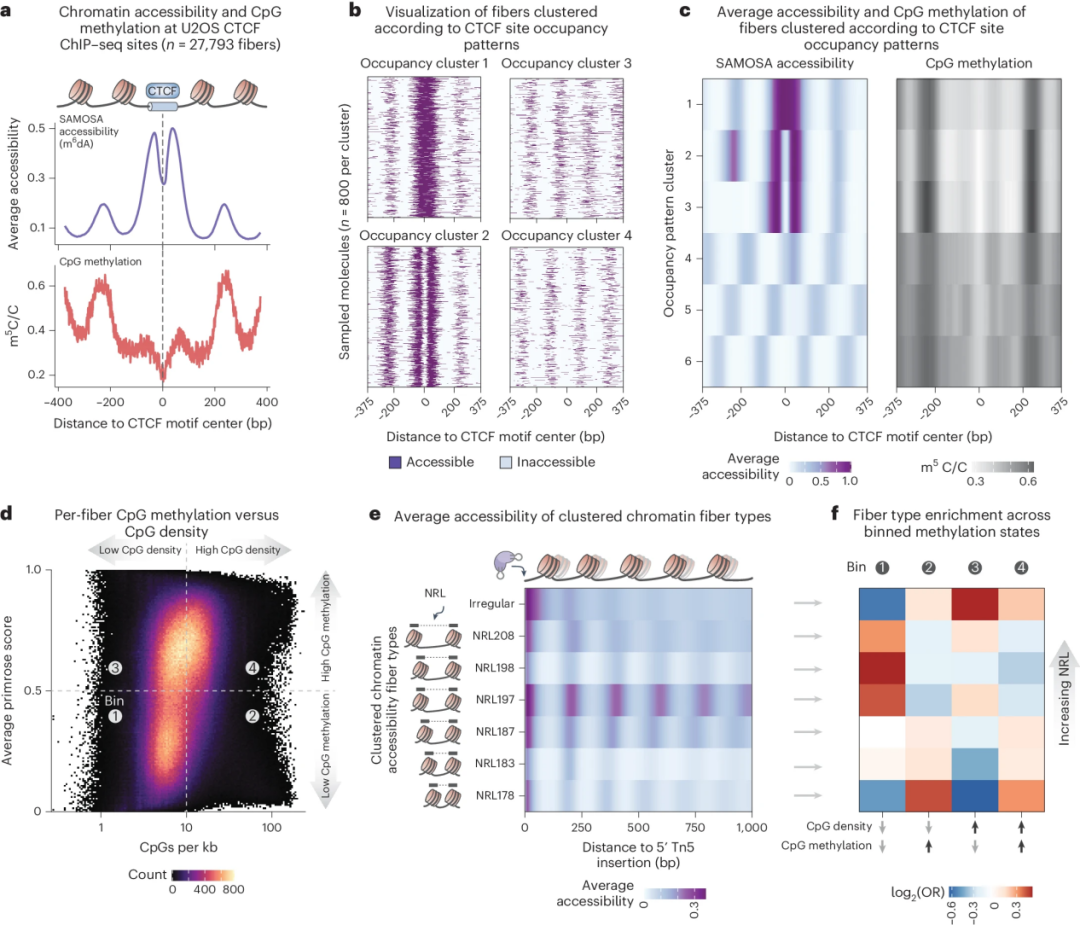
图4 SAMOSA-Tag同时描述了单个染色质纤维上的蛋白质-DNA相互作用和CpG甲基化
利用SAMOSA-Tag测序,解析了骨肉瘤细胞中的CTCF结合,核小体结构和CpG甲基化,揭示了与技术上具有挑战性的前列腺癌PDX细胞转移进展相关的整体染色质失调。
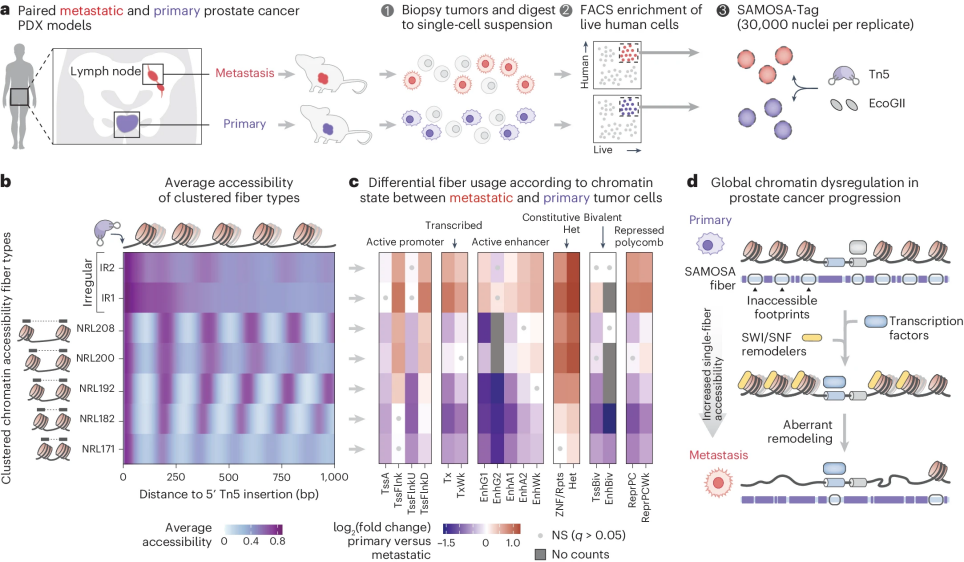
图5 前列腺癌患者PDX(患者来源的异种移植)的 SAMOSA-Tag 提示在前列腺癌转移过程中全局染色质失调
结论与意义
本研究优化了 Tn5 转座,作为从有限量的起始 DNA 制备无扩增、多重检测的 PacBio 文库的一般策略。应用这一原理开发了两种方法,利用HiFi测序同时读取修饰和未修饰的碱基,实现了单分子表观基因组分析,突出了基于Tn5的PacBio文库生成的广泛潜力。
总之,这两种tagmentation方法大大降低了PacBio单分子测序所需的起始DNA量,使得对稀有细胞群体、单细胞和微生物等进行高灵敏度的基因组和表观基因组分析成为可能,在基础和临床研究中具有广阔的应用前景。
参考文献
Nanda, A.S., Wu, K., Irkliyenko, I. et al. Direct transposition of native DNA for sensitive multimodal single-molecule sequencing. Nat Genet (2024).