小罗碎碎念
这篇文章是关于肝内胆管癌(intrahepatic cholangiocarcinoma, iCCA)中三级淋巴结构(tertiary lymphoid structures, TLSs)的分布、密度及其对临床结果的预测价值的研究。

| 作者类型 | 作者姓名 | 单位名称(中文) |
|---|---|---|
| 第一作者 | Guang-Yu Ding | 复旦大学中山医院肝外科及肝移植中心 |
| 第一作者 | Jia-Qiang Ma | 同上 |
| 第一作者 | Jing-Ping Yun | 中山大学肿瘤防治中心 |
| 通讯作者 | Qiang Gao | 复旦大学中山医院肝外科及肝移植中心 |
| 通讯作者 | Mu-Yan Cai | 中山大学肿瘤防治中心 |
| 通讯作者 | Yong Zeng | 四川大学华西医院肝脏外科及肝移植中心 |
文章的主要发现和结论
-
TLSs的分布和密度:研究发现,肿瘤内(intra-tumor)和肿瘤周围(peri-tumor)的TLSs对iCCA患者的预后影响相反。肿瘤内的TLSs与较好的预后相关,而肿瘤周围的TLSs则与较差的生存率相关。
-
TLSs的异质性:TLSs在不同的TLSs中表现出异质性,这可能是由于不同TLSs内存在不同的免疫细胞亚群,如T辅助细胞(Tfh)和调节性T细胞(Treg)。
-
TLSs的成熟度:研究还观察到,肿瘤内的TLSs成熟度更高,具有更多的生发中心,而肿瘤周围的TLSs则多为未成熟的淋巴细胞聚集。
-
免疫亚类:基于TLSs的分布和密度,研究者将iCCA患者分为四个不同的免疫亚类,这些亚类具有不同的临床结果。其中,表现出免疫活跃模式的患者预后最好,而免疫排斥模式的患者预后最差。
-
预后价值:研究通过Cox回归和Kaplan-Meier分析,发现TLSs的分布和密度与iCCA患者的总体生存率(OS)显著相关,并且这种相关性在内部和外部验证队列中得到了验证。
-
临床意义:文章提出,TLSs的分布和密度可以作为iCCA预后的有用免疫分类,并且Tfh和Treg细胞可能在决定空间不同的TLSs的功能取向中发挥关键作用。
一、引言
肝内胆管细胞癌(iCCA)是继肝细胞癌之后第二常见的原发性肝脏恶性肿瘤,全球范围内其发病率和死亡率均在上升[1,2]。
目前针对iCCA的治疗手段疗效有限,尽管术后复发率极高,但手术仍是唯一的治愈性选择[3,4]。
iCCA具有异质性特征,因此需要个性化的治疗策略[5]。广泛的分子研究表明,已尝试识别iCCA亚型,并揭示了免疫微环境在iCCA进展中的决定性作用[6–9]。
因此,直接对免疫背景进行表征可能为深入了解这种恶性肿瘤提供更多见解。通常,大多数iCCA被归类为免疫“冷”肿瘤,缺乏效应免疫细胞,而只有少数被认为是T细胞浸润的免疫“热”肿瘤,这些肿瘤可能对免疫检查点阻断疗法有响应[7]。
近期,肿瘤相关三级淋巴结构(TLSs),作为次级淋巴器官的类似物,受到了广泛关注[10,11]。
TLSs是局部抗原呈递和淋巴细胞分化的优势位点,因此为针对癌症的细胞和体液免疫反应提供了重要的微环境[12]。实际上,肿瘤内TLSs的存在与大多数实体瘤的良好预后和对免疫治疗的改善反应相关,尽管也存在一些相矛盾的结果[13–16]。然而,TLSs在iCCAs中的预后价值和临床相关性尚不明确。
为了填补这一知识空白,本研究利用来自中国东部、西部和南部3个癌症中心的4个独立患者队列,全面评估了iCCAs中TLSs的空间分布、丰富度和组成。建立并验证了一种新的TLS评分系统,用于量化不同解剖亚区域(肿瘤内、侵袭边缘和肿瘤周围)TLSs的丰富度,揭示了肿瘤内和肿瘤周围TLSs相反的预后作用。
通过多重免疫染色确定了TLSs的异质细胞组成,以解释其相反的预后价值。通过结合肿瘤内和肿瘤周围TLS评分,iCCAs可以被分为4个免疫亚类,其预后存在显著差异。
二、患者与方法
2-1:研究人群与病理评估
本研究纳入了来自中国3个肝癌中心的4个独立iCCA队列(队列D、V1、V2和V3),共计962名患者。
发现队列(队列D)包括371名在2010至2015年间于复旦大学附属中山医院(上海,中国)接受手术切除的iCCA患者。内部验证队列(队列V1)包括300名在2004至2009年间在同一医院接受手术切除的iCCA患者。队列V2和V3均为外部验证队列。队列V2包括180名在1999至2013年间于中山大学肿瘤防治中心(广州,中国)接受手术切除的患者,队列V3包括111名在2014至2018年间于四川大学华西医院(成都,中国)接受手术切除的患者。
所有患者均经病理证实为iCCA并接受了根治性切除。排除了肝门或肝外胆管细胞癌以及混合型原发性肝癌患者。患者在手术前或随访期间未接受任何分子靶向或免疫治疗。该研究得到了机构伦理委员会的批准,并在手术前获得了使用手术标本及相关临床数据的知情同意。
每个患者的病理H&E切片被扫描为全切片图像(WSIs),包括肿瘤和邻近周围肝脏的组织。除了常规病理评估外,根据既定标准[17]识别每张切片的组织坏死存在与否,并记录为阴性(坏死区域<5%)或阳性(坏死区域>5%)。
2-2:TLSs的表征与量化
TLSs在WSIs上由训练有素的观察者根据形态学检测,如前所述[18]。
根据成熟阶段,TLSs可分为淋巴聚集物(Agg)和淋巴滤泡(Fol);Fol可进一步细分为Fol-I(无生发中心的淋巴滤泡)和Fol-II(有生发中心的淋巴滤泡)。
因此,可以根据肿瘤内TLSs的成熟阶段(TLS成熟类别)将iCCAs分类为TLS阴性iCCA(无肿瘤内TLSs的肿瘤)、Agg iCCA(仅含Agg的肿瘤)和Fol iCCA(至少含有一个Fol,可伴有或不伴有Agg的肿瘤)。相应地,Fol iCCA可进一步分为Fol-I iCCA和Fol-II iCCA。
为了确定TLSs的空间分布,每个WSI被划分为3个亚区域:
- 肿瘤内(T)
- 侵袭边缘(IM,肿瘤与周围肿瘤界面两侧各500微米宽[19])
- 肿瘤周围(P)区域
作者观察到不同亚区域内TLSs的排列异质性和丰富度变化。因此,为每个亚区域建立了TLS评分系统以量化这些特征。
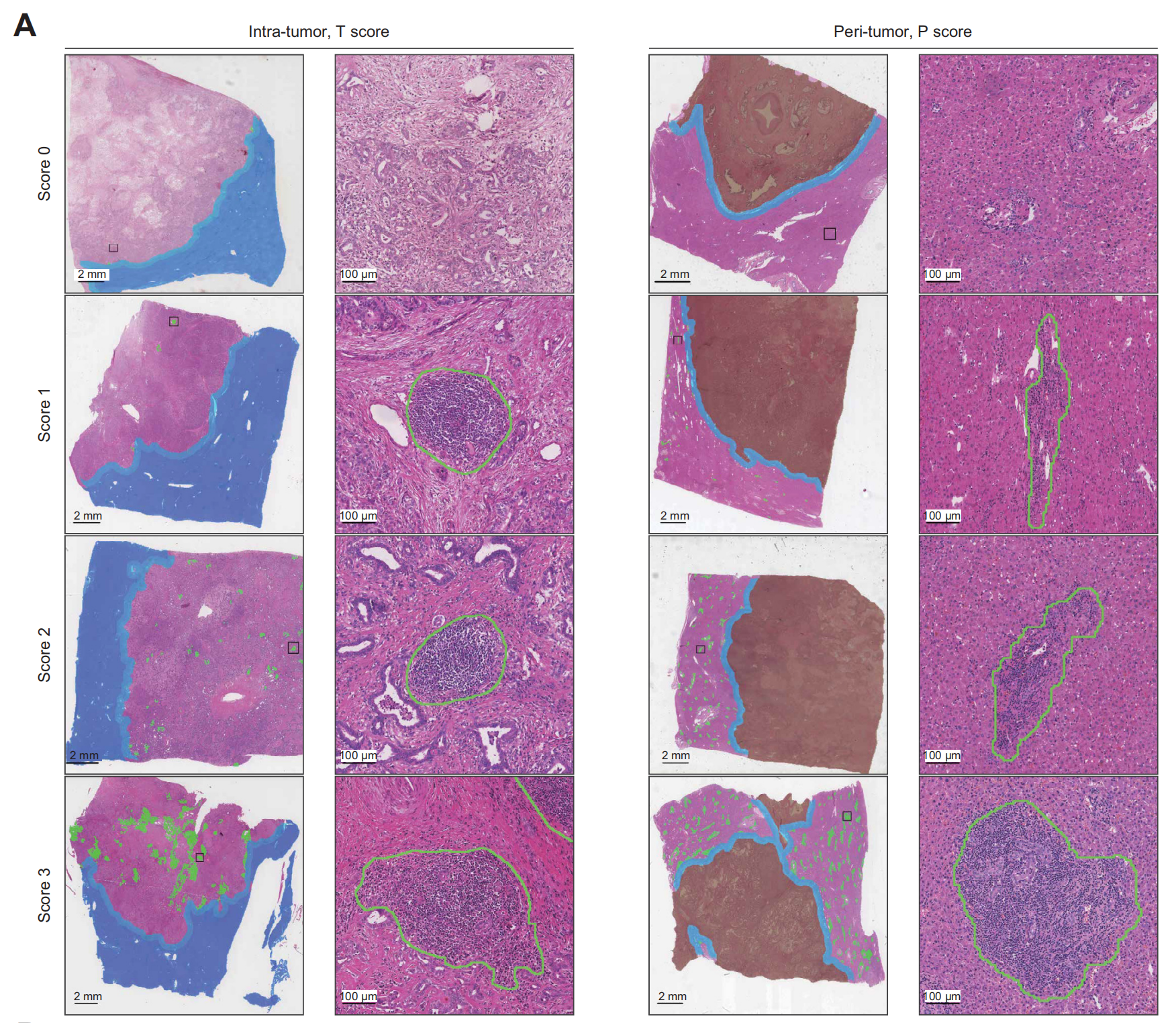
T区域内的TLS丰富度(T分数)可分为4类:
(a)分数0表示T区域内无TLS,相当于TLS阴性iCCA;
(b)分数1代表T区域内有1或2个TLS;
(c)分数2表示T区域内至少有3个TLS但不满足分数3的标准;
(d)分数3代表T区域内有大量TLS且相互汇聚。
类似地,P区域内的TLS丰富度(P分数)通过另一个四分类标准进行评分:
(a)分数0代表P区域内无典型TLS;
(b)分数1表示TLS分布在P区域的一个局部区域(小于50%);
(c)分数2表示P区域的大部分(超过50%)有TLS分布;
(d)分数3代表P区域内有大量TLS(涵盖整个P区域)且相互汇聚。
IM区域内的TLS丰富度(IM分数)通过补充方法和图S1B中详细描述的三级系统进行评估。值得注意的是,评估中包括了不同成熟阶段的TLSs,但排除了坏死区域中的粒细胞。
图1A展示了肿瘤内和肿瘤周围TLS评分系统的代表性WSIs。
为了确保评分系统的准确性和稳健性,作者准备了一个带有预定TLS分数的训练队列作为观察者的标准化教程,并在训练队列中实现了观察者之间的高度可重复性(图S1C,D,表S1)。
此外,作者手动标注了训练队列中每个WSI的亚区域和TLSs,从而使得计算机能够计算TLS分数(TLS区域/评分亚区域面积)。结果显示作者的评分系统准确地反映了TLSs的丰富度(图S1E,F)。关于TLS评分系统的扩展信息包含在补充方法中。
然后,每个病例不同亚区域的TLS分数由两名对临床和预后数据不知情的观察者进行评分,并显示评分者之间的高度一致性(图S1G-J,表S1)。如果分数不一致且有疑问,则使用第三名观察者达成共识。在队列D和V1中,一些病例有多个WSIs可用,观察到轻微的切片间评分差异。对于这些病例,记录所有切片中最常见的分数作为最终分数;如果不同分数的切片数量相等,则采用较高的分数。
2-3:多plex免疫组织化学、全外显子测序及数据分析
为了探究空间上不同的TLSs的细胞组成,进行了多plex免疫组织化学(mIHC)检测,具体方法如前所述[20],详细信息包含在补充方法中。
一抗分为3个panel:CD3、CD8和CD20;CD68、CK19和PDL1;CD4、Foxp3和Bcl6(表S2)。使用PerkinElmer Vectra3®平台对切片进行成像和扫描。通过PerkinElmer Inform软件选择并批量分析TLSs,确定每个标志物的阈值值,并通过Inform Score进行标识,该分数可根据得分图和原始染色图像调整截断值。
对于含有多个TLSs的亚区域,每个免疫亚群的密度或频率被平均以代表细胞组成。使用R脚本对阳性染色细胞进行量化,具体方法如前所述[20],详细内容在补充方法中。
此外,作者还初步探讨了高发生率突变与TLS浸润的相关性,使用来自另一项原则上接受的研究(Dong et al., Cancer Cell 2021)的全外显子测序数据。在这个独立的iCCA队列(n=262)中,识别了反复出现的遗传改变(包括FGFR2融合、IDH1、IDH2、KRAS、TP53、ARID1A、BAP1、EGFR、EPHA2、PBRM1、PIK3CA、RASA1和SMAD4),其中166个样本具有肿瘤和邻近周围肝脏的对应H&E切片(另外9个样本仅有肿瘤区域的切片)。这166个样本被纳入作者的相关性分析。
2-4:统计分析
使用SPSS(版本20.0;IBM,Armonk,NY,USA)和R软件进行统计分析。
分类变量使用卡方检验或Fisher精确检验进行比较。连续变量使用t检验或Mann-Whitney U检验进行比较。TLS评分系统的评分者间相关性及一致性水平通过kappa统计量、类内相关系数、Krippendorf’s alpha和Kendall’s W进行评估。生存曲线使用Kaplan-Meier方法绘制,并使用log-rank检验进行比较。
多变量分析使用Cox比例风险回归模型。不同分期系统的预测性能通过Harrell’s一致性指数(C-index)评估,并在R中的Hmisc包的rcorrp.cens包中进行比较。所有检验均为双尾检验,p值<0.05被认为具有统计学意义。
三、结果
3-1:患者的人口学和临床特征
本研究共纳入了962名患者的2,553张全切片图像(WSIs)(队列D中1,534张,队列V1中728张,队列V2中180张,队列V3中111张,队列D和V1中部分病例有多张WSIs)。
患者的人口学和临床特征在各队列之间大致平衡(表1)。
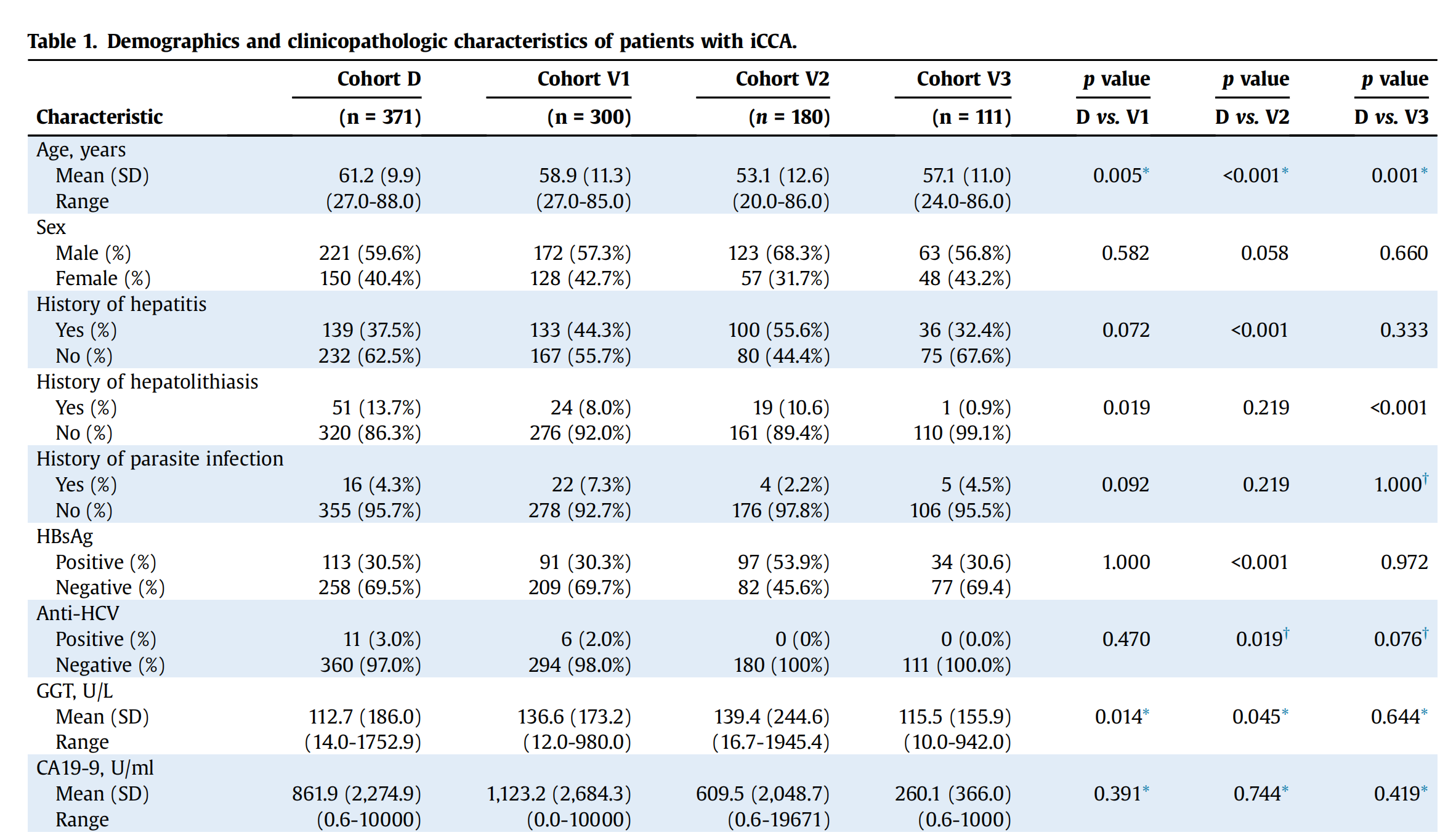
总体上,579名(60.2%)患者为男性,中位年龄为59岁(四分位距,51-66)。队列D、V1、V2和V3的中位随访时间分别为58.0(范围,6.0-124.7)、65.3(4.4-115.5)、26.7(0.7-120.6)和40.7(1.4-77.4)个月。队列D、V1、V2和V3的中位总生存期(OS)分别为27.5(范围,1.2-88.0)、16.5(0.2-108.2)、32.1(0.7-94.3)和30.2(3.1-56.4)个月。
3-2:不同亚区域的TLSs在iCCAs中预示不同的预后
根据上述评分系统,对每张WSI的TLS丰富度进行评分。
四个队列中不同T和P得分的患者数量如图1B所示。

值得注意的是,T得分和P得分之间没有显著相关性(所有p>0.05),表明不同亚区域的TLS丰富度相互独立。
对于队列D,对所有3个亚区域的TLS得分进行了评估,并显示出完全不同的预后价值。高T得分与延长的OS显著相关(图2A,p<0.001),而高P得分与缩短的OS相关(图2B,p<0.001)。
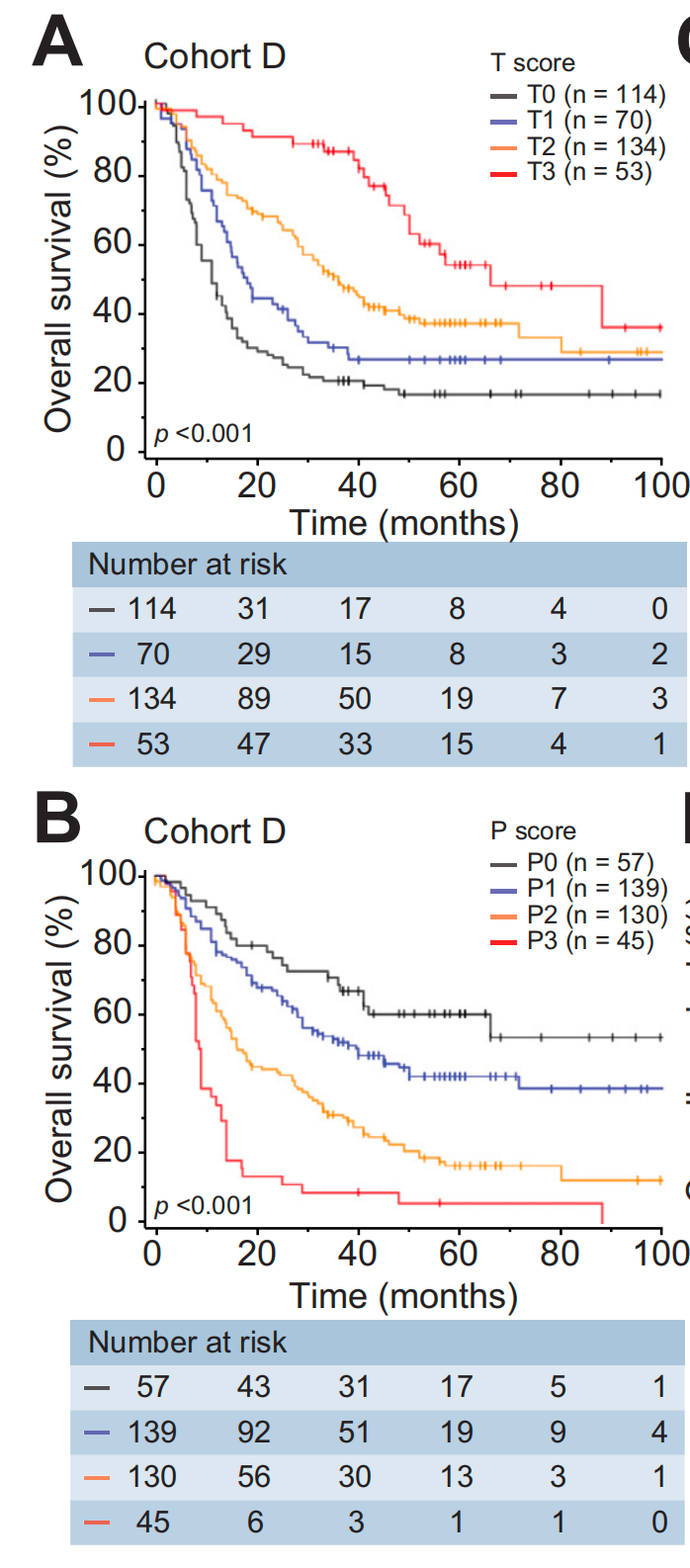
预后影响随着得分的增加而逐渐增强。作者还评估了队列D中TLSs的成熟阶段,发现P区域内的TLSs主要是Agg,而T区域内的TLSs中Fol-I和Fol-II的比例显著更高(图S1K,r=0.75,p<0.001)。
与之前对肝细胞癌的研究一致,肿瘤内TLSs的成熟阶段也对iCCA的预后有影响。
Fol iCCA的生存期显著优于Agg iCCA(图S1L,p=0.001),但将Fol iCCA进一步分为Fol-I和Fol-II并未显示出任何预后价值(p=0.144)。然而,这种TLS成熟分类与T得分呈正相关(图S1M,r=0.91,p<0.001),并在多变量分析中未能作为一个独立的预后因素保留(表S3,p=0.876)。
同样,IM得分在iCCA患者的预后中也无关紧要(图S1N,p=0.68)。因此,成熟阶段和IM得分在后续分析中被排除。这些发现 在另外3个验证队列中得到了进一步证实,其中P得分仍然是与不良OS显著相关的参数,而T得分在队列V2和V3中的显著性较低(图2C-H,p值范围为0.074至<0.001)。
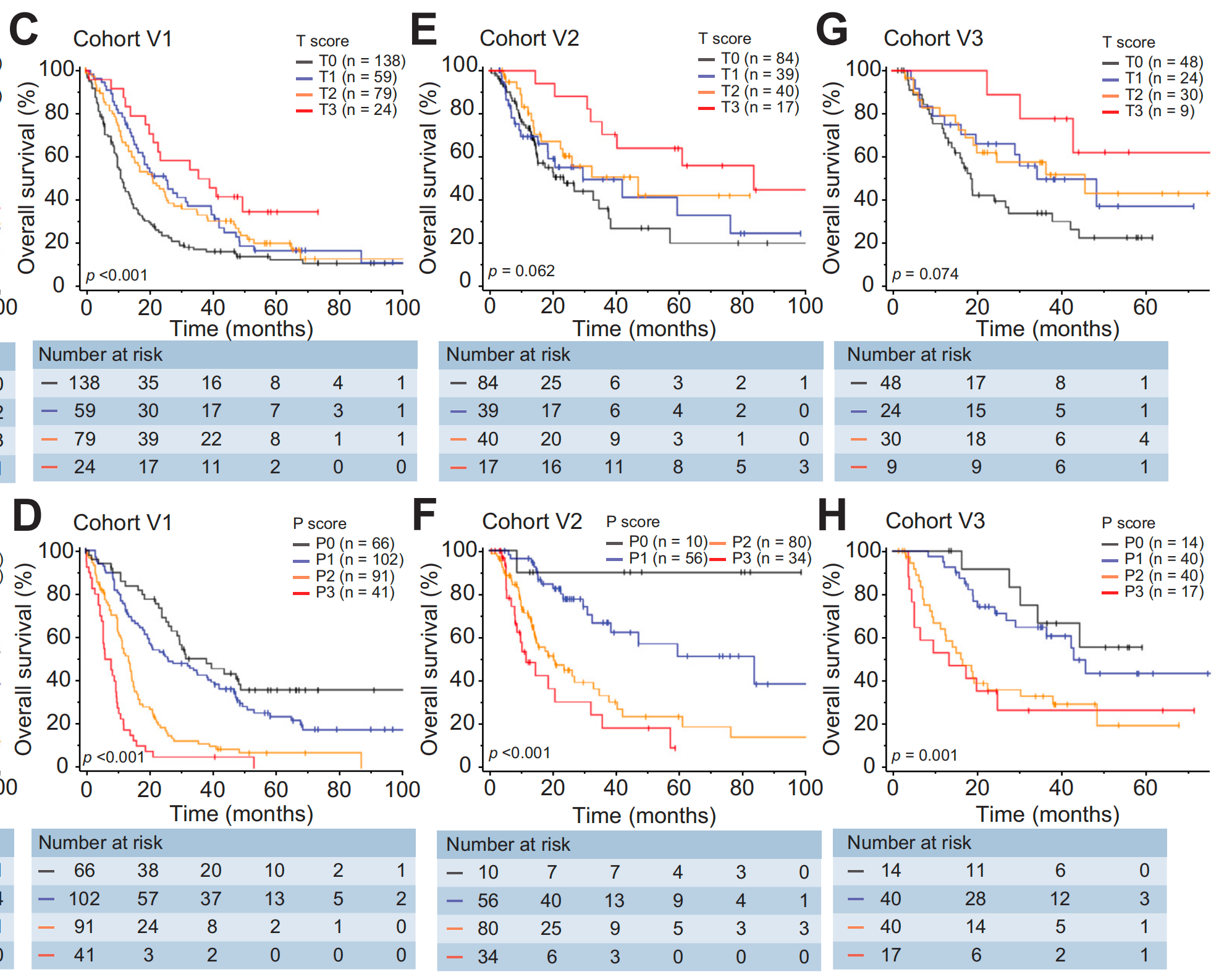
队列D和V1中临床病理特征与TLS得分的相关性列于表S4。T得分与肿瘤坏死、肿瘤大小和微血管侵犯呈负相关,而P得分与淋巴结转移以及血清γ-谷氨酰转移酶和碳水化合物抗原19-9水平呈正相关(所有p<0.05)。
T与P得分的相反预后价值和不同的临床病理相关性表明,肿瘤内和肿瘤周围TLSs之间存在本质差异。此外,高T得分可能表明免疫活跃的环境,而高P得分则是免疫排除的特征。
在另一个独立的iCCA队列(Dong et al., Cancer Cell 2021)中,还探讨了高发生率突变与TLS浸润的相关性。然而,除了IDH2突变(n=11)与P得分之间存在潜在关联(p=0.002)外,未发现TLS浸润与这些突变之间存在其他显著相关性(图S2)。
这一结果与之前的一项iCCA研究一致,该研究显示免疫亚型与常见遗传突变无关[9],表明遗传突变可能不是肿瘤免疫微环境的唯一影响因素。
尽管IDH2突变似乎与P得分相关,但由于IDH2突变病例数量有限,其在肿瘤周围免疫中的作用需要进一步调查。
3-3:免疫微环境中TLSs的组成
为了探究TLSs在iCCA中具有相反预后作用的潜在机制,从队列D中获取了17个iCCA样本(mIHC1),每个T得分和P得分至少有3个代表性样本。详细评分信息和临床特征列于表S5。
这些样本的连续切片被mIHC和H&E染色,通过两种方法识别的TLSs显示出良好的一致性,进一步验证了作者的TLS评分系统的真实性(图3A)。
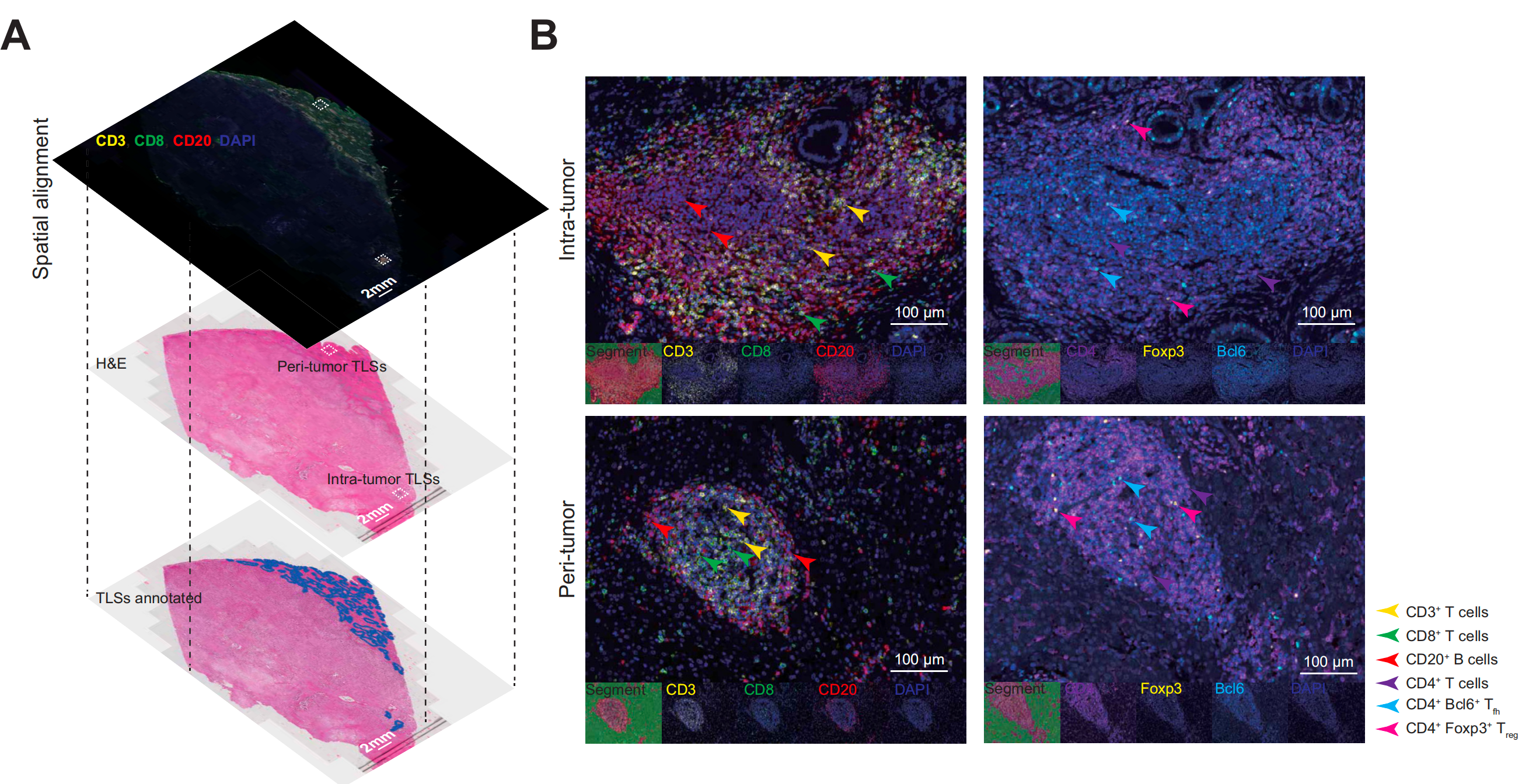
通过mIHC确定了8个突出的免疫亚群(图3B,图S3A和3B)。
TLSs内部和周围肿瘤区域TLSs中T辅助细胞(Tfh)和调节性T细胞(Treg)的分布显著不同。
首先,与周围肿瘤区域TLSs相比,CD4+ Bcl6+ Tfh细胞和CD4+ Foxp3+ Treg细胞在CD4+ T细胞中的密度和频率在肿瘤内TLSs中显著增加(图3C和3D,密度:Tfh,p=0.0048,Treg,p=0.023;频率:Tfh,p=0.0031,Treg,p=0.0036)。

TLSs中其他免疫亚群,包括CD20+ B细胞、CD8+细胞毒性T细胞和CD68+巨噬细胞,在两个亚区域之间没有显著差异(图S3C和3D)。其次,随着P得分的增加,肿瘤内TLSs中Treg细胞的频率显著增加(图3E和3F,p值范围从0.0039到0.024),这表明肿瘤内免疫抑制微环境与周围肿瘤区域TLSs的丰富度之间可能存在潜在的相关性。
然而,在肿瘤内TLSs中,Tfh细胞的频率在T得分1到3之间保持一致(图3E和3G),揭示了肿瘤内TLSs在一定程度上的同质性。作者还观察到,在肿瘤内TLSs中,CD8+细胞毒性T细胞的密度随着T得分的增加而增加,而CD68+和PDL1+细胞的密度显示出相反的趋势(图S3E和3F)。
值得注意的是,TLSs内CD20+ B细胞的密度与T得分或P得分均无相关性(图S3E和3G)。这些发现通过来自队列V2的另外22个iCCA样本(mIHC2;表S5和图S4)得到了进一步的确认。综上所述,T得分可能反映了成熟肿瘤内TLSs产生的抗肿瘤免疫反应的强度,而P得分可能反映了肿瘤内免疫抑制的水平。
3-4:结合T和P得分将iCCAs分为4个免疫亚类
考虑到它们在反映免疫背景方面的互补作用,将T和P得分结合起来可能为iCCA患者提供一个综合的免疫分类。
使用多变量Cox回归分析,根据队列D,将T得分和P得分(由回归系数加权)转化为一个新的变量“免疫评分”(Immune Score): 免疫评分 = (0.5 × T得分) + (-0.67 × P得分)。
在方程中,正系数表示保护因素,而负系数表示风险因素。免疫评分是一个离散变量,包含16个不同的值,每个值代表T和P得分的独特组合(表S6)。相邻的4个免疫评分值代表具有相似TLSs分布模式的相似预后分布;
因此,作者将它们分组在一起,进一步将患者分为4个免疫亚类:I、II、III和IV(表S6)。亚类之间在TLSs的丰富度和分布模式上存在差异。I类代表TLSs主要位于P区域的iCCA患者,而IV类代表TLSs主要位于T区域的iCCA患者。II和III类TLSs的分布模式是异质的,取决于肿瘤内和肿瘤周围TLSs之间的相对变化。
根据这一分类,四个队列中962名患者中,分别有28.1%,31.1%,28.4%和12.5%的患者被分为I、II、III和IV类。不同亚类之间的OS差异通过Kaplan-Meier曲线展示并得到独立队列的验证(图4A-D,所有p<0.001)。

IV类患者风险最低,队列D、V1、V2和V3的5年OS率分别为68.8%(95% CI 55.9%至81.7%),47.5%(29.3%至65.7%),91.7%(76.0%至100.0%)和72.7%(46.4%至98.9%)。
相比之下,I类患者风险最高,队列D、V1、V2和V3的5年OS率分别为3.4%(95% CI,0%至7.7%),0.0%(0.0%至0.0%),7.6%(0%至20.3%)和15.6%(0.0%至29.7%)。类似地,免疫亚类与无复发生存期之间也存在相似的相关性,其中IV类患者复发风险最低,而I类患者复发风险最高(图S5)。
与TNM分期系统相比,免疫亚类在预测OS方面显示出更好的准确性和区分能力。
免疫亚类预测OS的C-指数分别为0.73(95% CI,0.71-0.76),0.71(0.69-0.74),0.70(0.66-0.74)和0.73(0.68-0.78)对于队列D、V1、V2和V3,分别明显高于TNM分期系统(0.63,0.58,0.61和0.58对于队列D、V1、V2和V3,所有p<0.001)。
此外,免疫亚类在根据主要临床和病理特征(如TNM分期、肿瘤坏死和肿瘤大小)对患者进行分层后,对OS预测仍然显著(图S6)。
综上所述,本研究通过多中心大样本队列,建立了基于TLSs分布的iCCA免疫评分系统,该系统可以更准确地预测患者的预后,并为iCCA的个体化治疗提供指导。
此外,研究结果还表明,肿瘤内和肿瘤周围TLSs的分布和组成可能反映了肿瘤内免疫环境的差异,这为深入理解iCCA的免疫微环境提供了新的视角。
3-5:免疫亚类与临床病理特征的预后意义
多变量Cox分析显示,在所有四个队列中,只有免疫亚类和肿瘤坏死是OS的独立风险因素(所有p<0.05),而其他临床病理变量均未显示出一致的显著性(表2)。
与之前的研究一致[17],肿瘤坏死是iCCA的常见组织学特征(在作者的研究中,所有患者中有44.9%被归类为坏死阳性),并与不良预后相关(图S7A,所有p<0.001)。
肿瘤坏死的形成通常被认为是对癌细胞自身更具侵袭性的生物学行为的一个指标,这可能解释了免疫亚类和坏死之间相互独立的预后作用。
事实上,免疫亚类与肿瘤坏死之间也观察到了显著的负相关(图S7B,对于队列D、V1、V2和V3,r分别为-0.40、-0.23、-0.45和-0.37,所有p<0.05)。
从免疫亚类I到IV,肿瘤坏死患者的比例逐渐降低,强调了肿瘤微环境中肿瘤相关和宿主相关因素之间的相互依赖性和平衡。
四、讨论
本研究揭示了TLSs(肿瘤相关三级淋巴结构)在iCCA(肝内胆管细胞癌)患者中的复杂作用,这些作用基于其密度和空间位置。
肿瘤内的TLSs丰富度是iCCA预后良好的有效预测指标,而肿瘤周围的TLSs的存在与不良预后显著相关。TLSs在空间上的不同功能在肝细胞癌和乳腺癌中也得到了认识,但其潜在机制尚不明确。
在本研究中,作者发现与肿瘤周围的TLSs相比,肿瘤内的TLSs中CD4+ Bcl6+ Tfh细胞的频率显著增加。Tfh细胞是成熟TLSs的关键组成部分,有助于形成和维持生发中心,并塑造以抗肿瘤方向为主的免疫环境。肿瘤内TLSs中高水平的Tfh细胞可能是其有利预后影响的基础。
然而,作者也注意到,与肿瘤周围的TLSs相比,肿瘤内的TLSs中CD4+ Foxp3+ Treg细胞的频率显著增加。Treg细胞在肿瘤内的TLSs中的频率随着肿瘤周围TLSs丰富度的增加而显著增加,这暗示着肿瘤周围TLSs与肿瘤内免疫抑制微环境之间可能存在潜在的联系。
总的来说,肿瘤内和肿瘤周围TLSs的细胞组成可能定义了它们促瘤或抗瘤的活动。
简而言之,肿瘤内的TLSs是抗肿瘤免疫反应的微解剖学位点:T得分代表其丰富度,而P得分反映其效能。
这些参数的组合为iCCA患者提供了一个综合的免疫环境视图,并成功地将患者分为四个具有显著不同预后的免疫亚类。免疫亚类代表了患者中TLSs的空间分布、丰富度和功能取向(图4E)。
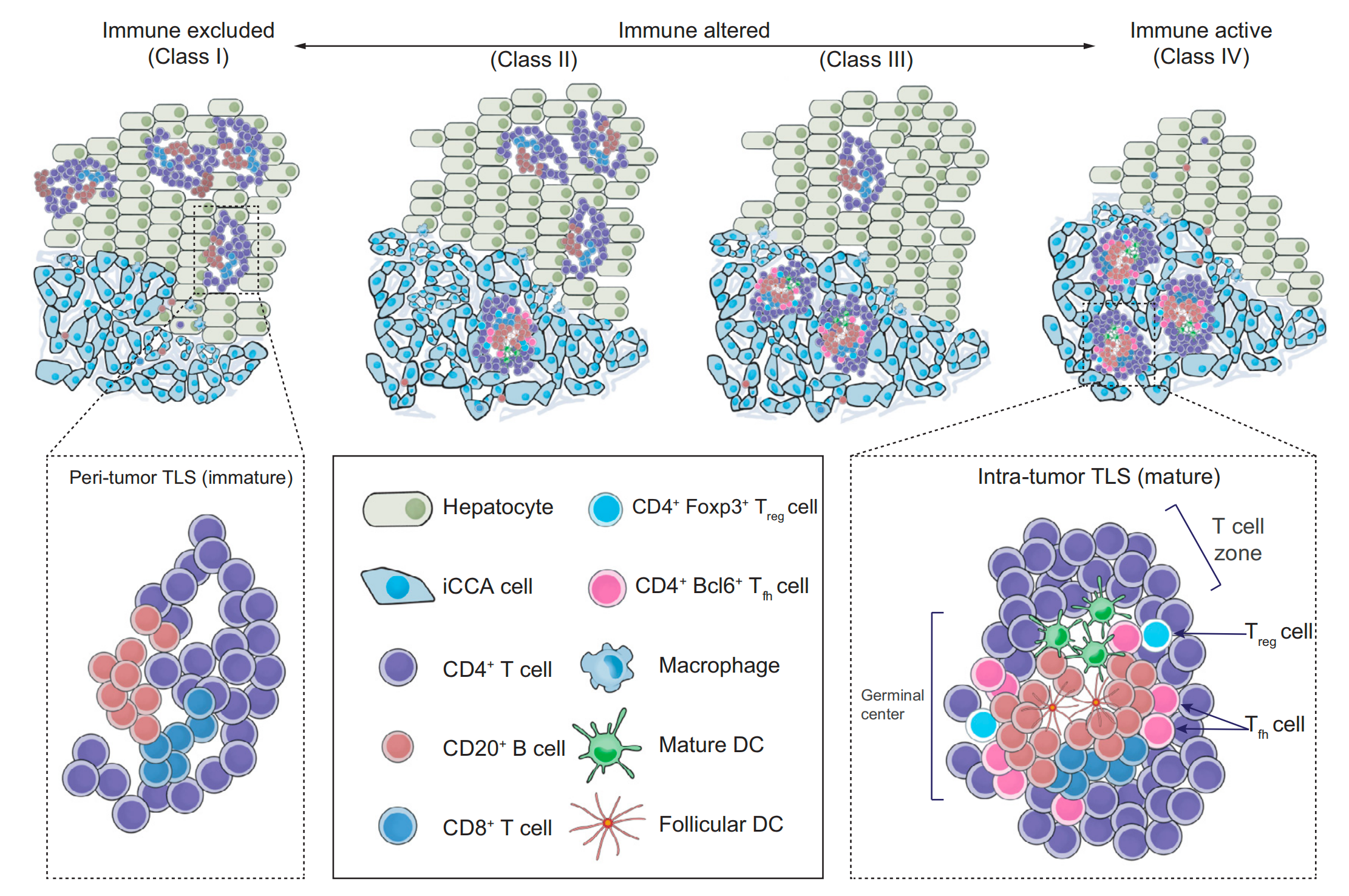
Class IV代表了具有大量肿瘤内TLSs和最小肿瘤周围TLSs的患者,表明了一种强烈而有效的抗肿瘤免疫反应(免疫活跃),而Class I则代表了相反的组合,即最不有效的抗肿瘤反应和最差的预后(免疫排除)。
Class II和III的TLSs分布模式代表了中间和异质性的抗肿瘤反应,反映了向促瘤或抗瘤方向倾斜的免疫平衡的改变(免疫改变)。因此,从Class I到IV,患者的免疫行为差异极大,这在内部和外部都得到了验证,突出了作者免疫亚类的可靠性和区分能力。
与作者的发现一致,最近基于基因表达的iCCA分类也报告说,具有反应性免疫基因模式的亚型预后良好,而没有免疫细胞标志的亚型预后较差。相比之下,一个由强烈的肿瘤周围免疫基因表达特征定义的亚型(在作者的研究中类似于Class I)预后最差。
尽管本研究基于间接方法识别免疫细胞且缺乏空间信息,但它从分子层面支持了作者的结果。免疫分类已经在结直肠癌和乳腺癌的临床实践中获得批准,与传统临床方法相比具有更优越的预后能力。
同样,作者的免疫亚类在预测iCCA患者的预后方面显示出了稳健和可靠的预后价值,明显优于TNM分期系统。
然而,仍有几个问题需要进一步研究。
首先,肿瘤相关TLSs已被证明与免疫治疗的改善反应正相关,因此,免疫亚类应该被测试其在肝胆癌治疗预测中的能力。其次,肿瘤中TLSs的形成和分布机制仍需阐明。第三,是否在肿瘤进展过程中TLSs的组成发生变化,或者它是否可以通过新的临床干预进行操纵,这些都是值得未来研究的课题。
值得注意的是,本研究发现,沿着侵袭边缘(IM)分布的TLSs与iCCA患者的生存无关。
IM通常被认为是肿瘤-宿主相互作用的前线。结直肠癌的结果表明,IM中的CD45RO+和CD8+细胞密度与良好的临床结果相关,而在乳腺癌中则得出相反的结论。实际上,IM浸润的TLSs可能来自界面两侧,具有不同的细胞组成和功能取向,这可能是IM得分在iCCA预后上无关紧要的一个可能解释。
综上所述,作者证明了TLSs的空间排列和丰富度与iCCA患者的预后显著相关,并提出了一个新的免疫分类方法,用于预测iCCA患者的生存期。作者还确定了Tfh和Treg细胞在决定TLSs的促瘤或抗瘤能力方面的关键作用,这揭示了一条提高免疫治疗响应率的潜在途径。

![【洛谷】P10417 [蓝桥杯 2023 国 A] 第 K 小的和 的题解](https://img-blog.csdnimg.cn/img_convert/bb465fd71adb7c9864eac11c84f68787.png)




![[Linux] Linux进程PCB内部信息的深入理解](https://i-blog.csdnimg.cn/direct/720a05b41a57462fa6232d047c1836ce.png)