大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
DNA甲基化是一种重要的表观遗传修饰,对调控基因组功能有多种作用。其水平在整个基因组中具有空间相关性,通常在被抑制区域较高,在转录因子(TF)结合位点(TFBS)和活性调控区域较低。然而建立全基因组和TF结合位点甲基化模式的机制仍不清楚。
2024年6月6日,欧洲分子生物学实验室EMBL(European Molecular Biology Laboratory)Maša Roller团队设计了一项比较表观基因组学研究以研究转录因子结合区域内的DNA甲基化(DNAm)模式。从五种哺乳动物(人类、猕猴、小鼠、大鼠和狗)的肝脏生成全基因组重亚硫酸盐测序(WGBS)数据,并检索匹配组织中五种转录因子的公开可用ChIP测序数据。其中四种(CEBPA、HNF4A、ONECUT1和FOXA1)是肝脏特异性调控网络的关键组分,而CTCF是一种广泛存在的多功能蛋白。作者利用这些数据集来表征转录因子结合区域(TFBRs)的DNA甲基化,揭示不同功能基因组元件中的差异DNAm模式,并表明DNA甲基化和转录因子结合共进化。相关研究成果以“DNA methylation patterns of transcription factor binding regions characterize their functional and evolutionary contexts”为题发表在《Genome Biology》期刊。

标题:DNA methylation patterns of transcription factor binding regions characterize their functional and evolutionary contexts(转录因子结合区域DNA甲基化模式表征了其功能和进化背景)
时间:2024-6-6
期刊:Genome Biology
影响因子:IF 12.3 / Q1
技术平台:ChIP-seq、WGBS等
研究摘要:
本研究采用比较方法来探究DNA甲基化与哺乳动物中转录因子(TF)结合位点进化之间的联系。具体来说,通过实验对DNA甲基化进行分析,并将其与已发表的五种不同转录因子(CTCF、CEBPA、HNF4A、ONECUT1、FOXA1)在五种哺乳动物(人类、猕猴、小鼠、大鼠、狗)肝脏中的占据情况相结合。
转录因子结合位点通常甲基化水平较低,但也通常具有中等甲基化水平。即使在核心结合motif中没有CpG位点,结合位点的甲基化水平也会受到其更广泛结合区域内CpG位点的影响。
通过采用分类和聚类方法,研究人员提取了在转录因子结合区域具有物种保守性的不同DNA甲基化水平模式。CEBPA、HNF4A、ONECUT1和FOXA1具有相同的甲基化模式,而CTCF的模式则具有差异。这些模式表征了转录因子结合区域的不同功能和染色质景观。
利用系统发育框架分析,揭示了转录因子占据的进化丧失中出现了DNA甲基化增加,表明了协调进化的存在。此外,每种甲基化模式都有其自身的进化轨迹,表征了其基因组背景。
总之,本研究通过表观基因组分析表明,DNA甲基化在物种间的转录因子结合变化中发挥作用,特定的DNA甲基化谱可以表征转录因子结合,并与其调控活性、染色质背景和进化轨迹相关联。
研究方法:

结果图形:
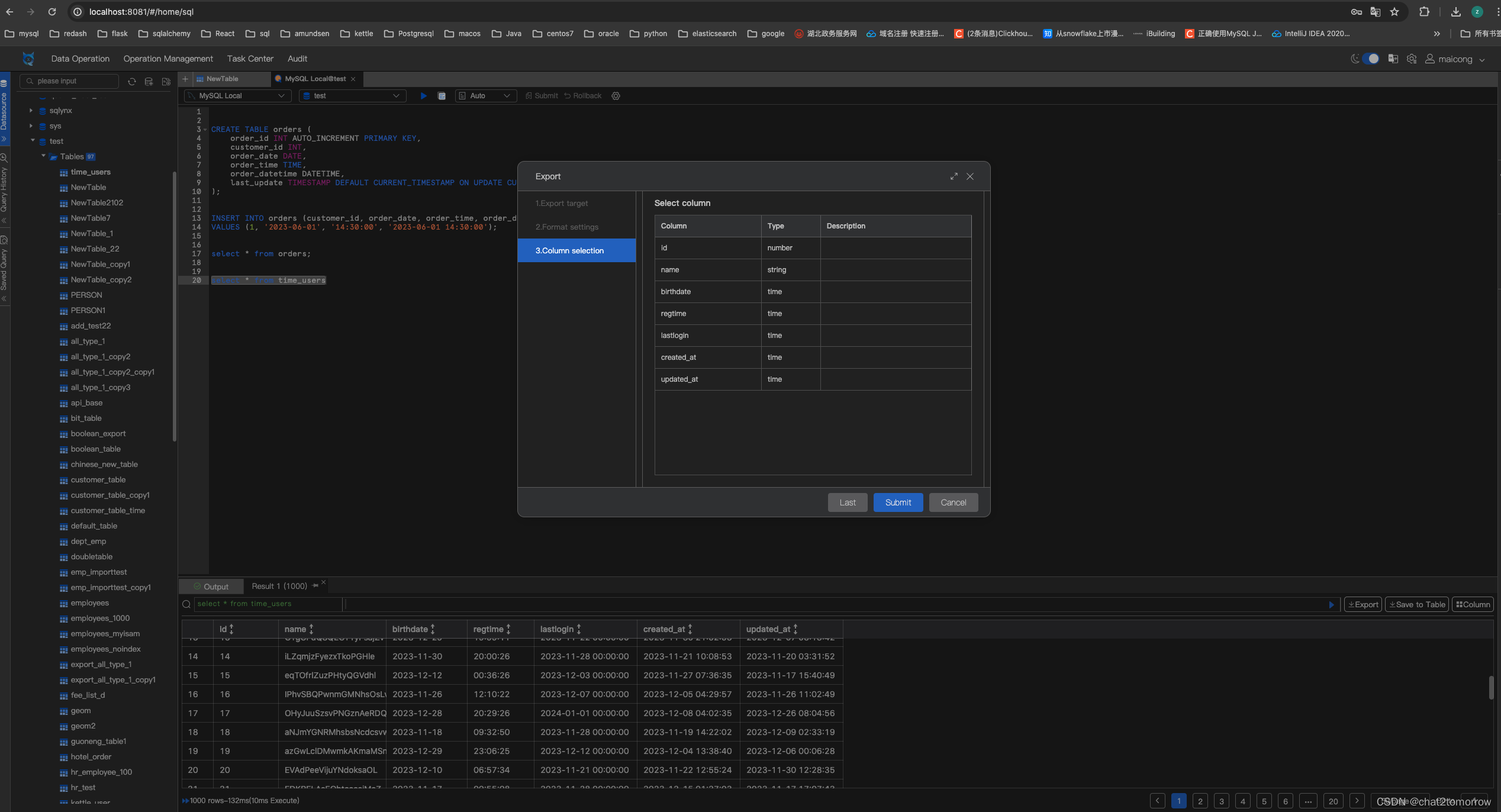
- 通过WGBS实验和ChIP-seq数据分析转录因子结合区域的DNA甲基化

图1:比对哺乳动物中的甲基化组。
- 示例区域:从五种哺乳动物分离的肝脏中SMG6位点周围的体内5mC甲基化和转录因子结合。上面显示通过亚硫酸盐测序检测的CpG甲基化水平,下面显示通过ChIP-seq检测的五种转录因子结合轨迹(CEBPA、CTCF、FOXA1、HNF4A、ONECUT1)。
- 每个物种中WGBS数据的基因组覆盖率。y轴显示百分比,点半径表示正链和负链覆盖的CpG总数
- 每个物种的全基因组CpG甲基化密度分布。所有分布都是双峰的,绝大多数CpG位点呈现高甲基化状态。
(2)转录因子可以结合所有甲基化水平的DNA

图2:转录因子结合区域(TFBRs)的甲基化谱。
- 每个转录因子和物种中至少含有一个CpG的TFBRs和转录因子结合位点(TFBSs)的百分比及其结合motif。大多数TFBRs包含CpG位点,但在转录因子结合位点很少见。为每个转录因子显示了基于人类样本计算的位点权重矩阵(PWMs)。
- 转录因子结合区域(TFBRs)和转录因子结合位点(TFBSs)的定义。TFBRs是ChIP-seq峰,已在物种和转录因子内按长度归一化。TFBSs覆盖ChIP-seq峰最顶端最近的结合motif。
- TFBRs的平均甲基化水平。在所有物种和转录因子中的分布是双峰分布。所有转录因子都具有低甲基化模式,而CTCF具有较高的高甲基化模式,其余转录因子具有较低模式。
- TFBRs和TFBSs的CpG甲基化密度分布。除了CTCF在所有物种中单峰分布外,所有分布都是双峰分布。高甲基化区域的阈值用灰色虚线标记(即平均甲基化60%)。
- 高甲基化TFBR中甲基化水平与转座子元件和非重复相关元件重叠。当TFBRs与转座元件重叠时其有较高5mC水平。
- 选定的转座元件组中高甲基化TFBRs相对于对照低甲基化TFBRs的相对正富集。
(3)转录因子结合多种共有的DNA甲基化谱

图3:转录因子结合区域的差异甲基化。
- 大鼠转录因子结合区域的平均5mC和CpG频率分布图,以ChIP-seq peaks峰值为中心,向两侧各扩展600 bp。每个图谱中分类的区域数量如图B所示。
- 大鼠CEBPA、小鼠FOXA1和猕猴CTCF结合区域的5mC分布图,以ChIP-seq peaks峰值为中心,归一化为1200 bp长度。这些区域有四种类型的甲基化图谱:“flat”(平坦)以深绿色表示,“left”(左)和“right”(右)分别以紫色和橙色表示(文中均称为“specular”即镜像),“high”(高)以浅绿色表示,“mid”(中等),这是CTCF特有的,以粉红色表示。
- 与B图中定义的每个聚类甲基化谱相关的转录因子结合区域的注释。右侧条形图显示每个甲基化谱中的转录因子结合事件的百分比,这些事件位于基因组的未甲基化区域(UMRs)、低甲基化区域(LMRs)或完全甲基化区域(FMR)(分别以黄色、橙色和红色表示)。左侧是每个5mC图谱中的转录因子结合事件被注释为活性启动子、活性增强子或准备增强子的百分比。条形颜色根据TFBRs甲基化图谱分配而定,并通过调节元素注释进行着色——活性启动子最浅,活性增强子较深,准备增强子最深。星号表示注释类别显著富集(经Bonferroni校正的z检验,*p值<0.05)。
- 每个转录因子结合区域与最近转录起始位点距离累积分布,按B图中定义的甲基化图谱分组。x轴以log10比例尺表示。
(4)DNA甲基化水平与转录因子结合的多样性相关联

图4:哺乳动物中甲基化与转录因子(TF)结合的共进化。
- 使用系统发育简约性方法示意图,以定义物种保守性类别和具有结合保守性的物种数量。简单来说,首先跨物种对齐并比较转录因子结合事件,然后使用简约性原则来划分特定于谱系和特定于类群的结合丢失,以及特定于谱系和特定于类群的结合获得。在物种中实验确定有结合的区域被称为同源结合的,没有结合的称为未结合的。高保守结合事件被定义为在所有物种中都有结合。下图展示了由共有转录因子结合事件的物种总数定义的相应物种保守性程度示例。
- 同源结合区域、同源未结合区域和基因组背景(BG)的平均5mC水平分布。
- 狗CEBPA和猕猴CTCF同源结合和同源未结合区域,根据A图中定义的物种保守性类别划分的平均5mC分布(Jonckheere-Terpstra趋势检验,p值<2.2e106)。
- 简约性方法将狗和大鼠的转录因子结合区域(TFBRs)的同源结合和同源未结合区域进一步划分为进化结合丢失和获得事件。
- 物种保守性与5mC图谱之间的关系。气泡图显示了狗CEBPA和猕猴CTCF转录因子结合事件的5mC图谱和转录因子结合保守性类别之间关联分析(独立性的卡方检验)的标准残差。正值表示物种保守性程度与甲基化谱之间存在正相关,而负值表示负相关。例如,狗的CEBPA结合事件,具有平坦特征的与较高水平的物种保守性正相关,而与谱系特异性结合事件负相关。气泡的大小与对总卡方得分的贡献百分比成比例,因此突出了物种保守性与甲基化谱组合对整体统计数据影响最大的组合。
关于易基因全基因组重亚硫酸盐测序(WGBS)
全基因组重亚硫酸盐甲基化测序(WGBS)可以在全基因组范围内精确的检测所有单个胞嘧啶碱基(C碱基)的甲基化水平,是DNA甲基化研究的金标准。WGBS能为基因组DNA甲基化时空特异性修饰的研究提供重要技术支持,能广泛应用在个体发育、衰老和疾病等生命过程的机制研究中,也是各物种甲基化图谱研究的首选方法。
易基因全基因组甲基化测序技术通过T4-DNA连接酶,在超声波打断基因组DNA片段的两端连接接头序列,连接产物通过重亚硫酸盐处理将未甲基化修饰的胞嘧啶C转变为尿嘧啶U,进而通过接头序列介导的 PCR 技术将尿嘧啶U转变为胸腺嘧啶T。
应用方向:
WGBS广泛用于各种物种,要求全基因组扫描(不错过关键位点)
- 全基因组甲基化图谱课题
- 标志物筛选课题
- 小规模研究课题
技术优势:
- 应用范围广:适用于所有参考基因组已知物种的甲基化研究;
- 全基因组覆盖:最大限度地获取完整的全基因组甲基化信息,精确绘制甲基化图谱;
- 单碱基分辨率:可精确分析每一个C碱基的甲基化状态。

关于易基因染色质免疫共沉淀测序 (ChIP-seq)
染色质免疫共沉淀(Chromatin Immunoprecipitation,ChIP),是研究体内蛋白质与DNA相互作用的经典方法。将ChIP与高通量测序技术相结合的ChIP-Seq技术,可在全基因组范围对特定蛋白的DNA结合位点进行高效而准确的筛选与鉴定,为研究的深入开展打下基础。
DNA与蛋白质的相互作用与基因的转录、染色质的空间构型和构象密切相关。运用组蛋白特定修饰的特异性抗体或DNA结合蛋白或转录因子特异性抗体富集与其结合的DNA片段,并进行纯化和文库构建,然后进行高通量测序,通过将获得的数据与参考基因组精确比对,研究人员可获得全基因组范围内某种修饰类型的特定组蛋白或转录因子与基因组DNA序列之间的关系,也可对多个样品进行差异比较。
应用方向:
ChIP 用来在空间上和时间上不同蛋白沿基因或基因组定位
- 转录因子和辅因子结合作用
- 复制因子和 DNA 修复蛋白
- 组蛋白修饰和变异组蛋白
技术优势:
- 物种范围广:细胞、动物组织、植物组织、细菌微生物多物种富集经验;
- 微量建库:只需5ng以上免疫沉淀后的DNA,即可展开测序分析;
- 方案灵活:根据不同的项目需求,选择不同的组蛋白修饰特异性抗体。
技术路线:

易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化)和表观转录组学(m6A、m5C、m1A、m7G)、染色质结构与功能组学技术方案(ChIP-seq、ATAC-seq),详询易基因:0755-28317900.

参考文献:
Rimoldi M, Wang N, Zhang J, Villar D, Odom DT, Taipale J, Flicek P, Roller M. DNA methylation patterns of transcription factor binding regions characterize their functional and evolutionary contexts. Genome Biol. 2024 Jun 6;25(1):146. pii: 10.1186/s13059-024-03218-6. doi: 10.1186/s13059-024-03218-6. PubMed PMID: 38844976.
相关阅读:
WGBS+ChIP-seq等表观组分析揭示FOXM1 是抗肿瘤免疫应答的关键调控因子
Genome Biol | WGBS+ChIP-seq揭示食管癌的细胞类型和癌症特异性表观遗传调控
项目文章 | Nature子刊:ChIP-seq等揭示c-di-AMP与DasR互作以调控细菌生长、发育和抗生素合成
项目文章 | WGBS+RNA-seq揭示松材线虫JIII阶段形成过程中的DNA甲基化差异