今天给同学们分享一篇文章“Combined PD-1, BRAF and MEK inhibition in BRAFV600E colorectal cancer: a phase 2 trial”,这篇文章发表在Nat Med期刊上,影响因子为82.9。

结果解读:
MAPK抑制增强BRAF V600E CRC的免疫反应
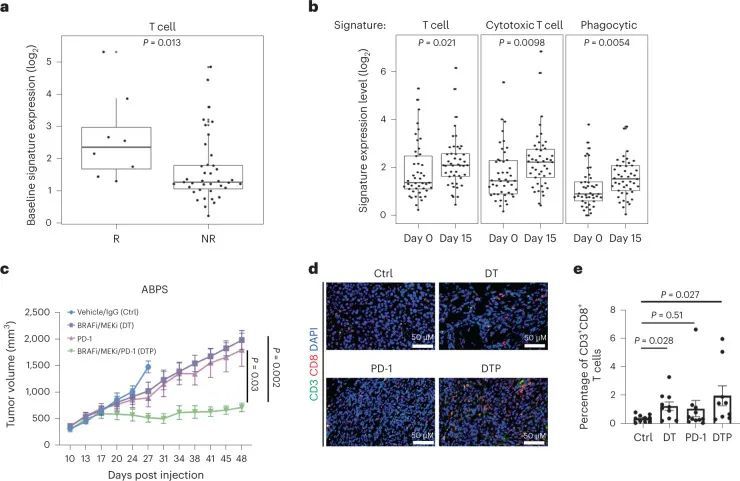
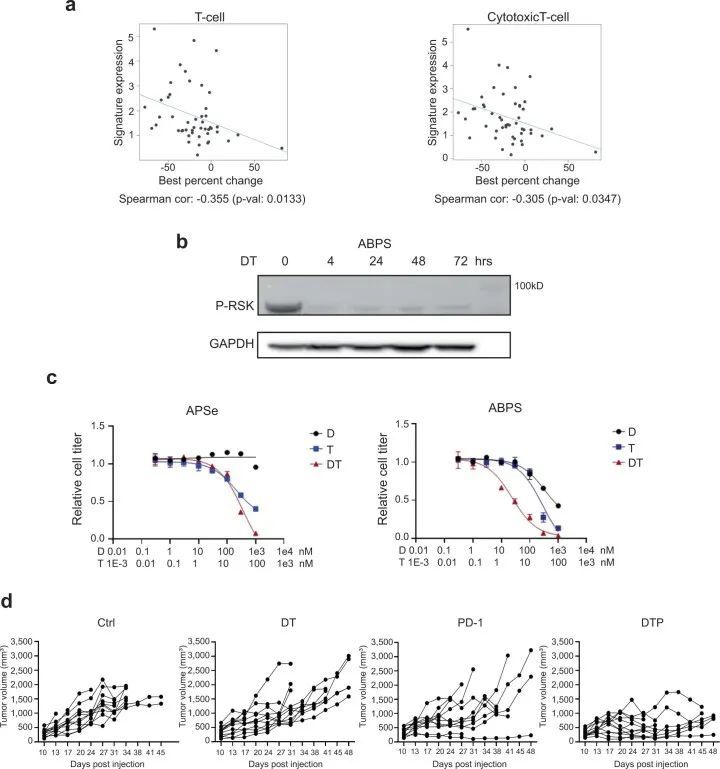
作者之前在BRAF V600E 结直肠癌的临床试验中,使用BRAF靶向治疗联合方案,发现BRAF通路抑制与免疫反应 12 之间可能存在潜在联系,其中大约三分之一的BRAF V600E 结直肠癌患者在同时具有MSI的情况下,持续获益超过1年。为了研究这种潜在的协同作用,作者分析了71名患有BRAF V600E 结直肠癌的患者的批量RNA测序数据,其中包括45对患者活检标本(治疗前和治疗第15天)和26个基线标本 25 。值得注意的是,基线肿瘤活检的RNA测序结果显示,与非应答者相比,应答者的T细胞标志物(表明T细胞水平增加)显著增高(图1a)。T细胞和细胞毒性T细胞标志物的基线水平也与目标病变尺寸相对于基线的最佳百分比变化相关。此外,在所有患者中,相对于配对的基线活检,治疗后15天内T细胞、细胞毒性T细胞和其他免疫标志物的增加得到了注意,表明BRAF通路抑制后肿瘤中T细胞和免疫浸润增加(图1b)。这些数据支持BRAF/MAPK抑制与BRAF V600E 结直肠癌中免疫反应之间的潜在相互作用。
临床疗效
根据这些数据,据作者所知,作者发起了第一项临床试验,将靶向BRAF通路抑制与ICB相结合应用于BRAF V600E 结直肠癌。BRAF V600E 结直肠癌患者接受了BRAFi达布替尼、MEKi曲美替尼和抗PD-1抗体斯帕他利珠单抗(PDR001)的治疗。虽然DT不是针对BRAF V600E 结直肠癌的最佳靶向策略,在先前的临床试验中,其产生了7%的完全缓解率和中位无进展生存期为3.5个月的结果,但来自黑色素瘤患者的已建立的剂量和安全性数据使得这种三联方案的临床试验能够更快地启动。作者推断,观察到的临床协同作用的证据将为将来评估ICB与更有效的BRAFi联合治疗方案(包括抗EGFR抗体联合治疗方案)提供合理性依据。
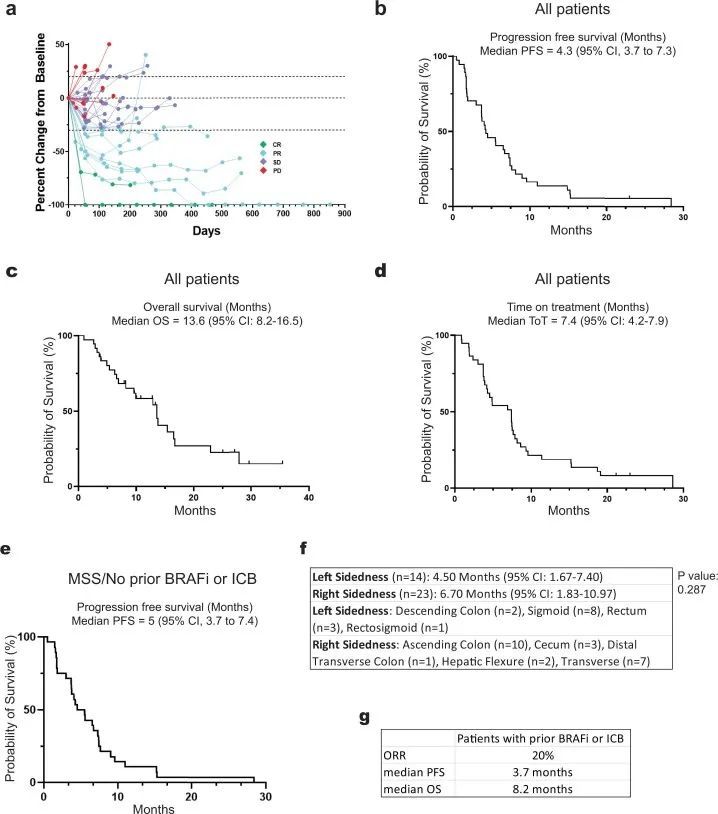
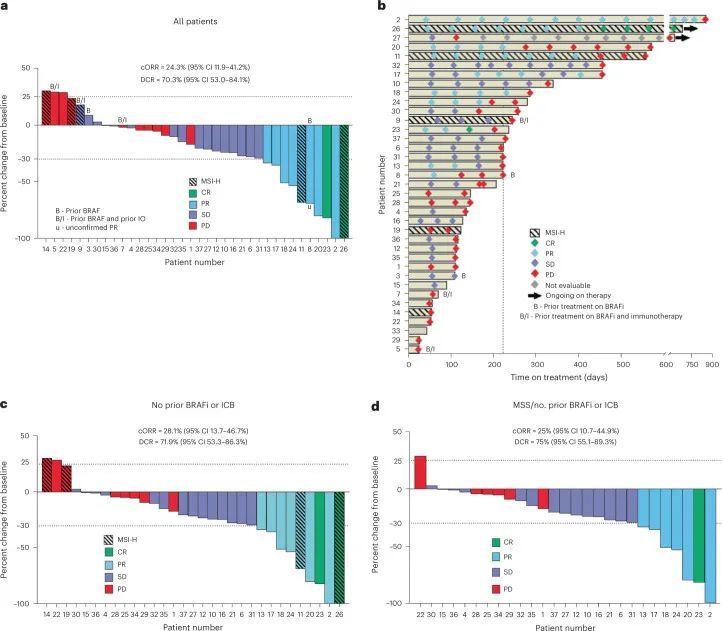
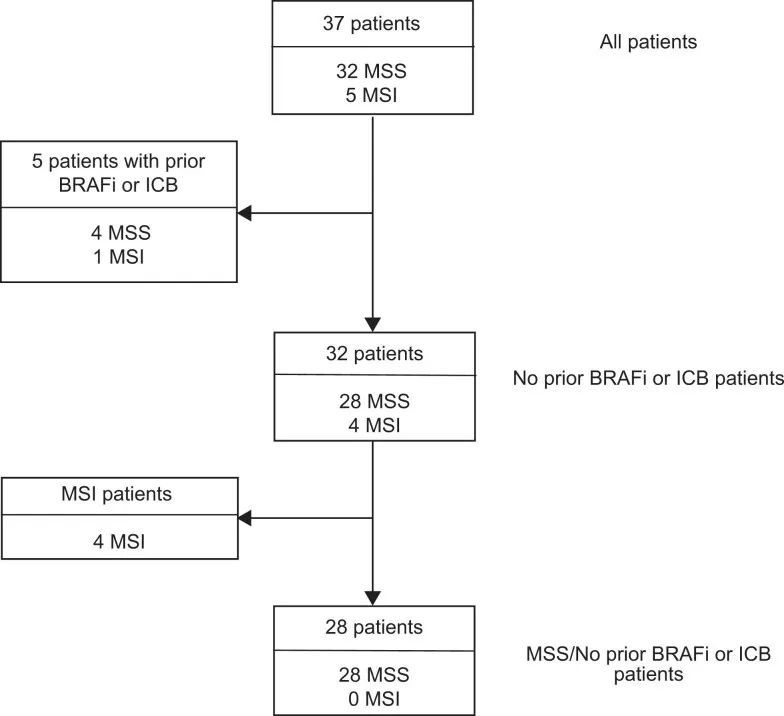
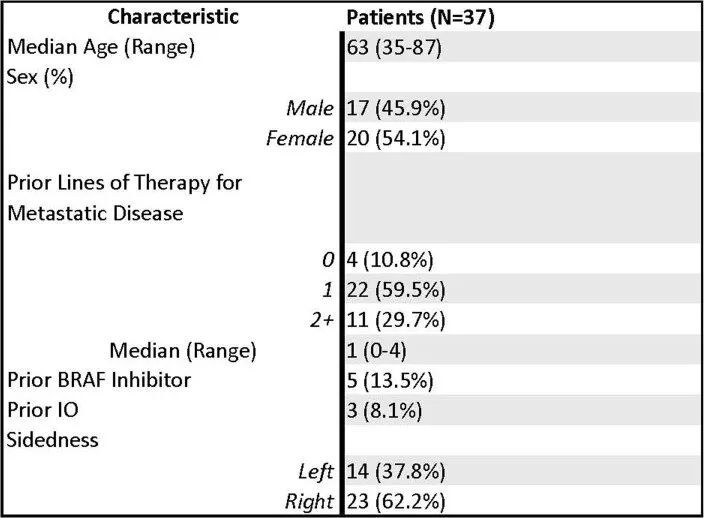
截至数据截止日期,已招募了计划中的40名BRAF V600E CRC患者中的37名。所有32个MSS患者名额已经招募完毕,还有8个MSI患者名额中的5个已经招募完毕。其中5名患者之前接受过BRAFis和/或免疫检查点抑制剂的治疗。中位年龄为63岁(范围35-87岁),其中20名(54.1%)为女性(扩展数据表1),中位随访时间为995天(范围245-1,324天)。总体而言,该方案耐受性良好,最常见的不良事件(AEs)为皮疹、发热和腹泻。主要终点为ORR,次要终点为PFS、疾病控制率(DCR)、反应持续时间和OS。在所有37名患者中,有9名患者达到了确认的反应(cORR为24.3%,95%置信区间(CI)为11.9-41.2%),另有1名患者达到了未确认的反应,DCR为70.3%(95% CI为53-84.1%)(图2a),与BRAF V600E CRC中仅使用达布拉非尼加曲美替尼的历史性7% cORR(95% CI为1.5-19.1%)相比,效果更好。两名患者达到了完全缓解。中位PFS为4.3个月(95% CI为3.7-7.3个月)。中位总生存期为13.6个月(95% CI 8.2-16.5个月)。治疗时间的中位数为7.4个月(95% CI 4.2-7.9个月)(图2b)。在32名没有接受过前期BRAF定向治疗或免疫检查点抑制剂治疗的患者中,cORR为28.1%,DCR为71.9%(图2c)。前期接受过BRAF定向治疗或免疫检查点抑制剂治疗的患者的ORR。
扩展数据表1
患者人口统计数据
扩展数据表2
毒性不良事件总结
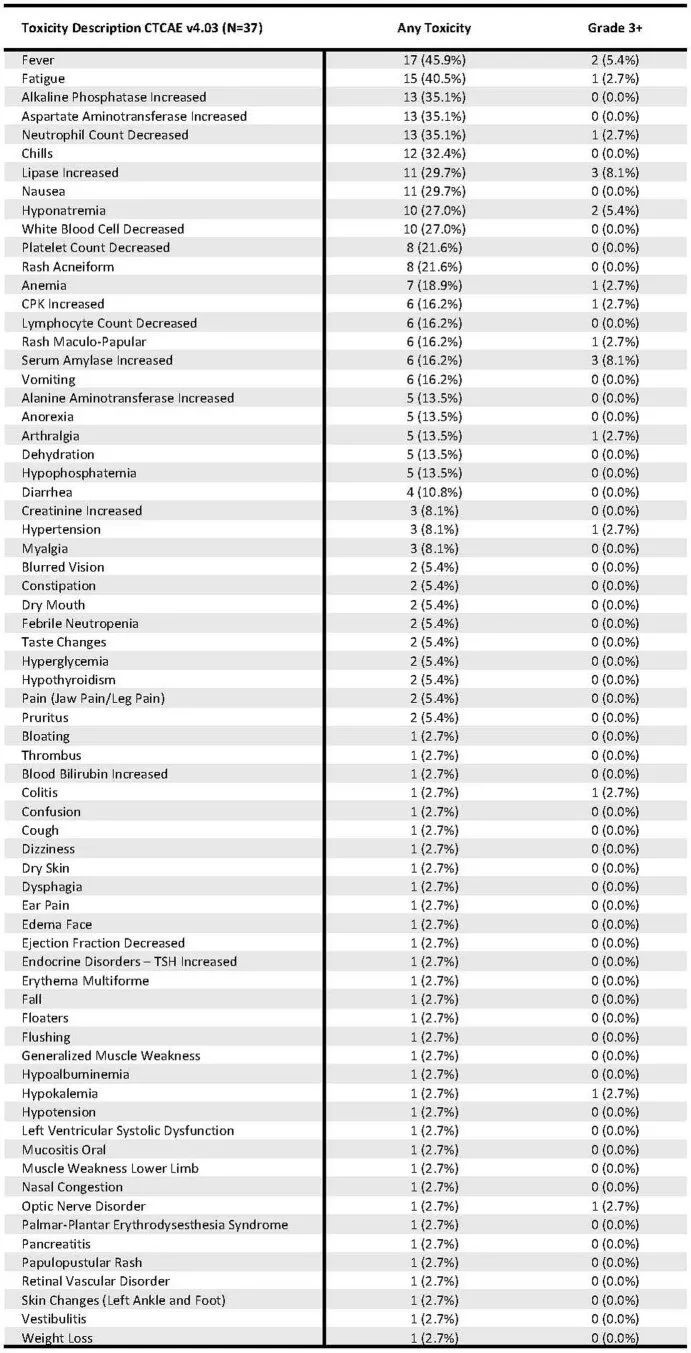
毒性AE总结
由于MSI CRC患者可能单独对ICB有反应,本研究的重点是28名既往未接受BRAF指导治疗或ICB的患者,他们也是MSS,因此,预测对ICB的单独反应率可以忽略不计。在这些患有MSS BRAFV600E CRC的患者中,cORR为25%(95%CI 10.7–44.9%),DCR为75%(95%CI 55.1–89.3%)(图。(图2d),2d),再次与历史控制进行比较。中位PFS为5 月(95%置信区间3.7-7.4 月),其中5名患者(18%)仍在接受治疗一年以上(图3e)。这与早期单独对DT的研究形成了鲜明对比,后者显示中位PFS仅为3.5 月,没有MSS患者的治疗时间超过1 年一名患者获得部分缓解(根据实体瘤疗效评估标准(RECISTS)1.1版,−100%),持续2.5 年。
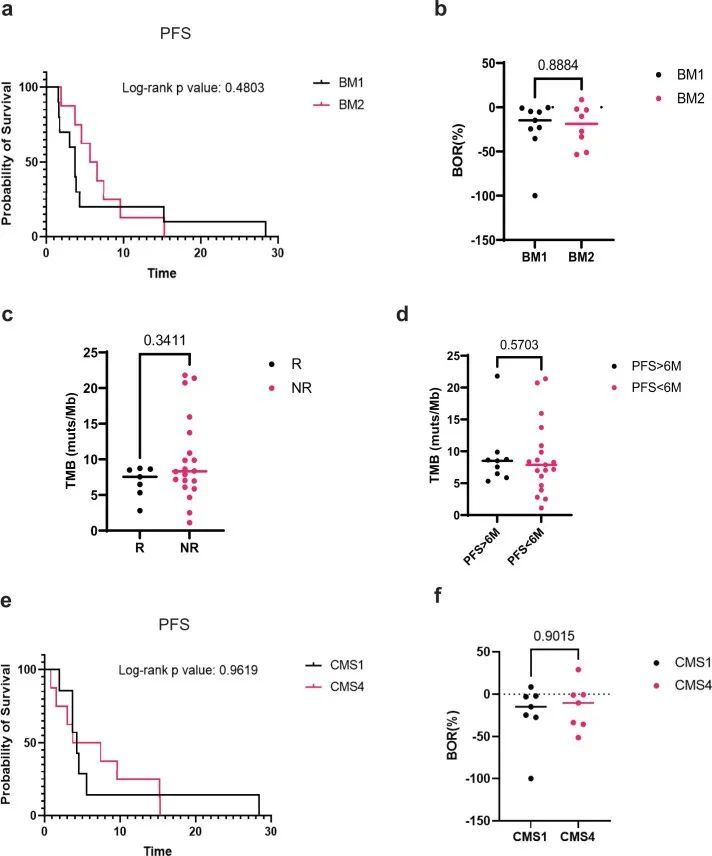
对基线活检的分析显示,肿瘤突变负荷、BM1/BM2转录亚型和共有分子亚型(CMS)与临床结果无关(图4)。此外,根据原发肿瘤的左侧和右侧,没有观察到疗效差异(图3f)。总体而言,这些数据表明了有希望的临床疗效,并证明了BRAF/MAPK通路抑制与ICB之间的协同作用。
肿瘤固有免疫反应与MAPK抑制
为了了解BRAF/MAPK通路抑制和肿瘤免疫反应的潜在相互作用,所有患者都对同一肿瘤病变进行了配对预处理和第15天的治疗活检。通过scRNAseq分析新鲜肿瘤活检,并从23名患者的两次配对活检中获得可评估的数据。在所有标本和基质、免疫和肿瘤上皮细胞群中,共有419551个单细胞通过了质量控制(QC)(图3a)。比较治疗前和治疗中活检中单个细胞群丰度的变化,作者观察到PFS患者治疗后肿瘤上皮细胞显著减少,CD45+免疫细胞(由细胞类型聚类定义)、T细胞和CD8+T细胞增加 > 6. 月(n = 11) 但PFS患者没有 < 6. 月(n = 12) (图3b)。
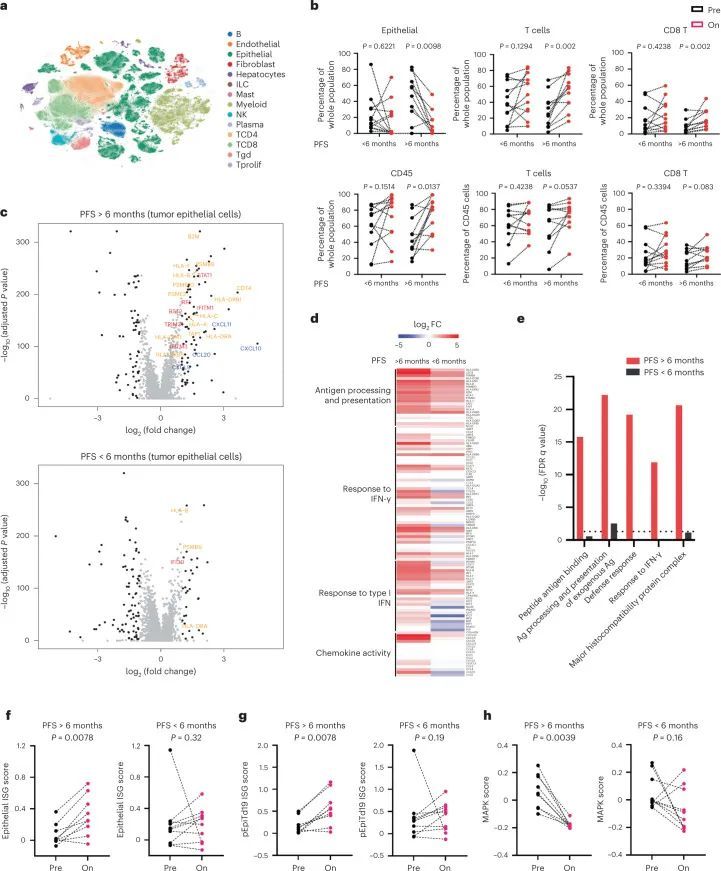
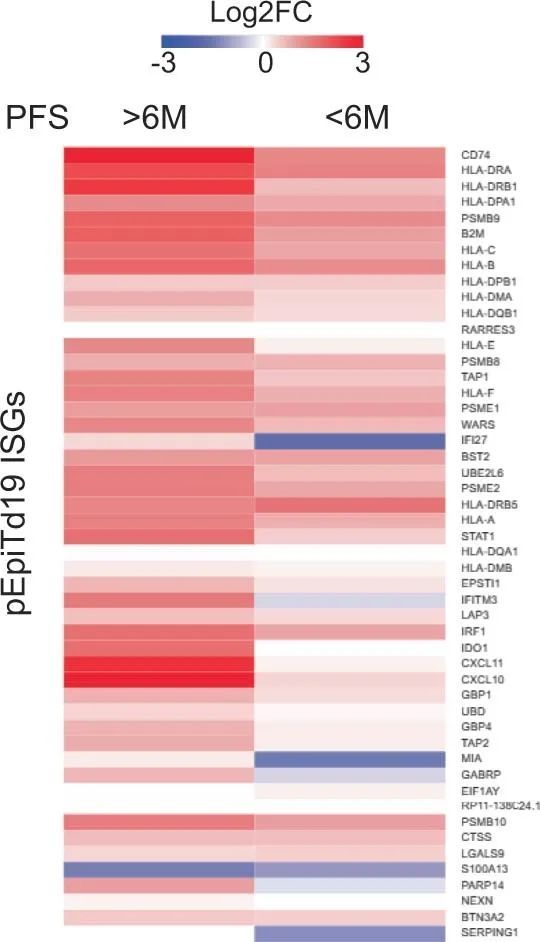
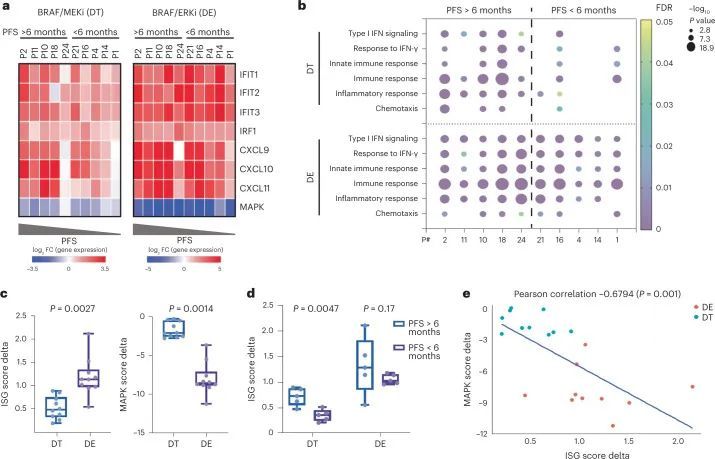
为了了解BRAF/MAPK抑制在肿瘤细胞中的特异性作用,作者表征了治疗后肿瘤上皮区室中基因表达的变化,以确定潜在的肿瘤细胞内在机制。与预处理相比,评估第15天肿瘤细胞中的差异表达基因(DEGs)显示PFS患者的免疫相关基因表达显著增加 > 6. 在PFS患者中未观察到的月份 < 6. 月,包括参与干扰素(IFN)反应(例如STAT1、IRF1、IFITM1、IFITM3、BST2和TRIM31)、抗原处理和呈递(例如B2M、CD74、PSMB10、TAP1、HLA-A、HLA-C、HLA-F、HLA-DRB1和HLA-DPA1)和趋化因子活性(例如CXCL9、CXCL10和CXCL11)的基因(图3c、d),表明IFN刺激的转录程序和抗原处理和呈递途径的整体上调,这也通过基因集富集分析观察到(图3e)。相反,PFS患者肿瘤上皮细胞中富集的免疫相关基因集较少 < 6. 月(图。(图3e).3e).PFS患者的DEG > 6. 使用映射到抗原处理和呈递、对IFN-γ的反应、对I型IFN的反应和趋化因子活性程序的月份来创建上皮干扰素刺激基因(ISG)的评分(图。(图3d)。PFS患者治疗后该评分显著升高 > 6. 月,但不是PFS < 6. 在患者水平分析中的几个月(除了之前显示的基因水平分析之外)(图。(图3f).3f)。作者还评估了作者最近在一项独立的scRNAseq研究中获得的人类CRC恶性上皮特异性ISG程序的评分,该程序与活化和慢性刺激的T细胞有关28。同样,PFS患者 > 6. 月的患者在第15天的评分(pEpiTd19-ISG)显著增加,而PFS患者 < 6. 几个月没有(图3g。图5)。
优化的MAPK抑制作用增强免疫反应
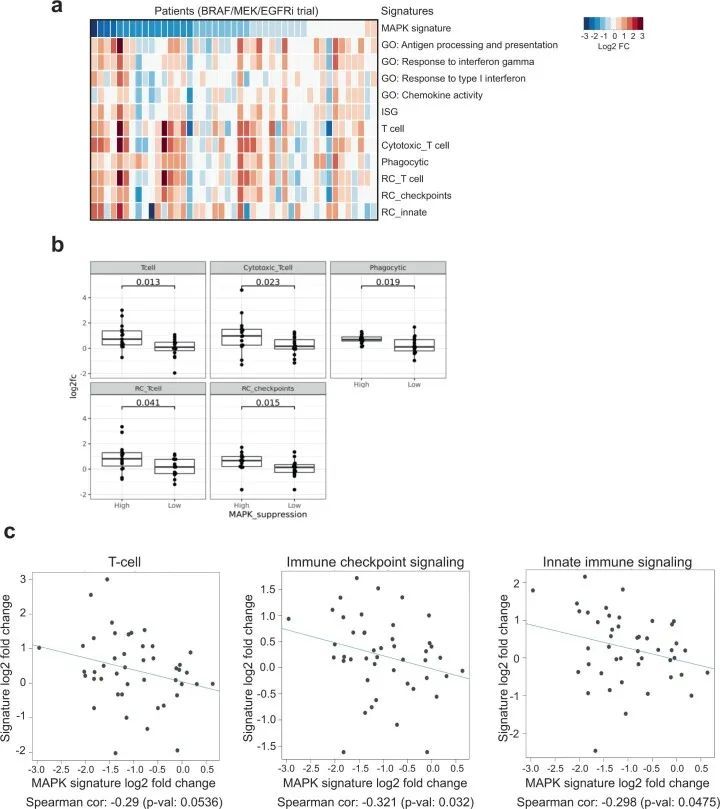
因此,作者假设在肿瘤细胞中实现的MAPK抑制程度可能与肿瘤内在诱导免疫基因表达的程度直接相关。因此,作者评估了在先前仅使用BRAF靶向治疗的BRAFV600E CRC患者中单独使用BRAF/MAPK通路抑制的效果。作者分析了来自BRAF/MEK/EGFR抑制12,25的先前临床试验的BRAFV600E CRC患者的45对预处理和治疗(第15天)活检的RNAseq数据。值得注意的是,在第15天,几种免疫信号的诱导与MAPK通路抑制的程度相关(图6a)。其中包括T细胞和细胞毒性特征、免疫检查点信号和吞噬特征(图6b)。此外,作者还发现,在治疗和预处理活检中,MAPK抑制程度和免疫特征诱导之间存在相关性,包括T细胞、免疫检查点和先天免疫反应特征(图6c)。在具有更大程度MAPK通路抑制的BRAFV600E CRC患者中观察到免疫特征的更大增加,这一事实支持了肿瘤细胞中MAPK抑制程度可能驱动免疫基因诱导和肿瘤免疫反应的假设。
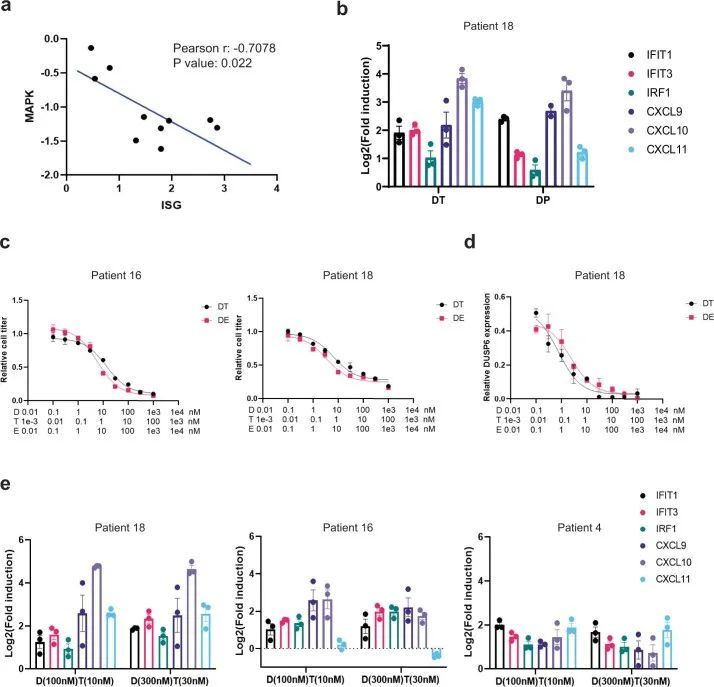
为了评估MAPK抑制和肿瘤细胞内特异性免疫程序诱导之间的潜在关系,作者使用了从10名患者(包括5名PFS患者)的基线肿瘤活检中成功生成的患者衍生的类器官模型 > 6. 月和5个PFS < 6. 月。用DT处理类器官,并通过定量聚合酶链式反应(qPCR)测量基因表达。PFS患者的类器官 > 6. 与PFS患者的类器官相比,几个月内参与IFN反应的基因(IFIT1、IFIT2、IFIT3和IRF1)和趋化因子活性(CXCL9、CXCL10和CXCL11)的表达增加更大 < 6. 月(图。(图4a,4a,左)。重要的是,PFS患者的类器官 < 6. 在用DT治疗后,几个月也显示出较小程度的MAPK通路抑制(通过平均DUSP6、ETV4、ETV5和SPRY4-log2FC计算)(图。(图4a,4a,左)。ISG诱导的程度与MAPK抑制的程度显著相关(图7a)表明MAPK通路抑制不足可能解释ISG上调的差异。值得注意的是,DT在两组类器官中对ISG的诱导和MAPK的抑制程度不同(PFS > 6. 月或PFS < 6. 月)反映了从来自相同组的患者的肿瘤上皮区室的scRNAseq分析中观察到的差异。类似地,通过RNAseq对DT处理的类器官的全局转录组学分析显示,在PFS患者的类器官中显著诱导了更多的免疫基因集 > 6. 月与PFS患者的类器官比较 < 6. 月(图。(图4b).4b)。同样,用达巴芬尼和抗EGFR抗体帕尼单抗治疗类器官模型也导致类似的ISG诱导(图7b)。重要的是,这些数据证实,MAPK通路抑制可以以肿瘤细胞固有的方式驱动免疫基因表达的诱导,这种方式不依赖于来自肿瘤免疫微环境的刺激,因为类器官培养物仅包含肿瘤细胞,而不包含来自肿瘤微环境的免疫或基质细胞。这些数据还提供了进一步的相关证据,表明MAPK抑制的程度可能与免疫基因诱导的程度直接相关。
总结
该研究的主要重点是MSS BRAFV600E CRC人群的疗效,因为这些患者对ICB的反应几乎为零,因此是最大的临床需求。然而,为MSI BRAFV600E患者保留了8个名额,以评估联合BRAF通路靶向是否可以增强MSI肿瘤对ICB的基础反应性。虽然在入选的五名MSI患者中有两名观察到了持久的反应,但这40%的ORR并没有表明临床益处增强的明确证据,剩余MSI时段的入选仍在进行中。