在日本,药物主文件(DMF)称为“主文件”或“MF”。
药物主文件(DMF)系统允许活性药物成分(API)的制造商向日本审查机构(PMDA)提交API的详细信息(制造方法、数据等)。注册信息(制造方法、数据等)作为使用原料药的医药品审批审查的必要信息。
DMF在对引用DMF的药品进行批准审查时进行审查。在DMF注册时,PMDA会检查其是否以正确的格式编写,例如,包括最低要求项目(申请)和附加数据(CTD M3)。

DMF的目的是保护原料药生产方法的“专有技术”免受药品上市许可申请人(MAA)/持有人(MAH)的影响。DMF不是专利。国外原料药生产企业可申请DMF注册。但外国制造商不能直接向PMDA申请。在日本任命“DMF的国内看护人”在PMDact中是必不可少的。DMF持有人、国内看守人和相关人员必须了解日本的法规和指南。
PMDact ...《药品、医疗器械、再生和细胞治疗产品、基因治疗产品、化妆品质量、功效、安全保障法》
当我们考虑引用DMF的药品批准申请的审查过程时,MAA/MAH、DMF持有人和国内看护人需要相互沟通。在日本的相关管理程序等中发挥重要作用的DMF的国内看护人。在各方的配合下,PMDA对提交的产品申请进行审查,充分考虑目标审查时间。目标审评时间是指总审评时间或监管审评时间。PMDA在其网站上发布了最新的年度报告,其中披露了该机构的经营业绩(目标审查时间)。
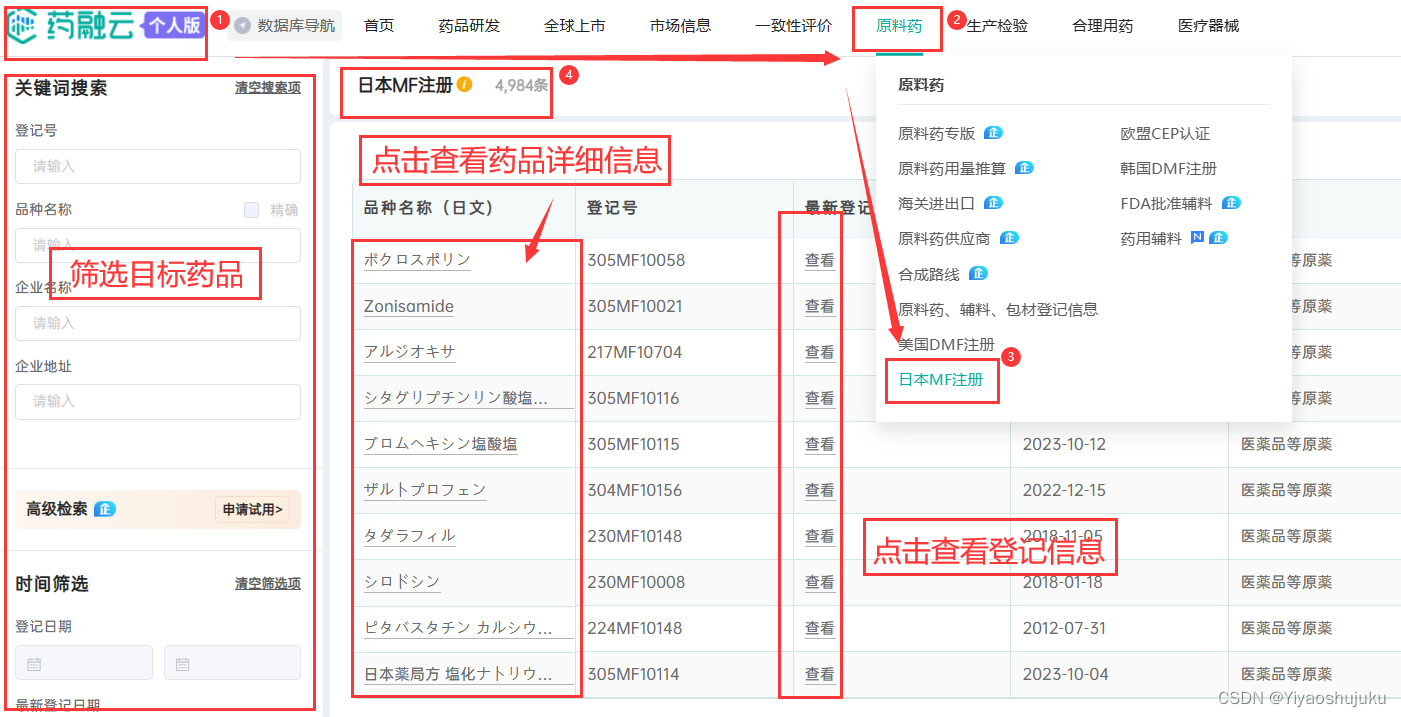
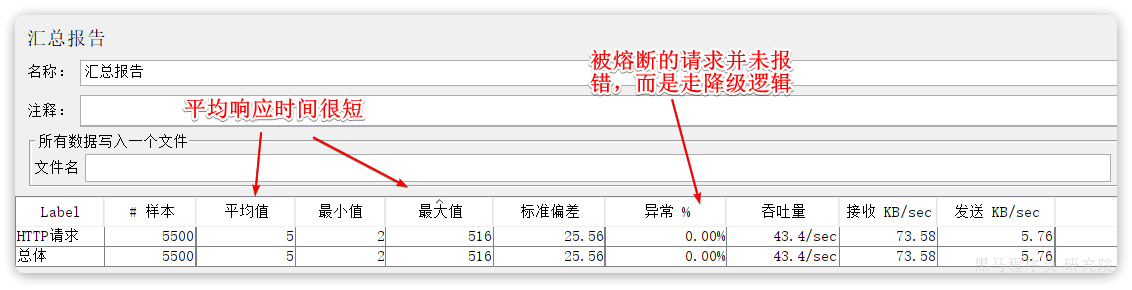
如果是想在国内高效的了解国内外药企对原料药、中间体、制剂原料、药用添加剂(公定书收载品以外的品种)备案情况,推荐使用药融云-日本MF注册数据库。
药融云-日本MF注册数据库是免费开放的数据库,是根据PMDA官网发布的数据整理而成,是了解国内外药企对原料药、中间体、制剂原料、药用添加剂(公定书收载品以外的品种)备案情况的得力工具。本数据库查询方式灵活,您可以在本数据库查到哪些原料厂家进行了MF备案注册,以及相关备案项目名称、MF注册号、登记科、首次注册时间、最新注册时间注册企业等信息。
查询网址:https://data.pharnexcloud.com/9/table/225?ref=wt
查看路径:药融云-->原料药-->日本MF注册数据库