发表单位:瑞士分子健康科学研究所
期 刊 :Cell Reports(IF:8.8)
发表日期:2023年8月29日
研究技术:ATAC-seq、ChIP-seq 、RNA-seq、scRNA-seq(爱基百客均可以提供)
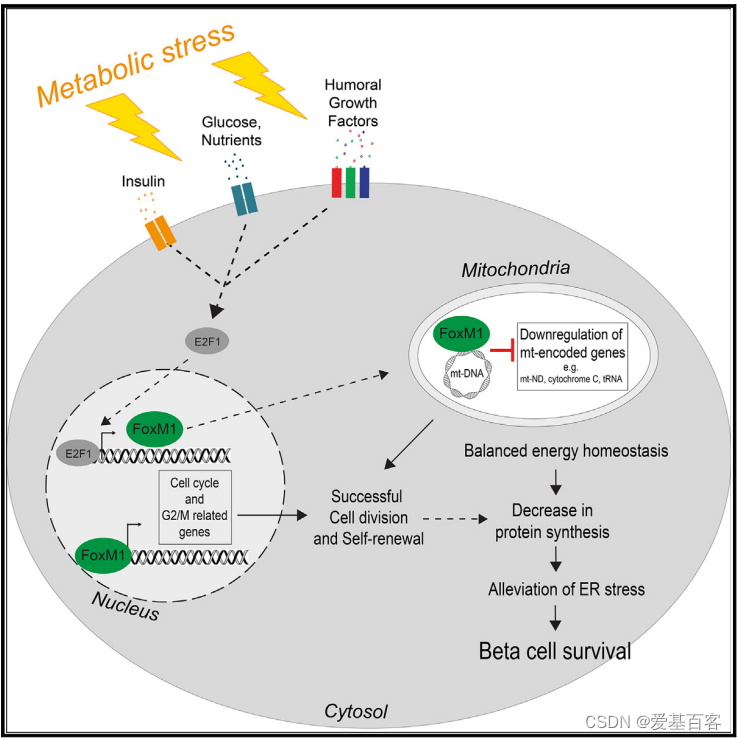
2023年8月,瑞士分子健康科学研究所的研究团队在Cell Reports期刊(IF=8.8)上发表了题为“FoxM1 coordinates cell division, protein synthesis, and mitochondrial activity in a subsetof b cells during acute metabolic stress”的文章。研究人员通过ATAC-Seq、ChIP-Seq和单细胞RNA-seq等技术,揭示了代谢应激可快速激活FoxM1等关键转录因子,FoxM1通过直接抑制线粒体编码基因,调节蛋白质合成、内质网应激和线粒体活性,从而影响增殖和静止的胰腺β细胞。
01 研究背景
胰腺β细胞是一种长寿的终末分化细胞,对维持葡萄糖稳态至关重要。它们可以通过增加胰岛素的产生、分泌或扩大β细胞质量来适应代谢需求。在严重的代谢应激过程中,β细胞表现出功能受损、胰岛素含量下降、去分化,并最终导致β细胞死亡或增殖。影响β细胞复制的细胞内过程包括胰岛素的产生、β细胞的成熟度、未折叠蛋白反应(UPR)和内质网应激。FoxM1是出生后的关键转录因子,调节出生后β细胞的周转和增殖,在高代谢需求或损伤时维持β细胞的质量,虽然FoxM1在细胞周期进程中已经得到了深入的研究,但对其他功能的研究较少。
本研究中,作者采用成年小鼠β细胞补偿的急性胰岛素抵抗模型,研究染色质重塑和基因表达的时间序列,观察到染色质重组具有显著的早期可塑性,以及控制细胞分裂和蛋白质合成的增殖β细胞(PβCs)的独特转录和功能特征。重要的是,作者发现FoxM1调节蛋白质翻译、内质网应激反应、线粒体生物发生和β细胞活性。
02 研究思路
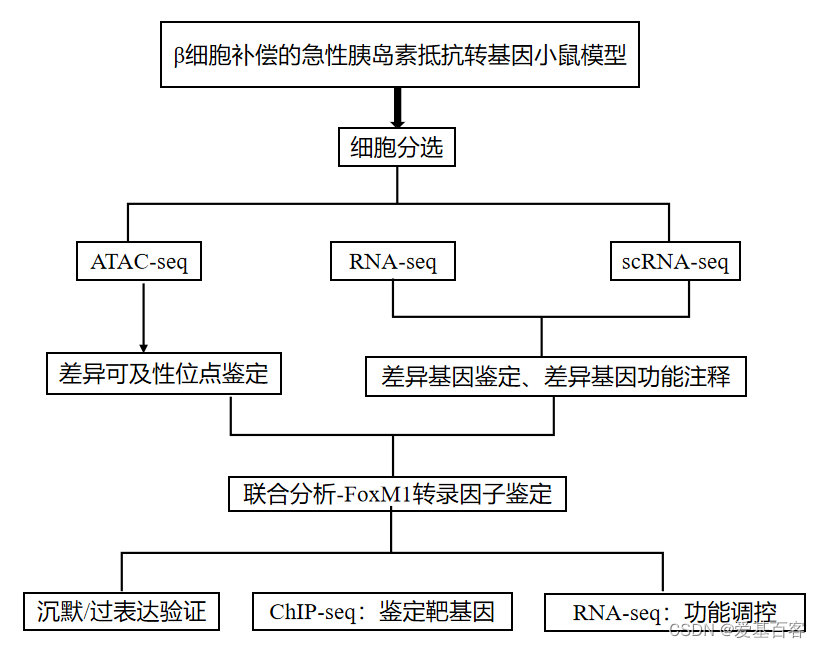
03 研究结果
⑴. 急性代谢应激诱导β细胞可塑性、内质网应激、蛋白质合成和增殖的变化
为了研究早期代谢应激过程中β细胞功能的时间异质性,作者用PBS或胰岛素受体拮抗剂S961处理小鼠胰岛素1(Ins1)基因启动子控制下表达绿色荧光蛋白(Ins1-GFP)的转基因小鼠24h或72h,诱导高血糖和胰岛素抵抗(图1.A),然后通过流式细胞术分析β细胞粒度,发现在S961给药24小时后,作者观察到两个异质的β细胞亚群:一个高粒度群体(称为S24H),类似于来自PBS对照小鼠(P72H)的β细胞,以及一个较低粒度的新群体(称为S24L)(图1.A),重要的是,S24H细胞在72 h后转化为低粒度的细胞群(图1.A,B)。为了探究粒度的减少是否由于细胞内胰岛素的消耗,作者检测了分选的P72H、S24L、S24H和S72L细胞的胰岛素含量。与PBS相比,S961作用72 h后,S72L细胞中的胰岛素含量明显降低(图1.C),此外,S24L细胞分泌的胰岛素明显少于S24H β细胞(图1.D)。这种异质粒度和胰岛素释放的显著变化显示了不同的分子和功能β细胞亚群。
接下来作者对P72H、S24L、S24H和S72L细胞进行了RNA-seq(图1.E),结果显示,S961处理的β细胞中细胞质、线粒体40S/60S核糖体蛋白(RPs)和真核翻译起始因子(eIF)转录本成分水平的增加(图1.F-I),此外,作者还发现在S961处理诱导了UPR通路相关基因的差异表达(图1.J),并且S72L细胞中涉及“DNA复制”和“细胞周期”以及与胰岛素合成相关的基因转录本的表达增加(图1.K,L)。这些结果表明,在代谢应激过程中,胰岛素分泌下降的早期β细胞首先启动了一个指示细胞周期进入和增殖的转录特征。
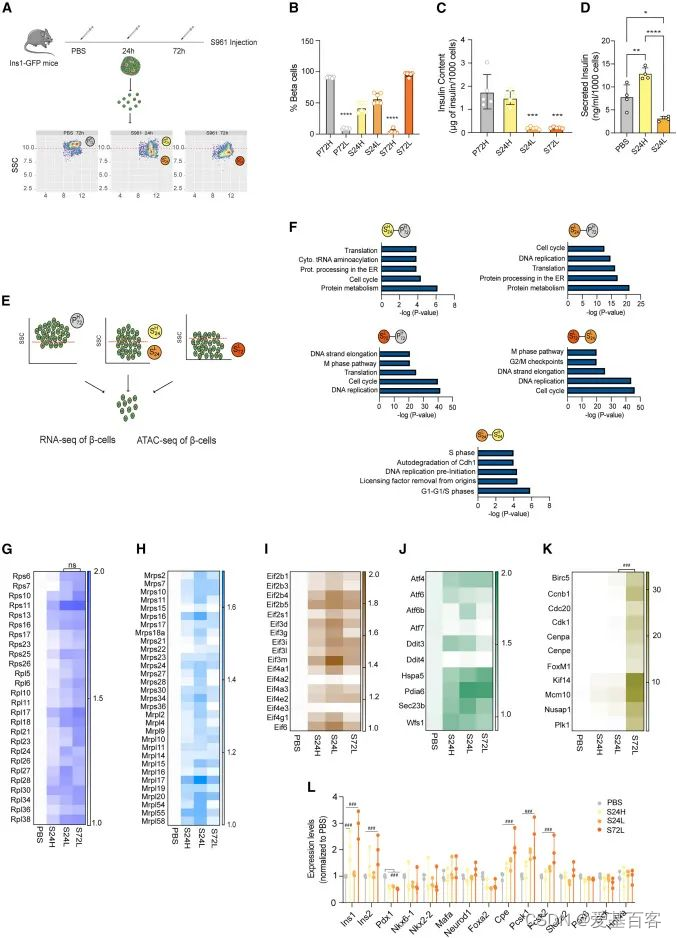
图1.早期代谢应激诱导β细胞可塑性、内质网应激、翻译和增殖的变化
⑵. 染色质可及性的变化是对代谢应激的早期反应
为了更好地了解转录调控,作者对转基因Ins1-GFP小鼠的P72H、S24L、S24H和S72L β细胞亚群进行了ATAC-seq,对不同细胞群中差异可及性(DA)位点总数的分析显示,S24L和S72L群体中的DA位点多于P72H和S24H群体(图2.A),大多数可及位点主要发生在靠近TSS的启动子区域(图2.B),而难接近的区域出现在基因间区域或内含子中(图2.C)。接下来作者对RNA-seq和ATAC-seq进行了联合分析,发现在S24H和S24L细胞中“内质网中的蛋白质加工”和“未折叠蛋白质反应”通路富集(图2.D),与UPR反应相关的基因的启动子染色质可及性和RNA转录水平上调(图2.E,F)。在S72L细胞中鉴定出与“细胞周期”、“DNA复制”和“M期途径”通路的富集(图2.G),相关基因的启动子染色质可及性和RNA转录水平上调在S72L细胞表达上调(图2.H,I)。
为了在蛋白水平上证实RNA-seq和ATAC-seq的结果,作者通过在新生蛋白中加入嘌呤霉素来检测蛋白质合成,然后分离小鼠胰岛进行WB,结果显示,与PBS相比,S961处理后24小时内翻译已经增加,而72 h后蛋白质合成速率下降(图2.J),表明24 h后翻译被部分阻断,FACS分选结果显示蛋白质合成的增加主要发生在S24H细胞中(图2.K,L)。WB的结果还显示与UPR反应相关的Hspa5和eIF2a-Ser51磷酸化的蛋白水平在S961处理72h后表达增加,与转录组测序结果一致(图2.J)。ATAC-seq结果显示,S72L细胞中与线粒体功能相关基因的启动子可及性降低(图2.M,N),而且ATP水平在24 h时升高,72 h时下降(图2.O),表明了ATP水平和蛋白质合成速率之间的相关性。这些结果表明应激信号与染色质可及性和转录之间有很强的协调性,在急性代谢应激期间控制着异质β细胞群的蛋白质合成。
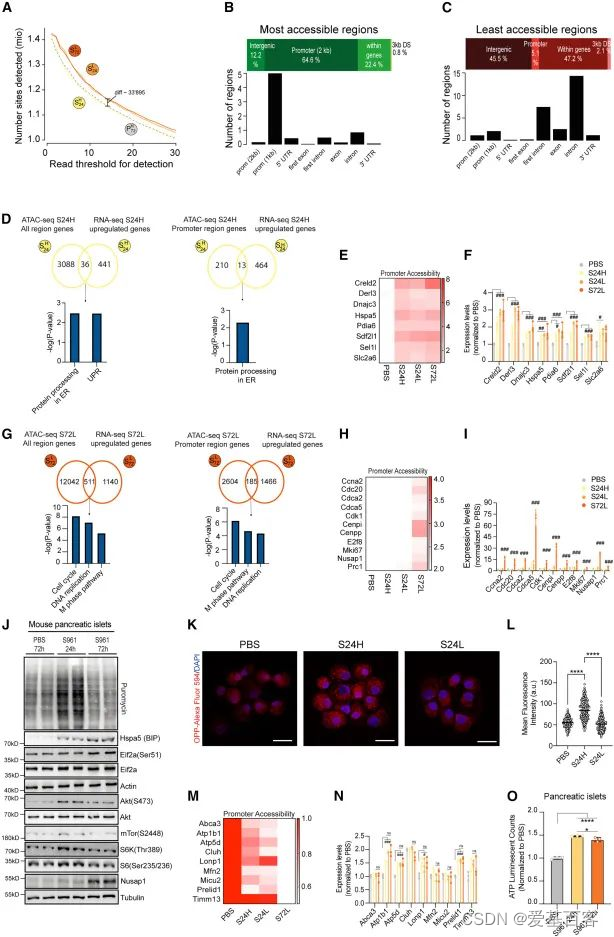
图2.染色质可及性的变化是对代谢应激的早期反应
⑶. 不同的转录和功能特征控制着增殖β细胞中的蛋白质合成
之前的研究结果表明,胰岛素分泌、蛋白质合成、线粒体功能和β细胞增殖之间存在时间协调的联系,在S72L细胞中,整体翻译和能量供应下降。为了研究在β细胞异质性的背景下,β细胞增殖对蛋白质合成调控的影响,作者通过对S961处理72h的td-Tomato/Rip-Cre小鼠的β细胞进行分选,然后进行单细胞RNA-seq(scRNA-seq)(图3.A),结果显示,增殖标记物Mki67阳性细胞分布均匀,并不局限于特定的簇(图3.B),说明所有分化的β细胞在S961处理72 h后均具有相同的增殖和分裂潜能。与之前的结果一致,scRNA-seq结果显示PβCs中上调的基因主要富集在“细胞周期”、“DNA复制”和“M期”的途径(图3.C),与增殖标志物Birc5、Nuspa1、FoxM1和Cenpa的表达增加一致(图3.D),下调的基因主要在“翻译”和“内质网中的蛋白质加工”途径中富集(图3.C),与核糖体和ER应激相关基因的表达减少相一致(图3.E,F),此外,参与β细胞功能的基因(Ins2、Chga和Chgb)在PβCs中的表达也减少(图3.G)。
为了进一步探究PβCs的生物学特征,作者从注射了S961或PBS 72h的CcnB1- GFP转基因小鼠中分离出CcnB1-GFP+细胞,然后与td-Tomato/Rip-Cre小鼠的β细胞通过scRNA-seq进行比较(图3.H),作者通过检测增加的CcnB1、Mki67以及有丝分裂和胞质分裂相关的转录本,证实了分选的细胞确实具有增殖能力(图3.I,J),免疫荧光染色显示有丝分裂标记物磷酸化组蛋白3(H3-Ser10)在用S961处理的小鼠胰腺组织切片的β细胞中也增加了(图3.K),接下来,作者检测了增殖的CcnB11细胞中被抑制的基因,发现了与“翻译”和“内质网蛋白质加工”相关的类似富集基因集(图3.L-O),而且β细胞的功能标记物在增殖细胞中受到抑制(图3.P),因此作者推测在有丝分裂和细胞分裂过程中,蛋白质的合成和能量供应可能会减少,作者使用了两种药物处理细胞,Ro3306,CDK1抑制剂,在G2/M过渡阶段阻止细胞周期,PTF-α,P53抑制剂,促进G2/M过渡和细胞分裂(图3.Q),作者发现在Ro3306处理的细胞中,ATP水平和蛋白质合成增加,而PTF-α处理的β细胞则引起了相反的反应(图3.R,S),单细胞的ATP水平在G1期逐渐增加,G2期达到最高水平,细胞分裂后急剧下降(图3.T,U)。这些结果揭示了在有丝分裂过程中,PβCs的ATP水平和蛋白质合成的降低。
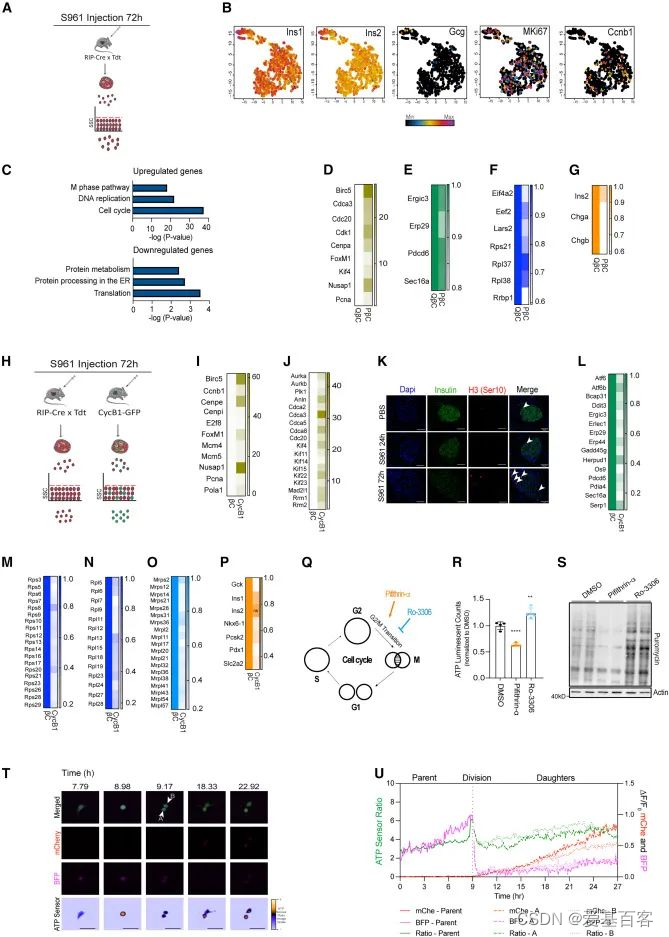
图3.不同的转录和功能特征控制着增殖β细胞中的蛋白质合成
⑷. FoxM1调节蛋白质合成和ER应激反应
为了确定在β细胞增殖和代谢应激过程中可能作为内质网应激、蛋白质合成和增殖的主调控因子的特定转录因子,作者对整体和单细胞的RNA-seq数据进行了ChEA分析,发现FoxM1是最丰富的转录因子(图4.A),s961处理的小鼠胰岛中FoxM1蛋白水平显著上调(图4.B,C),WB分析嘌呤霉素标记的胰岛显示,过表达FoxM1时,胰岛中的蛋白合成减少(图4.D),另外FoxM1沉默时,蛋白质合成增加(图4.E),这些结果表明,FoxM1可以调节β细胞中的蛋白质合成。TG处理的FoxM1沉默的Min6细胞显示eIF2a-Ser51磷酸化水平升高,Caspasase-3水平升高,表明凋亡率更高(图4.F),而过表达FoxM1具有保护作用(图4.G),表明β细胞中FoxM1的激活是缓解内质网应激所必需的。
为了进一步探究FoxM1、内质网应激与蛋白质合成之间的联系,接下来作者对过表达FoxM1或GFP的小鼠的胰岛进行了RNA-seq,结果显示,FoxM1过表达后DNA复制基因增加(图4.H),而与β细胞功能有关的基因仅轻微降低(图4.I),与内质网应激相关的基因表达降低(图4.J),线粒体转录本水平降低(图4.K,L),13个ATP合酶转录本(图4.M)和16个NADH:泛素氧化还原酶复合物(图4N)表达下调,这些发现揭示了FoxM1水平与线粒体基因表达之间广泛的反向关系。为了探究FoxM1除了调控核基因外,是否也转录控制线粒体编码基因,作者通过免疫荧光分析发现,GFP-FoxM1蛋白定位于线粒体、细胞质和细胞核(图4.O),WB的结果显示内源性的FoxM1在线粒体中高表达(图4.P)。
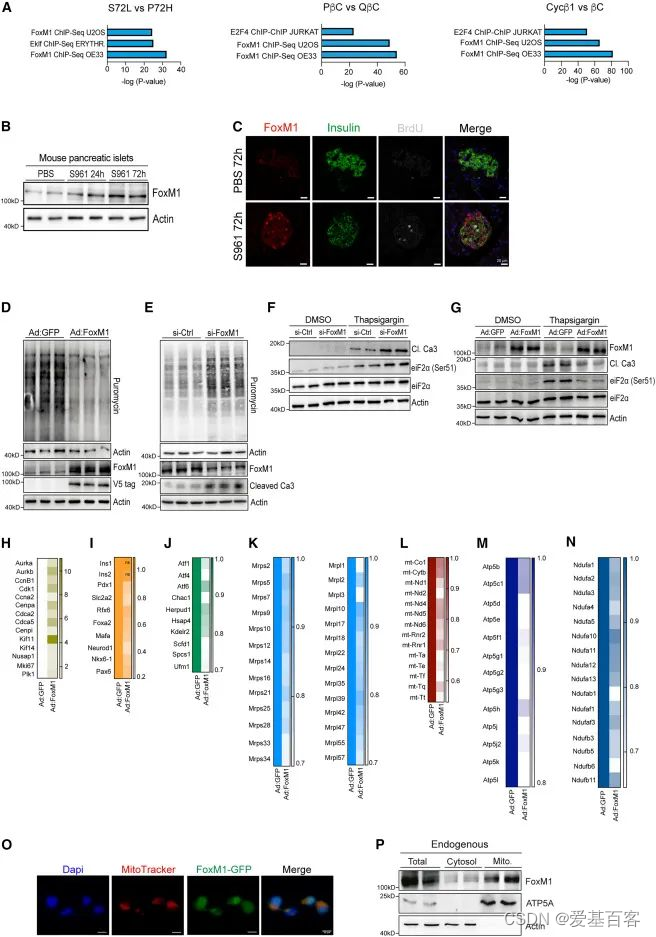
图4.FoxM1调节蛋白质合成和ER应激反应
⑸. FoxM1调控线粒体编码基因的转录,控制线粒体的生物发生和功能
为了探究FoxM1在线粒体代谢中的作用,作者检测了过表达FoxM1时β细胞中的耗氧量,结果显示耗氧量下降(图5.A,B),ATP水平也有所降低(图5.C,D),在FoxM1沉默的细胞中,ATP水平升高(图5.E)。而且FoxM1的过表达降低了线粒体DNA的拷贝数,沉默FoxM1后线粒体DNA的拷贝数又增加(图5.F,G)。WB的结果显示,FoxM1过表达时,Min6细胞中线粒体和胞质部分的翻译率都有所下降(图5.H-J)。为了更好地理解FoxM1如何调节翻译的机制,作者在Min6细胞中过表达V5标签标记的FoxM1,然后进行ChIP-seq,作者发现FOXM1广泛而不均匀地结合在整个线粒体基因组的正向和反向链上(图5.K)。另外作者通过与人类β细胞的scRNA-seq数据对比,发现在表达FoxM1的β细胞中,有59个基因显著下调,其中7个是线粒体编码基因(图5.L),GO分析显示下调的基因主要富集在与线粒体功能相关的通路(图5.M)。这些数据表明FoxM1可以调控线粒体编码基因的转录,控制线粒体的生物发生和功能。
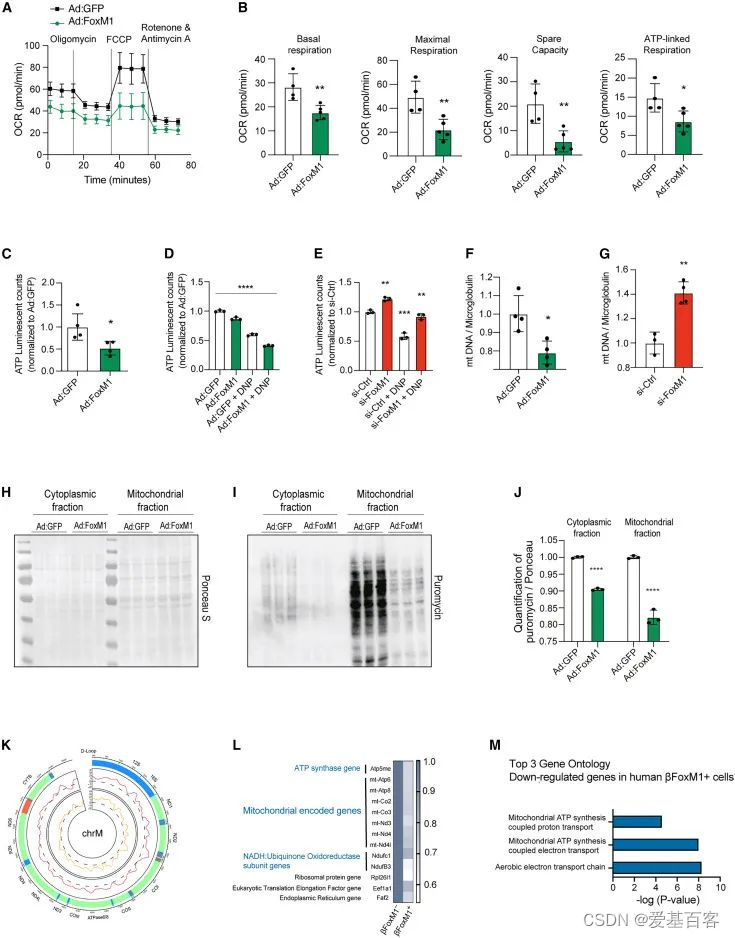
图5.FoxM1调控线粒体编码基因的转录,控制线粒体的生物发生和功能
04 研究结论
在本研究中,作者通过ATAC-seq、RNA-seq、scRNA-seq以及ChIP-seq等表观遗传技术,揭示了β细胞对早期代谢应激的反应特征,证明了一个UPR反应激活、蛋白质合成减少的β细胞亚群,其在胰岛素消耗后更容易增殖,通过β细胞的异质性反应来增加胰岛素分泌和刺激有丝分裂后的细胞分裂。此外,作者还发现代谢应激可快速激活FoxM1等关键转录因子,FoxM1通过直接抑制线粒体编码基因,调节蛋白质合成、内质网应激和线粒体活性,从而影响增殖和静止的β细胞。因此,增强FoxM1活性可能是维持β细胞功能的一种很有前途的治疗策略。
原文链接:
https://www.cell.com/cell-reports/fulltext/S2211-1247(23)00997-X
# 关于我们 #
爱基百客专注于提供领先表观组学服务。公司先后引入ChIP、CUT&Tag、WGBS、ATAC-seq、全转录组、10x Genomics、DNBSEQ-T7等实验平台,不断提升公司的科研服务能力。至今合作的科研客户超2000家,涵盖国内知名科研院所、高校以及相关生物企业,科研成果曾多次在Cancer Cell、Nature Communications、J HEMATOL ONCOL、Plant Cell 等国际高水平学术期刊发表,受到了客户广泛好评,是国内成长最迅速的高通量测序科研服务企业之一。