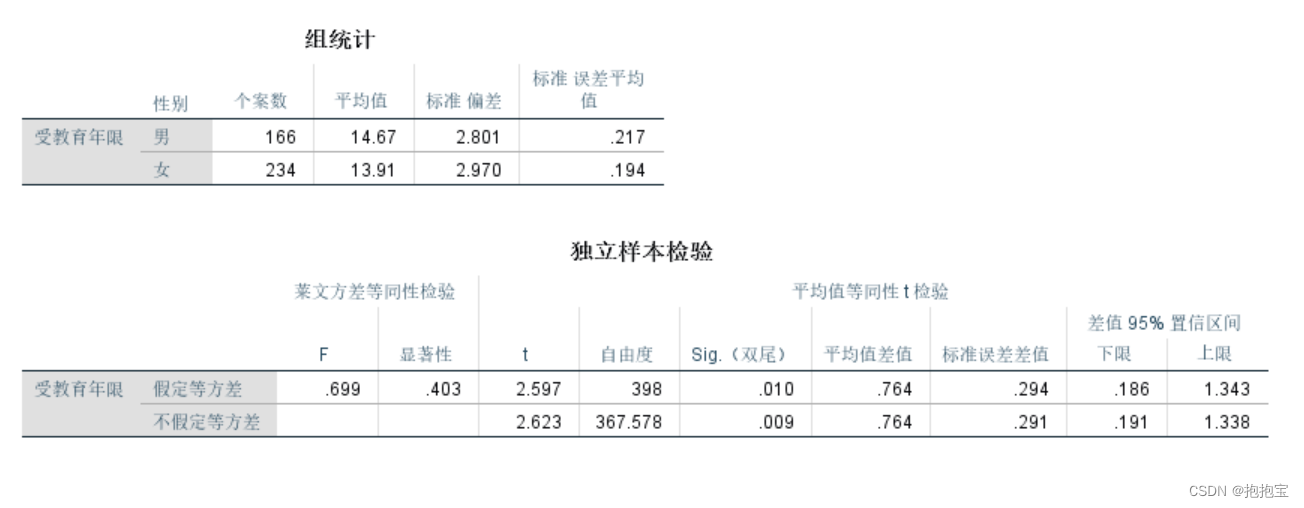
今天给同学们分享一篇单细胞+预后模型的生信文章“Integrating single-cell and bulk RNA sequencing to predict prognosis and immunotherapy response in prostate cancer”,这篇文章于2023年9月20日发表在Scientific Reports期刊上,影响因子为4.6。

前列腺癌(PCa)主要是一种发生在前列腺腺体的上皮恶性肿瘤,是全球男性最常见的癌症之一。尽管PCa的原因尚不清楚,但研究表明年龄、家族史、种族和基因调控等因素都与其发展有关。
1. CAF的识别
该研究的工作流程总结如图1所示。作者对scRNA-seq数据进行了细胞周期效应去除、归一化、降维和聚类分析,tSNE图显示了不同聚类的分布情况(图2A)。气泡图显示了每个聚类中标记基因的表达水平(图2B),作者对这些聚类进行了细胞注释(图2C)。作者提取了成纤维细胞并对其进行了上述分析,tSNE图显示了四个聚类的分布情况(图2D)。作者使用"FindAllMarkers"函数对每个聚类中高变异基因(logFC >= 0.5,min.pct = 0.3和diff.pct >= 0.2)进行了筛选,共鉴定出463个CAFRGs。最后,富集分析显示,聚类0主要涉及动脉形态发生、一氧化氮介导的信号转导、Rho蛋白信号转导的调节、PI3K-Akt信号通路和细胞外基质-受体相互作用;聚类1主要富集于肌肉系统过程、肌肉收缩、肌细胞分化、血管平滑肌收缩和cGMP-PKG信号通路;聚类2主要富集于细胞外基质组织、细胞外结构组织、外部包囊结构组织、补体和凝血级联反应以及金黄色葡萄球菌感染;聚类3主要富集于凋亡信号通路的调节、内源性凋亡信号通路、节律过程、细胞衰老和肌萎缩性侧索硬化症(图2E和F)。
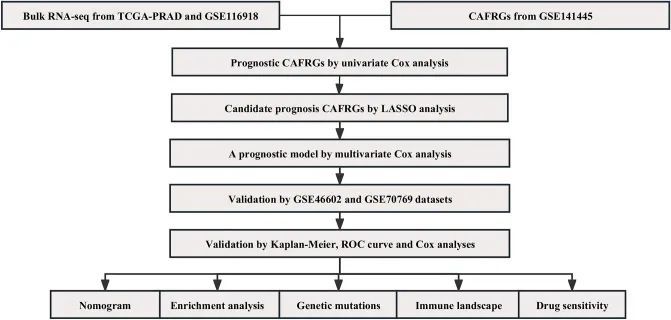
图1 整体工作流程
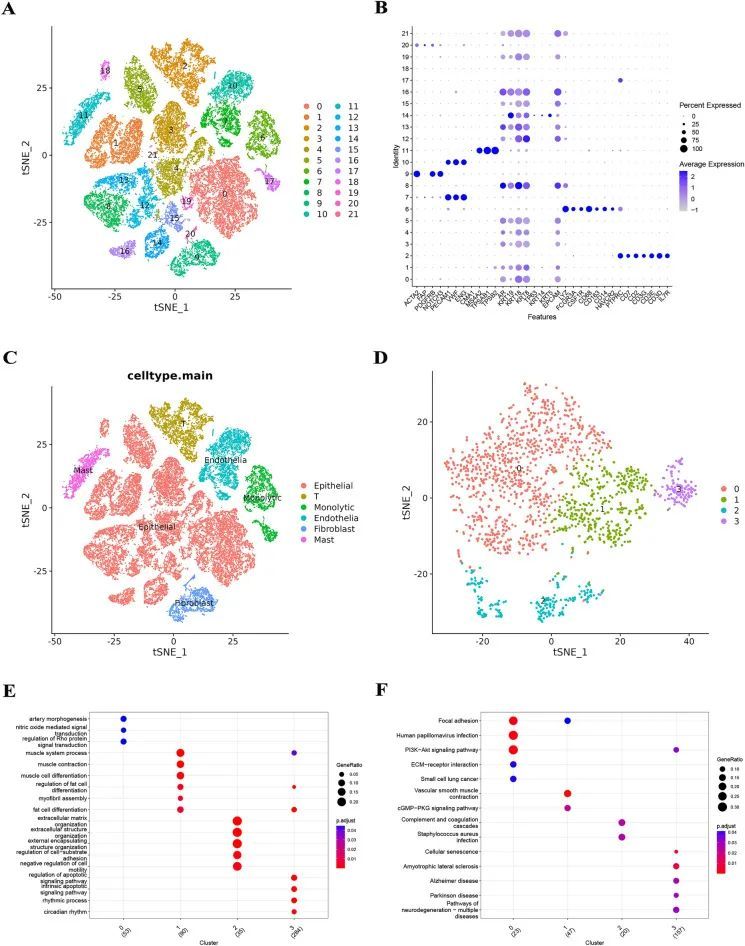
图2
2. 预测模型的构建
作者根据7:3的比例随机将整个PCa样本集分成训练集和测试集;训练集包含522个PCa样本,测试集包含220个PCa样本。单变量Cox分析筛选出29个预后相关的CAFRGs(图3A),LASSO分析进一步筛选出18个候选CAFRGs(图3B),多变量Cox分析构建了一个包含10个预后相关CAFRGs的模型(图3C)。
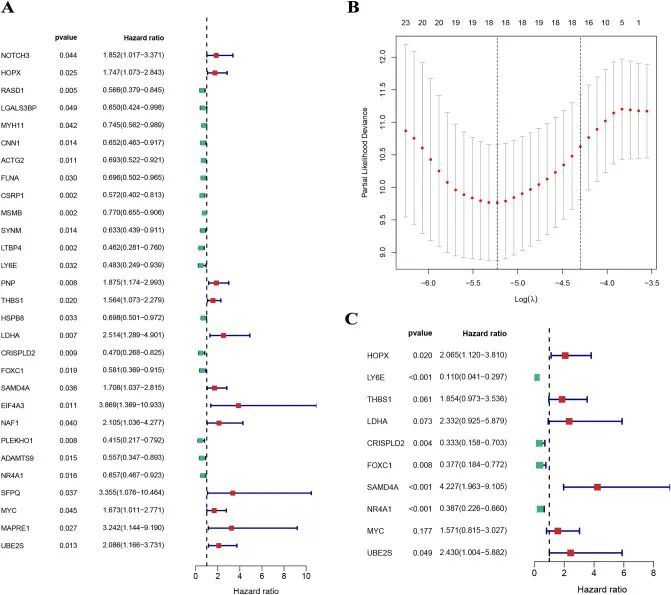
图3
3. 预后标志的验证
图4A显示,低风险组的前列腺癌患者生存率在不同的内部数据集(训练集、测试集、整体集、TCGA和GSE116918数据集)中显著较高,并且差异具有统计学意义,表明模型在内部的稳定性较高。图4B显示,高风险组的前列腺癌患者在不同的外部数据组(GSE46602、GSE70769和GSE116918数据集)中更有可能出现较高的BCR,并且差异具有统计学意义,表明该模型能够预测前列腺癌患者的预后和BCR。所有的曲线下面积(AUC)值都高于0.8,并且大于临床特征的AUC值(图5)。该模型是预测前列腺癌患者预后的独立预测因子(图6A)。为了更好地将该模型应用于临床工作,作者构建了一个结合了模型和临床特征的示意图,用于预测前列腺癌患者3年、5年和7年的生存概率,表明高风险组或低风险组对预后影响最大(图6B)。
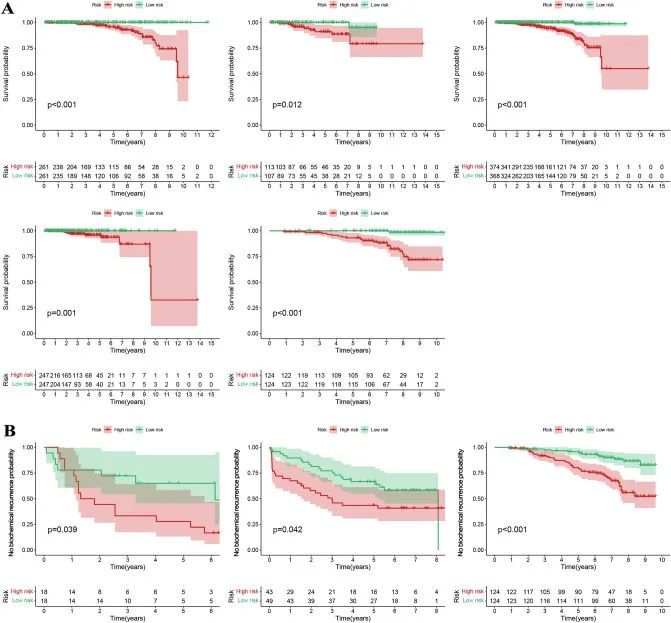
图4
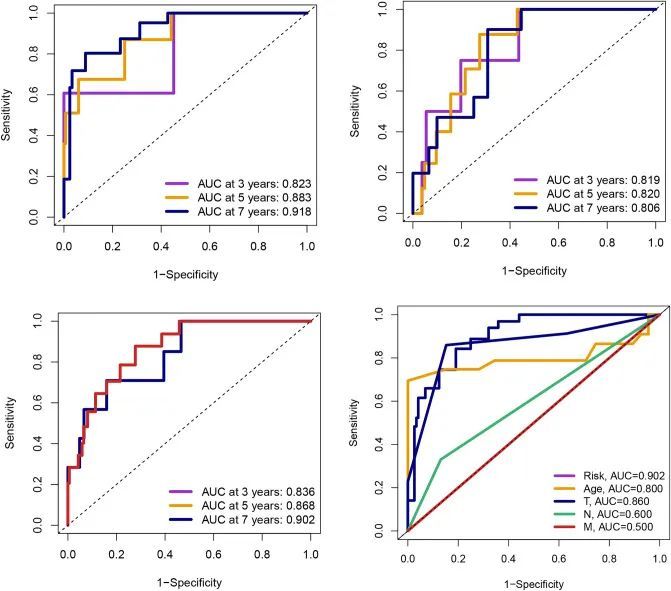
图5 所有标识的AUC值都高于0.8,并且大于临床特征的AUC值
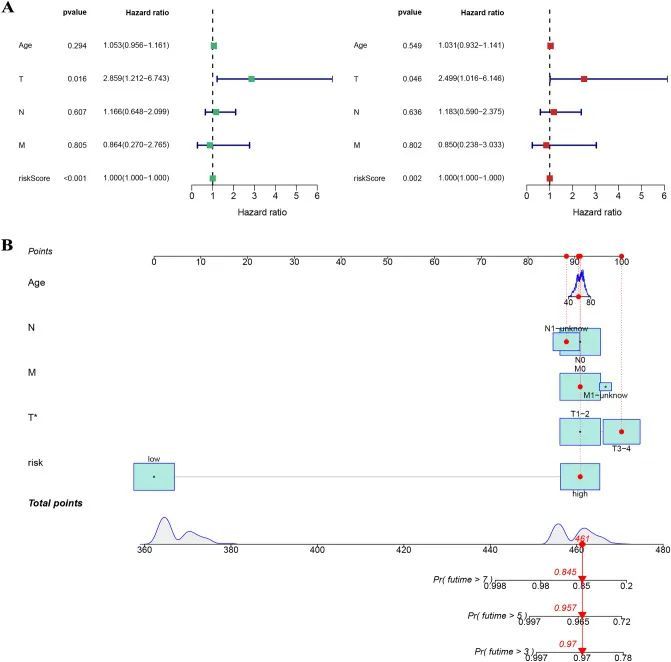
图6
4. 富集分析和突变分析
在|logFC > 1|和FDR < 0.05的阈值下,作者发现了183个差异表达基因(DEGs)。作者采用GO和KEGG分析来探索这些DEGs在前列腺癌中的作用和分子通路。生物过程(BP)术语与有丝分裂核分裂(GO:0140014)、姐妹染色单体分离(GO:0000819)和有丝分裂姐妹染色单体分离(GO:0000070)相关;细胞组分(CC)术语与肌节(GO:0030017)、肌原纤维(GO:0030016)和收缩纤维(GO:0043292)相关;分子功能(MF)术语与受体配体活性(GO:0048018)、信号受体激活活性(GO:0,030,546)和CXCR趋化因子受体结合(GO:0045236)相关(图7A)。KEGG分析显示,DEGs在IL-17信号通路(hsa04657)、阿米巴病(hsa05146)、ECM-受体相互作用(hsa04512)、类风湿性关节炎(hsa05323)、金黄色葡萄球菌感染(hsa05150)和病毒蛋白与细胞因子及细胞因子受体相互作用(hsa04061)中富集(图7B)。图7C和D显示了不同风险组中的基因突变情况,表明高风险组的突变数量明显多于低风险组,这可能与高风险组的预后不良有关。
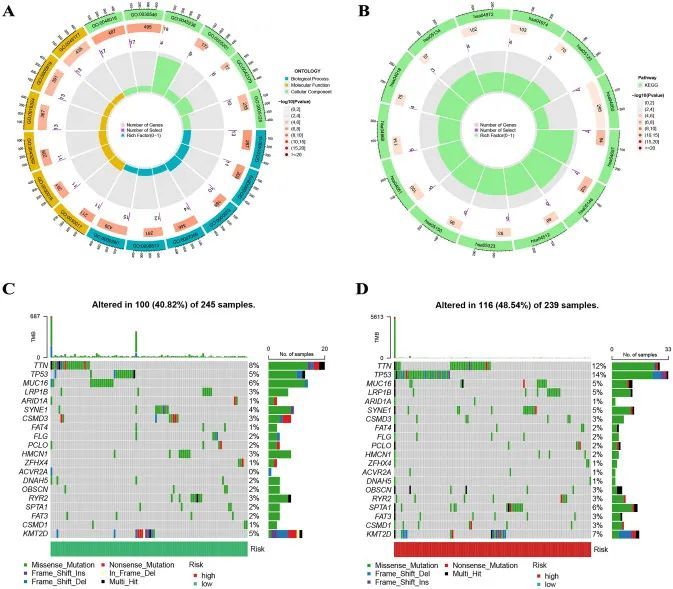
图7
5. 免疫微环境和免疫疗法
图8A显示,大多数免疫细胞浸润水平在低风险组中较高。图8B显示,除了促炎、主要组织相容性复合体I类和T细胞共刺激外,低风险组的免疫功能评分较高。CD274、LAG3和PDCD1等ICG的表达在不同风险组之间也有差异(图8C)。理论上,TMB评分越高,T细胞能够识别的新抗原越多,因此免疫治疗效果越好。高风险组的TMB评分较高,表明高风险组的患者更适合免疫治疗(图8D)。而TMB评分与风险评分的结合也是患者预后的强有力预测指标(图8E和F)。
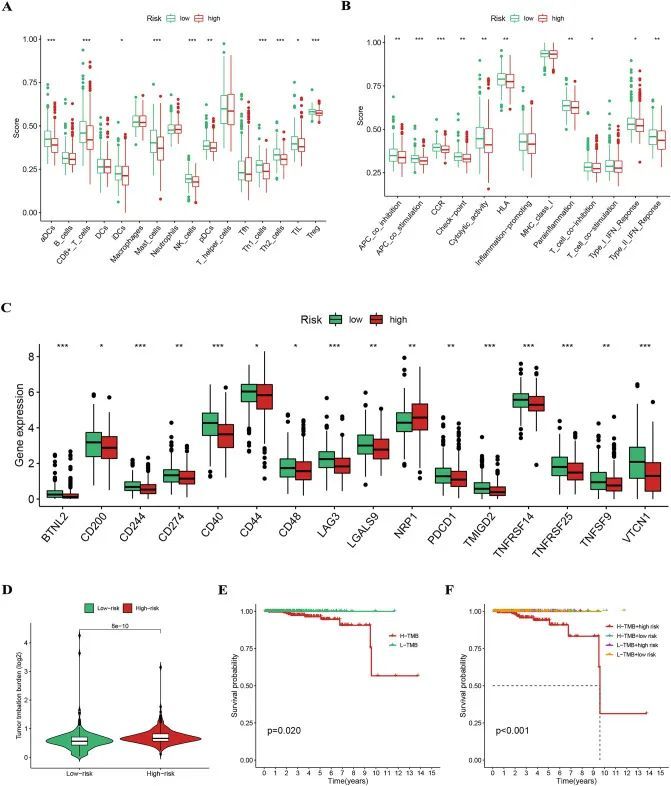
图8
6. 为不同风险群体的患者寻找抗肿瘤药物
除了免疫疗法外,化疗和靶向治疗也是前列腺癌治疗的主要策略。在本研究中,作者使用R软件包“pRRophetic”计算了不同组的IC50,并最终筛选出了31种化疗药物和靶向治疗药物(p < 0.001;图9)。
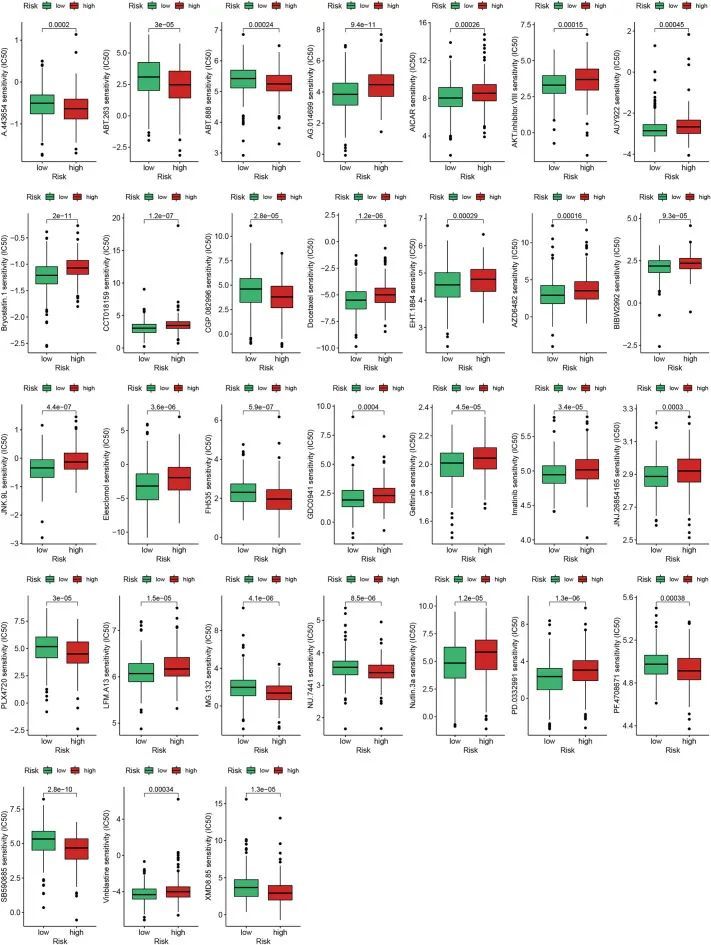
图9
总结
在这里,作者分析了前列腺癌(PCa)单细胞测序数据中的肿瘤相关成纤维细胞(CAFs),将它们分为四个聚类,并鉴定了CAFRGs。作者还基于CAFRGs构建了一个前列腺癌预后的诊断图,用于预测患者的预后和免疫治疗反应。总之,作者的研究将为前列腺癌的靶向治疗提供新的临床视角,并更好地预测患者的预后结果。